1,5-Ciclooctadieno - 1,5-Cyclooctadiene

|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
Cycloocta-1,5-diene |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| Abreviações | 1,5-COD |
| 2036542 1209288 ( Z , Z ) |
|
| ChemSpider | |
| ECHA InfoCard |
100,003,552 |
| Número EC | |
| Malha | 1,5-ciclooctadieno |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
| Número ONU | 2520 |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 8 H 12 | |
| Massa molar | 108,184 g · mol −1 |
| Aparência | Líquido incolor |
| Densidade | 0,882 g / mL |
| Ponto de fusão | -69 ° C; -92 ° F; 204 K |
| Ponto de ebulição | 150 ° C; 302 ° F; 423 K |
| Pressão de vapor | 910 Pa |
|
Índice de refração ( n D )
|
1.493 |
| Termoquímica | |
|
Capacidade de calor ( C )
|
198,9 J K −1 mol −1 |
|
Entropia molar padrão ( S |
250,0 J K −1 mol −1 |
| 21–27 kJ mol −1 | |
| −4,890 - −4,884 MJ mol −1 | |
| Perigos | |
| Pictogramas GHS |
 
|
| Palavra-sinal GHS | Perigo |
| H226 , H304 , H315 , H317 , H319 , H334 | |
| P261 , P280 , P301 + 310 , P305 + 351 + 338 , P331 , P342 + 311 | |
| Ponto de inflamação | 32 a 38 ° C (90 a 100 ° F; 305 a 311 K) |
| 222 ° C (432 ° F; 495 K) | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Cycloocta-1,5-diene é um hidrocarboneto cíclico com a fórmula química C 8 H 12 ; especificamente [- (CH
2)
2–CH = CH–] 2 .
Existem três isômeros configuracionais com esta estrutura, que diferem pelo arranjo das quatro ligações simples C – C adjacentes às ligações duplas. Cada par de ligações simples pode estar no mesmo lado ( cis , Z ) ou em lados opostos ( trans , E ) do plano da ligação dupla; as três possibilidades são indicadas como cis, cis , trans, trans e cis, trans ; ou ( Z, Z ), ( E, E ) e ( Z, E ). (Devido à simetria geral, trans, cis tem a mesma configuração que cis, trans .)
Geralmente abreviado como COD, o isômero cis, cis deste dieno é um precursor útil para outros compostos orgânicos e serve como um ligante na química organometálica . É um líquido incolor com um odor forte. 1,5-Ciclooctadieno pode ser preparado por dimerização de butadieno na presença de um catalisador de níquel, um coproduto sendo vinilciclohexeno . Aproximadamente 10.000 toneladas foram produzidas em 2005.
Reações orgânicas
COD reage com borano para dar 9-borabiciclo [3.3.1] nonano , comumente conhecido como 9-BBN, um reagente em química orgânica usado em hidroborações :
COD adiciona SCl 2 (ou reagentes semelhantes) para dar 2,6-dicloro-9-tiabiciclo [3.3.1] nonano:
O dicloreto resultante pode ser modificado adicionalmente como o derivado di azida ou di ciano em uma substituição nucleofílica auxiliada por assistência anquimérica .
Complexos de metal
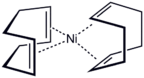
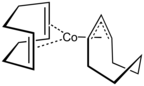
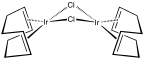
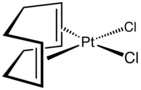
- Complexos de metal 1,5-COD selecionados.
O complexo Rh 2 (COD) 2 Cl 2 .
1,5-COD liga-se a metais de baixa valência por meio de ambos os grupos alcenos. Os complexos de metal-COD são atraentes porque são suficientemente estáveis para serem isolados, muitas vezes sendo mais robustos do que os complexos de etileno relacionados. A estabilidade dos complexos COD é atribuída ao efeito quelato . Os ligantes COD são facilmente substituídos por outros ligantes, como as fosfinas.
Ni (COD) 2 é preparado por redução do acetilacetonato de níquel anidro na presença do ligante, usando trietilalumínio
- 1 ⁄ 3 [Ni (C 5 H 7 O 2 ) 2 ] 3 + 2 COD + 2 Al (C 2 H 5 ) 3 → Ni (COD) 2 + 2 Al (C 2 H 5 ) 2 (C 5 H 7 O 2 ) + C 2 H 4 + C 2 H 6
O Pt (COD) 2 relacionado é preparado por uma rota mais tortuosa envolvendo o ciclo - octatetraeno de dilítio :
- Li 2 C 8 H 8 + PtCl 2 (COD) + 3 C 7 H 10 → [Pt (C 7 H 10 ) 3 ] + 2 LiCl + C 8 H 8 + C 8 H 12
- Pt (C 7 H 10 ) 3 + 2 COD → Pt (COD) 2 + 3 C 7 H 10
Um extenso trabalho foi relatado em complexos de COD, muitos dos quais foram descritos nos volumes 25, 26 e 28 de Sínteses Inorgânicas . O complexo de platina é um precursor de um complexo de etileno de 16 elétrons:
- Pt (COD) 2 + 3 C 2 H 4 → Pt (C 2 H 4 ) 3 + 2 COD
Os complexos COD são úteis como materiais de partida; um exemplo digno de nota é a reação:
- Ni (COD) 2 + 4 CO → Ni (CO) 4 + 2 COD
O produto Ni (CO) 4 é altamente tóxico, portanto, é vantajoso gerá-lo no vaso de reação quando solicitado. Outros complexos de metais de baixo-valentes de COD incluem dímero ródio ciclooctadieno cloreto , ciclooctadieno de cloreto de irídio dímero , e Fe (COD) (CO) 3 , e catalisador de Crabtree .
Os complexos M (COD) 2 com níquel, paládio e platina têm geometria tetraédrica , enquanto os complexos [M (COD) 2 ] + de ródio e irídio são quadrados planos .
( E , E ) -COD
A altamente tensa trans , trans- isómero de 1,5-ciclo-octadieno é um composto conhecido. ( E , E ) -COD foi sintetizado pela primeira vez por George M. Whitesides e Arthur C. Cope em 1969 por foto-isomerização das cis , cis composto. Outra síntese (reação de eliminação dupla de um anel de ciclooctano) foi relatada por Rolf Huisgen em 1987. A conformação molecular de ( E , E ) -COD é torcida ao invés de cadeira. O composto foi investigado como um mediador químico de clique .


![2,6-Dicloro-9-tiabiciclo [3.3.1] nonano, síntese e reações](https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/CODSCl2.png/450px-CODSCl2.png)