Efeito anomérico - Anomeric effect
Em química orgânica , o efeito anomérico ou efeito Edward-Lemieux é um efeito estereeletrônico que descreve a tendência de substituintes heteroatômicos adjacentes a um heteroátomo dentro de um anel de ciclohexano para preferir a orientação axial em vez da orientação equatorial menos impedida que seria esperada de considerações estéricas . Este efeito foi originalmente observado em anéis de piranose por JT Edward em 1955, ao estudar a química dos carboidratos .
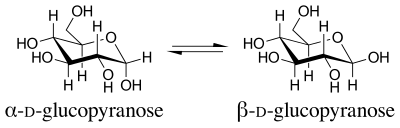
O termo efeito anomérico foi introduzido em 1958. O nome vem do termo usado para designar o carbono do anel de menor número de uma piranose, o carbono anomérico . Os isômeros que diferem apenas na configuração no carbono anomérico são chamados de anômeros . Os anômeros de D- glucopiranose são diastereômeros , com o anômero beta tendo um grupo OH apontando para cima equatorialmente, e o anômero alfa tendo esse grupo OH apontando para baixo axialmente.
O efeito anomérico também pode ser generalizado para qualquer ciclo-hexil ou sistema linear com a fórmula geral CYCX, onde Y é um heteroátomo com um ou mais pares solitários e X é um átomo ou grupo eletronegativo . A magnitude do efeito anomérico é estimada em cerca de 1–2 kcal / mol no caso dos açúcares, mas é diferente para cada molécula.
No caso acima, o grupo metoxi no anel ciclohexano (topo) prefere a posição equatorial. No entanto, no anel de tetra - hidropirano (parte inferior), o grupo metoxi prefere a posição axial. Isso ocorre porque no anel de ciclohexano, Y = carbono, que não é um heteroátomo, o efeito anomérico não é observado e os estéricos dominam a posição do substituinte observada . No anel tetrahidropirano, Y = oxigênio, que é um heteroátomo, então o efeito anomérico contribui e estabiliza a posição do substituinte observada. Em ambos os casos, X = OMe.
O efeito anomérico é mais frequentemente observado quando Y = oxigênio, mas também pode ser visto com outro par solitário contendo heteroátomos no anel, como nitrogênio, enxofre e fósforo. O método exato pelo qual o efeito anomérico causa estabilização é um ponto de controvérsia, e várias hipóteses têm sido propostas para explicá-lo.
Explicação física e controvérsia
A razão física para o efeito anomérico não é completamente compreendida. Várias explicações, em parte conflitantes, foram oferecidas e o assunto ainda não foi resolvido.
Hiperconjugação
Moléculas cíclicas
Uma explicação amplamente aceita é que há uma interação de estabilização ( hiperconjugação ) entre o par de elétrons não compartilhado no heteroátomo endocíclico (dentro do anel de açúcar) e o orbital σ * da ligação C – X axial (exocíclica). Isso faz com que a molécula alinhe o par solitário doador de elétrons antiperiplanar (180 °) com a ligação σ CX exocíclica, diminuindo a energia geral do sistema e causando mais estabilidade.
Alguns autores também questionam a validade desse modelo de hiperconjugação baseado em resultados da teoria quântica dos átomos nas moléculas . Embora a maioria dos estudos sobre os efeitos anoméricos tenham sido de natureza teórica, a hipótese n – σ * (hiperconjugação) também foi amplamente criticada com base no fato de que a redistribuição da densidade de elétrons em acetais proposta por esta hipótese não é congruente com a química experimental conhecida de acetais e, em particular, a química dos monossacarídeos.
Moléculas acíclicas
A hiperconjugação também é encontrada em moléculas acíclicas contendo heteroátomos, outra forma de efeito anomérico. Se uma molécula tem um átomo com um único par de elétrons e o átomo adjacente é capaz de aceitar elétrons no orbital σ *, ocorre hiperconjugação, estabilizando a molécula. Isso forma uma forma de ressonância "sem vínculo". Para esta sobreposição orbital para ocorrer, o trans , trans conformação é preferida para a maioria dos heteroátomos, no entanto, para a estabilização de ocorrer em dimetoximetano , o desajeitado , desajeitado conformação é de cerca de 3-5 kcal / mol mais baixa em energia (mais estável) do que o trans , conformação trans - é cerca de duas vezes maior que o efeito em açúcares porque há duas ligações giratórias (portanto, é trans em torno de ambas as ligações ou gauche em torno de ambas) que são afetadas.
Minimização de dipolo
Outra explicação aceita para o efeito anomérico é que a configuração equatorial tem os dipolos envolvendo ambos os heteroátomos parcialmente alinhados e, portanto, se repelindo. Em contraste, a configuração axial tem esses dipolos aproximadamente opostos, representando assim um estado de energia mais estável e mais baixo.
Tanto a hiperconjugação quanto a minimização de dipolo contribuem para a conformação (Z) preferida de ésteres em relação à conformação (E). Na conformação (Z), o par solitário de elétrons no oxigênio alfa pode doar para o orbital σ * CO vizinho. Além disso, o dipolo é minimizado na conformação (Z) e maximizado na conformação (E).
nn repulsões e ligações de hidrogênio CH
Se os pares de elétrons solitários nos oxigênios no centro anomérico de 2-metoxipirano forem mostrados, um breve exame das conformações dos anômeros revelará que o anômero β sempre tem pelo menos um par de eclipses (coplanar 1,3- interagindo) pares solitários, esta repulsão nn é uma situação de alta energia. Por outro lado, o anômero α possui conformações nas quais não há repulsões nn, e isso é verdade na conformação exo-anomérica. A repulsão nn energeticamente desfavorável presente no anômero β, juntamente com a ligação de hidrogênio energeticamente favorável entre o H-5 axial e um par solitário de elétrons no substituinte α-anomérico axial (ligação de hidrogênio CH / n), foi sugerida [ referências 7 e 8] para explicar a maior parte da diferença energética entre os anômeros, o efeito anomérico. O programa de mecânica molecular StruMM3D, que não é especialmente parametrizado para o efeito anomérico, estima que as contribuições dipolares para o efeito anomérico (principalmente a repulsão nn e ligações de hidrogênio CH discutidas acima) são cerca de 1,5 kcal / mol.
Influências
Enquanto o efeito anomérico é uma explicação geral para este tipo de estabilização para uma molécula, o tipo e a quantidade de estabilização podem ser afetados pelos substituintes sendo examinados, bem como pelo solvente sendo estudado.
Efeito substituinte
Em um sistema fechado, há uma diferença observada no efeito anomérico para diferentes substituintes em um anel de ciclohexano ou tetra - hidropirano (Y = Oxigênio). Quando X = OH, o efeito anomérico genérico pode ser visto, conforme explicado anteriormente. Quando X = CN, os mesmos resultados são vistos, onde a posição equatorial é preferida no anel de ciclohexano, mas a posição axial é preferida no anel de tetra-hidropirano. Isso é consistente com a estabilização do efeito anomérico. Quando X = F, o efeito anomérico é de fato observado para ambos os anéis. Porém, quando X = NH 2 , nenhuma estabilização do efeito anomérico é observada e ambos os sistemas preferem a posição equatorial. Isso é atribuído aos estéricos e a um efeito denominado efeito anomérico reverso (ver abaixo).
Efeito solvente
Uma crítica comum à teoria da hiperconjugação é que ela falha em explicar por que o efeito anomérico não é observado quando moléculas de tetra-hidropirano substituídas são colocadas em solventes polares , e a posição equatorial é mais uma vez preferida. Foi mostrado, no entanto, que a hiperconjugação depende do solvente no sistema. Cada um dos sistemas substituídos descritos acima foram testados na fase gasosa (ou seja, sem solvente) e em solução aquosa (ou seja, solvente polar). Quando X = F, o efeito anomérico foi observado em ambos os meios, sendo sempre preferida a posição axial. Isso é atribuído à hiperconjugação. Quando X = OH ou CN, o efeito anomérico foi observado na fase gasosa, quando a posição axial foi preferida. No entanto, em soluções aquosas, ambos os substituintes preferiram a posição equatorial. Isso é atribuído ao fato de que há mais repulsões eletrostáticas com o substituinte posicionado axialmente e o solvente polar, fazendo com que a posição equatorial seja preferida. Quando X = NH 2 , novamente, nenhum efeito anomérico foi observado e a posição equatorial foi sempre preferida.
Superando o efeito anomérico
Embora o efeito anomérico possa causar estabilização de moléculas, ele tem uma magnitude para sua estabilização, e esse valor pode ser superado por outros efeitos mais desestabilizadores em alguns casos.
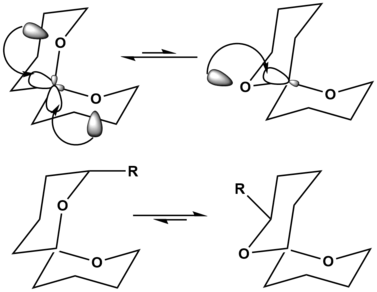
No exemplo dos espirocetais, a orientação no canto superior esquerdo mostra a estabilização pelo efeito anomérico hiperconjugativo duas vezes, estabilizando assim bastante a orientação da molécula. A orientação no canto superior direito mostra esta estabilização anomérica hiperconjugativa apenas uma vez, fazendo com que seja a estrutura menos preferida. No entanto, quando o substituinte é adicionado ao esqueleto espirocetal, a estrutura mais preferida pode ser alterada. Quando um substituinte grande é adicionado ao esqueleto espirocetal, como visto no canto inferior esquerdo, a cepa de ter este substituinte grande, R, na posição axial é muito desestabilizante para a molécula. Na molécula do canto inferior direito, R está agora na posição equatorial, o que não causa mais desestabilização na molécula. Portanto, sem substituintes, a reação de equilíbrio superior é favorecida no lado esquerdo, enquanto o equilíbrio inferior é favorecido no lado direito, simplesmente pela adição de um substituinte grande e desestabilizador.
Efeito exo anomérico
Uma extensão do efeito anomérico, o efeito exo anomérico é a preferência de substituintes saindo de um anel para adotar a conformação gauche, enquanto os estéricos sugerem que uma conformação antiperiplanar seria preferida.
Um exemplo disso é o 2-metoxitetra-hidropirano. Como o efeito anomérico prevê, o substituinte metoxi mostra uma preferência aumentada pela conformação axial. No entanto, há na verdade mais de uma conformação axial possível devido à rotação em torno da ligação CO entre o substituinte metoxi e o anel. Quando se aplica os princípios do efeito anomérico reverso, pode-se predizer que o conformador gauche é o preferido, sugerindo que a conformação superior esquerda é a melhor na figura acima. Esta previsão é apoiada por evidências experimentais. Além disso, essa preferência pela posição gauche ainda é observada na conformação equatorial.
Efeito anomérico reverso
Este termo se refere à aparente preferência de substituintes de nitrogênio carregados positivamente para a conformação equatorial além do que as interações estéricas normais poderiam prever em anéis contendo um átomo eletronegativo, como o oxigênio. Substituintes contendo carbonos com cargas positivas parciais não exibem o mesmo efeito. Explicações teóricas para o efeito anomérico reverso incluem uma explicação eletrostática e a deslocalização dos elétrons sp 3 do par anomérico de carbono e oxigênio. Há algum debate sobre se este é ou não um fenômeno real. Os substituintes contendo nitrogênio com os quais foi relatado são bastante volumosos, tornando difícil separar os efeitos normais do volume estérico e o efeito anomérico reverso, se ele existir. Por exemplo, na molécula mostrada abaixo, o substituinte piridínio prefere fortemente a posição equatorial, como os fatores estéricos poderiam prever, mas na verdade mostra uma preferência mais forte por esta conformação do que o previsto, sugerindo que o efeito anomérico reverso está contribuindo.
Efeito metaloanomérico
Os metais de transição tardia dos grupos 10, 11 e 12, quando colocados no carbono anomérico, mostram fortes preferências axiais. Este fenômeno denominado como efeito metalo-anomérico se origina da estabilização de interações hiperconjugativas entre oxigênio ou outros heteroátomos com pares solitários e orbitais anti-ligação CM que atuam como bons aceitadores. O efeito metalo-anomérico generalizado refere-se à estabilização termodinâmica de conformadores sinclinais de compostos com a fórmula geral M-CH 2 -OR. As preferências axiais / equatoriais podem ser influenciadas por ligantes anexados à configuração metálica e eletrônica. Em termos gerais, passando de um elemento mais leve para um mais pesado no grupo, a magnitude do efeito metalo-anomérico aumenta. Além disso, os estados de oxidação mais elevados favorecem os conformadores axial / sinclinal.
Aplicações sintéticas
O efeito anomérico é levado em consideração sinteticamente. Devido à sua descoberta nos açúcares, a química do açúcar e dos carboidratos é um dos usos sintéticos mais comuns do efeito anomérico. Por exemplo, a glicosidação Koenigs-Knorr instala um grupo α-OR ou β-OR em alta diastereosseletividade que é efetuada pelo efeito anomérico. Lactona sophorolipídica , (+) - Lepicidina A e (-) - Litospermosida são alguns dos produtos sintetizados através da Glicosidação de Koenigs-Knorr superando o efeito anomérico.
Veja também
- Estereoquímica Alcane
- Anômero
- Conformação de carboidrato
- Isomeria conformacional
- Conformação de ciclohexano
- Efeito Gauche
- Forças intramoleculares
- Monossacarídeo
- Raymond Lemieux
- Efeitos estéricos
Referências
links externos
-
 Mídia relacionada ao efeito anomérico no Wikimedia Commons
Mídia relacionada ao efeito anomérico no Wikimedia Commons