Receptor de hidrocarboneto aril - Aryl hydrocarbon receptor
O receptor de hidrocarboneto de arilo ( AhR ou AHR ou Ahr ou AHR ) é uma proteína que, em seres humanos é codificada pelo AHR gene . O receptor de aril hidrocarboneto é um fator de transcrição que regula a expressão gênica. Foi pensado originalmente para funcionar principalmente como um sensor de substâncias químicas xenobióticas e também como regulador de enzimas como o citocromo P450s, que metabolizam essas substâncias. Os mais notáveis desses produtos químicos xenobióticos são os hidrocarbonetos aromáticos (aril), dos quais o receptor deriva seu nome.
Mais recentemente, foi descoberto que o AhR é ativado (ou desativado) por uma série de derivados de indol endógenos , como quinurenina . Além de regular as enzimas do metabolismo, o AhR tem papéis na regulação da imunidade, manutenção das células-tronco e diferenciação celular .
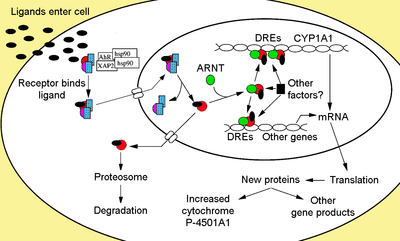
O receptor de hidrocarboneto de arilo é um membro da família de básicas hélice-ansa-hélice factores de transcrição . O AHR liga vários ligantes exógenos, como flavonóides naturais de plantas , polifenólicos e indóis , bem como hidrocarbonetos aromáticos policíclicos sintéticos e compostos semelhantes a dioxinas . AhR é um fator de transcrição citosólico normalmente inativo, ligado a várias co-chaperonas . Após a ligação do ligante a substâncias químicas como 2,3,7,8-tetraclorodibenzo- p -dioxina (TCDD), as chaperonas se dissociam resultando em AhR translocando para o núcleo e dimerizando com ARNT ( translocador nuclear AhR ) , levando a mudanças na transcrição do gene .
Domínios funcionais de proteína
A proteína AhR contém vários domínios críticos para a função e é classificada como um membro da família básica de fatores de transcrição hélice-alça-hélice / Per-Arnt-Sim (bHLH / PAS) . O motivo bHLH está localizado no terminal N da proteína e é uma entidade comum em uma variedade de fatores de transcrição . Os membros da superfamília bHLH têm dois domínios funcionalmente distintos e altamente conservados. A primeira é a região básica (b), que está envolvida na ligação do fator de transcrição ao DNA . A segunda é a região hélice-alça-hélice (HLH), que facilita as interações proteína-proteína. Também contidos no AhR estão dois domínios PAS, PAS-A e PAS-B, que são trechos de 200-350 aminoácidos que exibem uma alta homologia de sequência com os domínios de proteína que foram originalmente encontrados no período dos genes de Drosophila (Per) e obstinado (Sim) e no parceiro de dimerização do AhR, o translocador nuclear do receptor de hidrocarboneto de arila (ARNT). Os domínios PAS suportam interações secundárias específicas com outras proteínas contendo domínios PAS, como é o caso com AhR e ARNT, de modo que complexos de proteínas diméricos e heteroméricos podem se formar. O local de ligação do ligando de AhR está contido no domínio PAS-B e contém vários resíduos conservados críticos para a ligação do ligando. Finalmente, um domínio rico em glutamina (rico em Q) está localizado na região C-terminal da proteína e está envolvido no recrutamento e na transativação do coativador.
Ligantes
Os ligantes AhR foram geralmente classificados em duas categorias, sintéticos ou de ocorrência natural. Os primeiros ligantes a serem descobertos foram sintéticos e membros dos hidrocarbonetos aromáticos halogenados ( dibenzodioxinas policloradas , dibenzofuranos e bifenilos ) e hidrocarbonetos aromáticos policíclicos ( 3-metilcolantreno , benzo [ a ] pireno , benzantracenos e benzoflavonas ). Uma gama de ligantes sintéticos foi projetada para direcionar o possível tratamento futuro do câncer de mama.
A pesquisa se concentrou em compostos de ocorrência natural com a esperança de identificar um ligante endógeno. Os compostos de ocorrência natural que foram identificados como ligantes de Ahr incluem derivados de triptofano , como corante índigo e indirubina , tetrapirróis , como bilirrubina , os metabólitos do ácido araquidônico lipoxina A4 e prostaglandina G , lipoproteína de baixa densidade modificada e vários carotenóides dietéticos . Uma suposição feita na busca por um ligante endógeno é que o ligante será um agonista do receptor . No entanto, o trabalho de Savouret et al. mostrou que isso pode não ser o caso, uma vez que suas descobertas demonstram que o 7-cetocolesterol inibe competitivamente a transdução do sinal de Ahr.
A carbidopa é um modulador seletivo do receptor de hidrocarboneto de arila (SAhRM).
Indolocarbazol (ICZ) é um dos mais fortes agonistas não halogenados para AHR relatados in vitro.
Via de sinalização
Complexo citosólico
O Ahr não ligado ao ligante é retido no citoplasma como um complexo de proteína inativa que consiste em um dímero de Hsp90 , prostaglandina E sintase 3 (PTGES3, p23) e uma única molécula da proteína que interage com o receptor AH semelhante à imunofilina , também conhecida como hepatite Proteína 2 associada a X do vírus B (XAP2), proteína que interage com AhR (AIP) e 9 ativada por AhR (ARA9). O dímero de Hsp90, juntamente com PTGES3 (p23), tem um papel multifuncional na proteção do receptor da proteólise, restringindo o receptor em uma conformação receptiva à ligação do ligante e evitando a ligação prematura do ARNT . O AIP interage com o terminal carboxila de Hsp90 e se liga à sequência de localização nuclear AhR (NLS) evitando o tráfego inadequado do receptor para o núcleo.
Ativação do receptor
Após a ligação do ligante ao AhR, o AIP é liberado resultando na exposição do NLS, que está localizado na região bHLH, levando à importação para o núcleo. Presume-se que, uma vez no núcleo, a Hsp90 se dissocia, expondo os dois domínios PAS, permitindo a ligação de ARNT. O complexo de heterodímero AhR / ARNT ativado é então capaz de interagir direta ou indiretamente com o DNA, ligando-se a sequências de reconhecimento localizadas na região reguladora 5 'dos genes responsivos à dioxina.
Ligação ao DNA (elemento de resposta xenobiótica - XRE)
O motivo de reconhecimento clássico do complexo AhR / ARNT, referido como o elemento responsivo a AhR, dioxina ou xenobiótica (AHRE, DRE ou XRE), contém a sequência central 5'-GCGTG-3 'dentro da sequência de consenso 5 '-T / GNGCGTGA / CG / CA-3' na região promotora de genes responsivos a AhR. O heterodímero AhR / ARNT se liga diretamente à sequência central AHRE / DRE / XRE de uma maneira assimétrica, de modo que ARNT se liga a 5'-GTG-3 'e o AhR se liga a 5'-TC / TGC-3'. Pesquisas recentes sugerem que um segundo tipo de elemento denominado AHRE-II, 5'-CATG (N6) C [T / A] TG-3 ', é capaz de agir indiretamente com o complexo AhR / ARNT. Independentemente do elemento de resposta, o resultado final é uma variedade de mudanças diferenciais na expressão gênica.
Papel funcional na fisiologia e toxicologia
Papel no desenvolvimento
Em termos de evolução, o papel fisiológico mais antigo do AhR está no desenvolvimento. Presume-se que o AhR evoluiu de invertebrados, onde desempenhou um papel independente de ligante nos processos normais de desenvolvimento. O homólogo AhR em Drosophila , spineless (ss) é necessário para o desenvolvimento dos segmentos distais da antena e da perna. Ss se dimeriza com tango (tgo), que é o homólogo do mamífero Arnt, para iniciar a transcrição do gene. A evolução do receptor em vertebrados resultou na capacidade de se ligar ao ligante e pode ter ajudado os humanos a evoluir para tolerar a fumaça do fogo. No desenvolvimento de vertebrados, o AhR aparentemente desempenha um papel na proliferação e diferenciação celular. Apesar da falta de um ligante endógeno claro, o AhR parece desempenhar um papel na diferenciação de muitas vias de desenvolvimento, incluindo hematopoiese, sistemas linfóides, células T, neurônios e hepatócitos. O AhR também tem uma função importante nas células-tronco hematopoiéticas: o antagonismo do AhR promove sua autorrenovação e expansão ex vivo e está envolvido na diferenciação de megacariócitos.
Resposta adaptativa e inata
A resposta adaptativa se manifesta como a indução de enzimas de metabolização xenobiótica. A evidência desta resposta foi observada pela primeira vez a partir da indução do citocromo P450, família 1, subfamília A, polipeptídeo 1 (Cyp1a1) resultante da exposição a TCDD, que foi determinado estar diretamente relacionado à ativação da via de sinalização de Ahr. A busca por outros genes metabolizadores induzidos por ligantes AhR, devido à presença de DREs, levou à identificação de uma "bateria de genes AhR" de enzimas metabolizadoras de Fase I e Fase II consistindo em CYP1A1 , CYP1A2 , CYP1B1 , NQO1, ALDH3A1, UGT1A2 e GSTA1. Presumivelmente, os vertebrados têm essa função de serem capazes de detectar uma ampla gama de produtos químicos, indicada pela ampla gama de substratos que o AhR é capaz de se ligar e facilitar sua biotransformação e eliminação. O AhR também pode sinalizar a presença de produtos químicos tóxicos nos alimentos e causar aversão a esses alimentos.
A ativação do AhR também parece ser importante para as respostas imunológicas e inibição da inflamação por meio da regulação positiva da interleucina 22 e da regulação negativa da resposta Th17 . O Knockdown de AHR regula principalmente para baixo a expressão de genes da imunidade inata em células THP-1 .
Resposta tóxica
Extensões da resposta adaptativa são as respostas tóxicas eliciadas pela ativação do AhR. A toxicidade resulta de duas formas diferentes de sinalização de AhR. O primeiro é um efeito colateral da resposta adaptativa em que a indução de enzimas metabolizadoras resulta na produção de metabólitos tóxicos. Por exemplo, o hidrocarboneto aromático policíclico benzo [ a ] pireno (BaP), um ligante do AhR, induz seu próprio metabolismo e bioativação a um metabólito tóxico por meio da indução de CYP1A1 e CYP1B1 em vários tecidos. A segunda abordagem à toxicidade é o resultado de mudanças aberrantes na transcrição do gene global, além daquelas observadas na "bateria de genes AhR". Essas mudanças globais na expressão gênica levam a mudanças adversas nos processos e funções celulares. A análise de microarray provou ser mais benéfica na compreensão e caracterização dessa resposta.
Interações proteína-proteína
Além das interações de proteínas mencionadas acima, o AhR também demonstrou interagir com:
Referências
links externos
- Aril + hidrocarboneto + receptor na Biblioteca Nacional de Medicina dos Estados Unidos. Cabeçalhos de Assuntos Médicos (MeSH)
- Localização do genoma humano AHR e página de detalhes do gene AHR no navegador do genoma UCSC .
- Human ARNT localização genoma e ARNT gene detalhes da página no navegador UCSC Genome .





