Balmer series - Balmer series

A série Balmer , ou linhas Balmer na física atômica , é uma de um conjunto de seis séries nomeadas que descrevem as emissões da linha espectral do átomo de hidrogênio . A série Balmer é calculada usando a fórmula de Balmer, uma equação empírica descoberta por Johann Balmer em 1885.
O espectro visível da luz do hidrogênio exibe quatro comprimentos de onda , 410 nm , 434 nm, 486 nm e 656 nm, que correspondem às emissões de fótons por elétrons em estados excitados em transição para o nível quântico descrito pelo número quântico principal n igual a 2. Existem várias linhas ultravioleta de Balmer proeminentes com comprimentos de onda menores que 400 nm. O número dessas linhas é um contínuo infinito à medida que se aproxima de um limite de 364,5 nm no ultravioleta.
Após a descoberta de Balmer, cinco outras séries espectrais de hidrogênio foram descobertas, correspondendo a elétrons em transição para valores de n diferentes de dois.
Visão geral
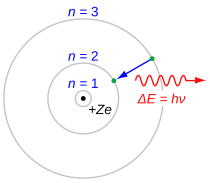
A série Balmer é caracterizada pela transição do elétron de n ≥ 3 para n = 2, onde n se refere ao número quântico radial ou número quântico principal do elétron. As transições são nomeadas sequencialmente por letras gregas: n = 3 a n = 2 é chamado H-α, 4 a 2 é H-β, 5 a 2 é H-γ e 6 a 2 é H-δ. Como as primeiras linhas espectrais associadas a esta série estão localizadas na parte visível do espectro eletromagnético , essas linhas são historicamente chamadas de "H-alfa", "H-beta", "H-gama" e assim por diante, onde H é o elemento hidrogênio.
Transição de n 3 → 2 4 → 2 5 → 2 6 → 2 7 → 2 8 → 2 9 → 2 ∞ → 2 Nome H-α / Ba-α H-β / Ba-β H-γ / Ba-γ H-δ / Ba-δ H-ε / Ba-ε H-ζ / Ba-ζ H-η / Ba-η Pausa para balmer Comprimento de onda (nm, ar) 656,279 486,135 434,0472 410,1734 397,0075 388,9064 383.5397 364,6 Diferença de energia (eV) 1,89 2,55 2,86 3,03 3,13 3,19 3,23 3,40 Cor vermelho Aqua Azul Tolet ( Ultravioleta ) (Ultravioleta) (Ultravioleta) (Ultravioleta)
Embora os físicos estivessem cientes das emissões atômicas antes de 1885, eles não tinham uma ferramenta para prever com precisão onde as linhas espectrais deveriam aparecer. A equação de Balmer prevê as quatro linhas espectrais visíveis do hidrogênio com alta precisão. A equação de Balmer inspirou a equação de Rydberg como uma generalização dela, e isso por sua vez levou os físicos a encontrar as séries de Lyman , Paschen e Brackett , que previam outras linhas espectrais de hidrogênio encontradas fora do espectro visível .
A linha espectral H-alfa vermelha da série Balmer do hidrogênio atômico, que é a transição da camada n = 3 para a camada n = 2, é uma das cores conspícuas do universo . Contribui com uma linha vermelha brilhante para o espectro de emissão ou nebulosa de ionização, como a nebulosa de Orion , que geralmente são regiões H II encontradas em regiões de formação de estrelas. Em imagens em cores reais, essas nebulosas têm uma cor rosa avermelhada da combinação de linhas de Balmer visíveis que o hidrogênio emite.
Mais tarde, foi descoberto que, quando as linhas da série Balmer do espectro do hidrogênio foram examinadas em resolução muito alta, elas eram dupletos bem espaçados. Essa divisão é chamada de estrutura fina . Também foi descoberto que elétrons excitados de camadas com n maior que 6 poderiam saltar para a camada n = 2, emitindo tons de ultravioleta ao fazer isso.

Fórmula de Balmer
Balmer notou que um único comprimento de onda tinha uma relação com cada linha do espectro de hidrogênio que estava na região da luz visível . Esse comprimento de onda era364,506 82 nm . Quando qualquer número inteiro maior que 2 era elevado ao quadrado e depois dividido por ele mesmo ao quadrado menos 4, esse número era multiplicado por364,506 82 nm (veja a equação abaixo) deu o comprimento de onda de outra linha no espectro do hidrogênio. Por esta fórmula, ele foi capaz de mostrar que algumas medidas de linhas feitas em sua época por espectroscopia eram ligeiramente imprecisas e sua fórmula previa linhas que foram encontradas posteriormente, embora ainda não tivessem sido observadas. Seu número também se revelou o limite da série. A equação de Balmer poderia ser usada para encontrar o comprimento de onda das linhas de absorção / emissão e foi originalmente apresentada da seguinte forma (exceto por uma alteração de notação para fornecer a constante de Balmer como B ):
Onde
- λ é o comprimento de onda.
- B é uma constante com o valor de3,645 0,682 × 10 -7 m ou364,506 82 nm .
- m é igual a 2
- n é um número inteiro tal que n > m .
Em 1888, o físico Johannes Rydberg generalizou a equação de Balmer para todas as transições de hidrogênio. A equação comumente usada para calcular a série de Balmer é um exemplo específico da fórmula de Rydberg e segue como um rearranjo matemático recíproco simples da fórmula acima (convencionalmente usando uma notação de m para n como a única constante integral necessária):
onde λ é o comprimento de onda da luz absorvida / emitida e R H é a constante de Rydberg para o hidrogênio. A constante de Rydberg é considerada igual a4/B na fórmula de Balmer, e este valor, para um núcleo infinitamente pesado, é 4/3,645 0,682 × 10 -7 m = 10 973 731 0,57 m -1 .
Papel na astronomia
A série Balmer é particularmente útil em astronomia porque as linhas Balmer aparecem em vários objetos estelares devido à abundância de hidrogênio no universo e, portanto, são comumente vistas e relativamente fortes em comparação com linhas de outros elementos.
A classificação espectral das estrelas, que é principalmente uma determinação da temperatura da superfície, é baseada na força relativa das linhas espectrais, e a série de Balmer em particular é muito importante. Outras características de uma estrela que podem ser determinadas por análise detalhada de seu espectro incluem a gravidade da superfície (relacionada ao tamanho físico) e a composição.
Como as linhas de Balmer são comumente vistas nos espectros de vários objetos, elas são freqüentemente usadas para determinar as velocidades radiais devido ao deslocamento doppler das linhas de Balmer. Isso tem usos importantes em toda a astronomia, desde a detecção de estrelas binárias , exoplanetas , objetos compactos como estrelas de nêutrons e buracos negros (pelo movimento do hidrogênio em discos de acreção ao redor deles), identificando grupos de objetos com movimentos semelhantes e, presumivelmente, origens ( grupos móveis , conjuntos de estrela , aglomerados de galáxias , e detritos de colisões), que determinam as distâncias (na verdade redshifts ) de galáxias ou quasares , e identificando objectos desconhecidas por análise do seu espectro.
As linhas de Balmer podem aparecer como linhas de absorção ou emissão em um espectro, dependendo da natureza do objeto observado. Nas estrelas , as linhas de Balmer são geralmente vistas em absorção e são "mais fortes" em estrelas com uma temperatura superficial de cerca de 10.000 Kelvin ( tipo espectral A). No espectro da maioria das galáxias espirais e irregulares, núcleos galácticos ativos , regiões H II e nebulosas planetárias , as linhas de Balmer são linhas de emissão.
Em espectros estelares, a linha H-épsilon (transição 7 → 2, 397,007 nm) é frequentemente misturada com outra linha de absorção causada por cálcio ionizado conhecido como "H" (a designação original dada por Joseph von Fraunhofer ). H-epsilon é separado por 0,16 nm de Ca II H em 396,847 nm, e não pode ser resolvido em espectros de baixa resolução. A linha H-zeta (transição 8 → 2) é similarmente misturada com uma linha de hélio neutra vista em estrelas quentes.
Veja também
- Espectroscopia astronômica
- Modelo Bohr
- Série espectral de hidrogênio
- Lyman series
- Fórmula de Rydberg
- Classificação estelar
- Justificativa teórica e experimental para a equação de Schrödinger


