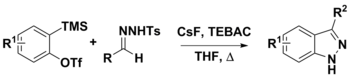Reação de Bamford-Stevens - Bamford–Stevens reaction
A reação de Bamford-Stevens é uma reação química em que o tratamento de tosilhidrazonas com base forte fornece alcenos . Recebeu o nome do químico britânico William Randall Bamford e do químico escocês Thomas Stevens Stevens (1900–2000). O uso de solventes apróticos fornece predominantemente Z- alcenos , enquanto o solvente prótico fornece uma mistura de E- e Z-alcenos. Como uma transformação geradora de alceno, a reação de Bamford-Stevens tem ampla utilidade na metodologia sintética e na síntese de moléculas complexas.
O tratamento das tosilhidrazonas com reagentes de alquil-lítio é denominado reação de Shapiro .
Mecanismo de reação
A primeira etapa da reação de Bamford-Stevens é a formação do composto diazo 3 .
Em solventes próticos, o composto diazo 3 se decompõe no íon carbênio 5 .
Em solventes apróticos, o composto diazo 3 decompõe-se no carbeno 7 .
Reação dirigida de Bamford-Stevens
A reação de Bamford-Stevens não se mostrou útil para a geração estereosseletiva de alcenos via decomposição térmica de tosilhidrazonas metaladas devido ao rearranjo 1,2 indiscriminado do centro do carbeno, que dá uma mistura de produtos. Ao substituir um grupo alquil por um grupo trimetilsilil (TMS) em N-aziridiniliminas, a migração de um átomo de hidrogênio específico pode ser aumentada. Com o átomo de silício beta para H, um efeito estereeletrônico σ C-Si → σ * CH enfraquece a ligação CH, resultando em sua migração exclusiva e levando à formação quase exclusiva de alilsilanos em vez de quantidades iguais de alilsilanos e homoalilsilanos isoméricos, análogos a a mistura de produtos vista no caso dialquil, ou outros produtos de inserção (isto é, ciclopropanos). Veja o efeito beta-silício .
Síntese de indazóis 3-substituídos a partir de arinas e N-tosilhidrazonas
As N- tossil-hidrazonas podem ser utilizadas em vários procedimentos sintéticos. Seu uso com arinas tem sido usado para preparar indazóis 3-substituídos por meio de duas vias propostas. A primeira etapa é a desprotonação da hidrazona de compostos diazo usando CsF. Neste ponto, a base conjugada poderia se decompor para dar o composto diazo e sofrer uma cicloadição dipolar [3 + 2] com o arino para dar o produto, ou uma anulação [3 + 2] com arino que também daria o produto final . Enquanto bases fortes, como LiOtBu e Cs 2 CO 3 são freqüentemente usadas nesta química, CsF foi usado para facilitar a geração in situ de arinas de o- (trimetilsilil) aril triflatos. O CsF também foi considerado suficientemente básico para desprotonar a N-tosilhidrazona.
N- tossil-hidrazonas como reagentes para reações de acoplamento cruzado
Barluenga e colaboradores desenvolveram o primeiro exemplo de uso de N-tosilhidrazonas como parceiros nucleofílicos em reações de acoplamento cruzado. Normalmente, os reagentes nucleofílicos nas reações de acoplamento tendem a ser da variedade organometálica , a saber, organomagnésio, -zinco, -tina, -silício e -boro. Combinado com halogenetos de aril eletrofílicos , N-tosilhidrazonas podem ser usados para preparar olefinas polissubstituídas sob condições catalisadas por Pd sem o uso de reagentes organometálicos muitas vezes caros e sinteticamente exigentes.
O escopo da reação é amplo; N-tosilhidrazonas derivadas de aldeídos e cetonas são bem toleradas, o que leva a olefinas di- e trissubstituídas. Além disso, uma variedade de haletos de arila são bem tolerados como parceiros de acoplamento, incluindo aqueles que carregam grupos de retirada e doação de elétrons, bem como compostos heterocíclicos aromáticos ricos em π e deficientes em π . A estereoquímica é um elemento importante a ser considerado ao preparar olefinas polissubstituídas. O uso de hidrazonas derivadas de aldeídos lineares resultou em olefinas exclusivamente trans, enquanto os resultados estereoquímicos de olefinas trissubstituídas foram dependentes do tamanho dos substituintes.
Acredita-se que o mecanismo dessa transformação prossiga de maneira semelhante à síntese de alcenos por meio da reação de Bamford-Stevens; a decomposição de N-tosilhidrazonas na presença de base para gerar diazocompostos que então liberam gás nitrogênio, produzindo um carbeno, que pode então ser extinto com um eletrófilo. Neste caso, a reação de acoplamento começa com a adição oxidativa do halogeneto de arila ao catalisador Pd 0 para dar o complexo aril Pd II . A reação do diazocomposto, gerado a partir da hidrazona, com o complexo Pd II produz um complexo Pd-carbeno. Uma inserção migratória do grupo arilo dá um alquilo Pd complexo, o qual sofre de syn eliminação beta-hidreto para gerar o arilo trans olefina e regenerar o Pd 0 catalisador. Esta reação também viu utilidade na preparação de eninas conjugadas de N-tosilhidrazonas e alcinos terminais em condições de reação catalisadas por Pd semelhantes e seguindo o mesmo mecanismo.
Além disso, Barluenga e colaboradores demonstraram uma reação de acoplamento de três componentes em um único recipiente de aldeídos ou cetonas, tosilhidrazidas e halogenetos de arila em que a N- tossil-hidrazona é formada in situ. Este processo produz olefinas estereosseletivas com rendimentos semelhantes em comparação com o processo no qual N- tossil-hidrazonas pré- formadas são usadas.
Barluenga e colaboradores também desenvolveram a metodologia de acoplamento redutivo livre de metal de N-tosilhidrazonas com ácidos borônicos. A reação tolera uma variedade de grupos funcionais em ambos os substratos, incluindo substituintes aromáticos, heteroaromáticos, alifáticos, doadores e retiradores de elétrons, e prossegue com altos rendimentos na presença de carbonato de potássio. A reação é pensada para prosseguir através da formação de um composto diazo que é gerado a partir de um sal de hidrazona. O composto diazo poderia então reagir com o ácido borônico para produzir o ácido benzilborônico através de um intermediário boronato. Uma via alternativa consiste na formação do ácido benzilborônico por meio de um intermediário zwitteriônico, seguida pela protodeboronação do ácido benzilborônico em condições básicas, que resulta no produto redutor final.
Esta metodologia também foi estendida a nucleófilos de heteroátomo para produzir éteres e tioéteres.
Um rearranjo de Bamford-Stevens / térmico alifático de Claisen catalisado por ródio
Um novo processo foi desenvolvido por Stoltz no qual a reação de Bamford-Stevens foi combinada com o rearranjo de Claisen para produzir uma variedade de produtos de olefina. Esta transformação prossegue primeiro pela decomposição térmica de N-aziridinilhidrazonas para formar o composto diazo ( 1 ), seguida por uma des diazotização mediada por ródio ( 2 ) e o deslocamento de 1,2- hidreto syn ( 3 ). Este substrato sofre um rearranjo térmico alifático de Claisen ( 4 ) para produzir o produto.
Aplicação à síntese total
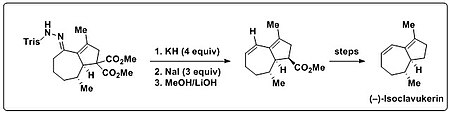
Trost et al. utilizou a reação de Bamford-Stevens em sua síntese total de (-) - isoclavucerina para introduzir uma porção dieno encontrada no produto natural. Uma trisilhidrazona bicíclica foi inicialmente submetida às condições de reação de Shapiro (alquil-lítio ou LDA), o que apenas levou a produtos de decomposição incaracterizáveis. Quando esta trisilhidrazona bicíclica foi submetida a base forte (KH) e calor, no entanto, o produto dieno desejado foi gerado. Além disso, foi demonstrado que a geração de olefinas e a seguinte descarboxilação podem ser realizadas em um único recipiente. Para tanto, adicionou-se excesso de NaI e elevação da temperatura para facilitar a descarboxilação do Krapcho .
Referências
- ^ Bamford, WR; Stevens, TS (1952). "924. A decomposição de tolueno-p-sulfonilhidrazonas por álcali". Journal of the Chemical Society : 4735. doi : 10.1039 / JR9520004735 .
- ^ Shapiro, RH (março de 1976). "Alcenos de Tosylhydrazones". Reações orgânicas . 23 . Nova York: Wiley. pp. 405–507. ISBN 0-471-19624-X.
- ^ Adlington, RM; Barrett, AGM (1983). "Aplicações recentes da reação de Shapiro". Contas de pesquisa química . 16 (2): 55. doi : 10.1021 / ar00086a004 .
- ^ Creary, X. (1986). "Pirólise do sal de tosilhidrazona: fenildiazometanos" . Sínteses orgânicas . 64 : 207. doi : 10.15227 / orgsyn.064.0207 .( também no Volume Coletivo (1990) 7 : 438 (PDF) )
- ^ Sarkar, T. (1992). "Reação de Bamford-Stevens dirigida por silício de β-Trimetilsilil N-aziridiniliminas". J. Chem. Soc. Chem. Comum. (17): 1184–1185. doi : 10.1039 / C39920001184 .
- ^ Lambert, J. (1990). "A interação com o silício com o carbono carregado positivamente". Tetraedro . 46 (8): 2677–2689. doi : 10.1016 / s0040-4020 (01) 88362-9 .
- ^ Jorgensen, W. (1985). "Magnitude e origem do efeito .beta.-silício sobre íons carbênio". Geléia. Chem. Soc . 107 (6): 1496–1500. doi : 10.1021 / ja00292a008 .
- ^ Feng, S. (2011). "Synthesis of 3-Substituted Indazoles from Arynes and N-tosylhydrazones". Org. Lett . 13 (13): 3340–3343. doi : 10,1021 / ol201086g . PMID 21630698 .
- ^ Pellissier, H. (2002). “O uso de arinas em síntese orgânica”. Tetraedro . 59 (6): 701–730. doi : 10.1016 / s0040-4020 (02) 01563-6 .
- ^ Baruenga, J. (2007). "N-tosylhydrazones as Reagents for Cross-Coupling Reactions: A Route to Polysubstituted Olefins". Angew. Chem. Int. Ed . 46 (29): 5587–5590. doi : 10.1002 / anie.200701815 . PMID 17577897 .
- ^ Zhihui, S. (2012). "N-tosilhidrazonas: reagentes versáteis para reações de acoplamento cruzado catalisadas por metal e sem metal". Chem. Soc. Rev . 41 (2): 560–572. doi : 10.1039 / c1cs15127d . PMID 21785803 .
- ^ Barluenga, J. (2009). "Acoplamento redutivo formador de ligações carbono-carbono livre de metal entre ácidos bênicos e tosilhidrazonas". Nat. Chem . 1 (6): 494–499. Bibcode : 2009NatCh ... 1..494B . doi : 10.1038 / nchem.328 . PMID 21378917 . S2CID 35892518 .
- ^ Stoltz, B. (2002). "Non-Carbonyl-Stabilized Metallocarbenoids in Synthesis: The Development of a Tandem Rhodium-Catalyzed Bamford-Stevens / Thermal Aliphatic Claisen Rearrangement Sequence" (PDF) . Geléia. Chem. Soc . 124 (42): 12426–12427. doi : 10.1021 / ja028020j . PMID 12381180 .
- ^ Wood, J. (1999). "Desenvolvimento de um rearranjo de Claisen iniciado por um carbenoide de ródio para a síntese enantiosseletiva de compostos α-hidroxi carbonila". Geléia. Chem. Soc . 121 (8): 1748–1749. doi : 10.1021 / ja983294l .
- ^ Trost, BM (1996). "On the Diastereoselectivity of Intramolecular Pd-Catalyzed TMM Cycloadions. An Asymmetric Synthesis of the Perhydroazulene (-) - isoclavukerin A". Geléia. Chem. Soc . 118 (42): 10094–10105. doi : 10.1021 / ja961561m .
- ^ Kurti, L .; Czako, B. (2005). Aplicações Estratégicas de Reações Nomeadas em Síntese Orgânica . El Sevier. ISBN 978-0124297852.