Acetato de berílio básico - Basic beryllium acetate

|
|
| Nomes | |
|---|---|
|
Nome IUPAC sistemático
Hexa-μ-acetato (O, O ') - μ4-oxo-tetraberyllium (II) |
|
| Outros nomes
Oxiacetato de
berílio Acetato de óxido de berílio Acetato básico de berílio |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.038.881 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
| Propriedades | |
|
C 12H 18Ser 4O 13 |
|
| Massa molar | 406,3122 g / mol |
| Aparência | incolor |
| Ponto de fusão | 285 ° C (545 ° F; 558 K) |
| Ponto de ebulição | 330 ° C (626 ° F; 603 K) |
| Solubilidade em clorofórmio | solúvel |
| Perigos | |
| Riscos principais | altamente tóxico |
| NIOSH (limites de exposição à saúde dos EUA): | |
|
PEL (permitido)
|
TWA 0,002 mg / m 3 C 0,005 mg / m 3 (30 minutos), com um pico máximo de 0,025 mg / m 3 (como Be) |
|
REL (recomendado)
|
Ca C 0,0005 mg / m 3 (como Be) |
|
IDLH (perigo imediato)
|
Ca [4 mg / m 3 (as Be)] |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O acetato de berílio básico é o composto químico com a fórmula Be 4 O (O 2 CCH 3 ) 6 . Este composto adota uma estrutura distinta, mas não tem aplicações e foi apenas levemente estudado. É um sólido incolor solúvel em solventes orgânicos.
Preparação
Pode ser preparado tratando carbonato de berílio básico com ácido acético quente .
- 2 Be
2CO
3(OH)
2+ 6 AcOH → Be
4O (AcO)
6+ 5 H
2O + 2 CO
2
O acetato de berílio básico é insolúvel em água, mas solúvel em clorofórmio , o que é consistente com o fato de ser apolar. Ele derrete e sublima no vácuo sem decomposição.
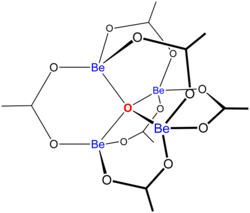
Estrutura
" Acetatos básicos " consistem em um conjunto de centros de metal ligados a um íon de óxido central e uma coleção de ligantes de acetato . O acetato de berílio básico tem um núcleo tetraédrico Be 4 O 6+ com acetatos (CH 3 CO 2 - ) abrangendo cada um dos pares de centros Be 2+ . Consiste em anéis Be 2 O 3 C de seis membros entrelaçados . A estrutura é relevante para sua estabilidade considerável (o composto é destilável a 330 ° C).
Usos
A solubilidade do sal em solventes orgânicos (clorofórmio) é útil para extrair e purificar frações ricas em berílio para muitos fins. Os monocristais básicos de acetato de berílio podem ser facilmente cultivados e são úteis para alinhar difratômetros de raios-X e também como referência em cristalografia de proteínas.
Veja também
Referências
- ^ a b c Guia de bolso de NIOSH aos perigos químicos. "# 0054" . Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ Moeller, T. (1950). "Basic Beryllium Derivatives of Organic Acids". Em Audrieth, LF (ed.). Sínteses Inorgânicas, Volume 3 . Sínteses inorgânicas. John Wiley & Sons . pp. 4–9. doi : 10.1002 / 9780470132340.ch2 . ISBN 978-0-470-13234-0.
- ^ Bragg, WH (1923). "Crystal Structure of Basic Beryllium Acetate" . Nature . 111 (2790): 532. bibcode : 1923Natur.111..532B . doi : 10.1038 / 111532a0 .
- ^ Pauling, L .; Sherman, J. (1934). "The Structure of the Carboxyl Group. II. The Crystal Structure of Basic Beryllium Acetate" (PDF) . Proceedings of the National Academy of Sciences . 20 (6): 340–5. Bibcode : 1934PNAS ... 20..340P . doi : 10.1073 / pnas.20.6.340 . PMC 1076415 . PMID 16587899 .
