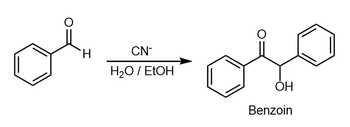
Condensação de benjoim - Benzoin condensation
A adição de benjoim é uma reação de adição envolvendo dois aldeídos . A reação geralmente ocorre entre aldeídos aromáticos ou glioxais . A reação produz uma aciloína . Na aplicação clássica, o benzaldeído é convertido em benjoim .
A condensação de benjoim foi relatada pela primeira vez em 1832 por Justus von Liebig e Friedrich Wöhler durante sua pesquisa sobre o óleo de amêndoa amarga . A versão catalítica da reação envolvendo cianeto foi desenvolvida por Nikolay Zinin no final da década de 1830,
Mecanismo de reação
A reação é catalisada por nucleófilos , como um cianeto ou um carbeno N-heterocíclico (geralmente sais de tiazólio ). O mecanismo de reação foi proposto em 1903 por AJ Lapworth . Na primeira etapa dessa reação, o ânion cianeto (como cianeto de sódio ) reage com o aldeído em uma adição nucleofílica . O rearranjo dos resultados intermediários na inversão da polaridade do grupo carbonila , que então se adiciona ao segundo grupo carbonila em uma segunda adição nucleofílica. A transferência de prótons e a eliminação do íon cianeto fornecem o benjoim como produto. Esta é uma reação reversível , o que significa que a distribuição dos produtos é determinada pela estabilidade termodinâmica relativa dos produtos e do material de partida.
Nesta reação, um aldeído doa um próton e um aldeído aceita um próton. Alguns aldeídos só podem doar prótons, como o 4-dimetilaminobenzaldeído, ao passo que o benzaldeído é tanto aceitador quanto doador de prótons. Desta forma, é possível sintetizar benjoins mistos, ou seja, produtos com grupos diferentes em cada metade do produto. No entanto, deve-se ter cuidado para combinar um aldeído doador de prótons com um aldeído que aceita prótons para evitar a homodimerização indesejada.
Escopo
A reação pode ser estendida a aldeídos alifáticos com catálise básica na presença de sais de tiazólio ; o mecanismo de reação é essencialmente o mesmo ... Esses compostos são importantes na síntese de compostos heterocíclicos . A adição 1,4 análoga de um aldeído a uma enona é chamada de reação de Stetter .
Em bioquímica , a coenzima tiamina é responsável pela biossíntese de compostos do tipo aciloína utilizando a adição de benzoína. Esta coenzima também contém uma porção tiazólio, que na desprotonação se torna um carbeno nucleofílico.
A versão assimétrica desta reação foi realizada utilizando sais quirais de tiazólio e triazólio . Verificou-se que os sais de triazólio dão maior excesso enantiomérico do que os sais de tiazólio. Um exemplo é mostrado abaixo.
Uma vez que os produtos da reação são termodinamicamente controlados, o Retro Benjoin Addition pode ser sinteticamente útil. Se um benjoim ou aciloína podem ser sintetizados por outro método, então eles podem ser convertidos nas cetonas componentes usando cianeto ou catalisadores de tiazólio. O mecanismo de reação é igual ao anterior, mas ocorre na direção inversa. Isso pode permitir o acesso de cetonas que de outra forma seriam difíceis de produzir.
Veja também
Referências
- ^ Menon, Rajeev S .; Biju, Akkattu T .; Nair, Vijay (2016). "Avanços recentes nas reações de benzoína catalisadas por N-heterocíclico (NHC)" . Beilstein Journal of Organic Chemistry . 12 : 444–461. doi : 10.3762 / bjoc.12.47 . PMC 4901930 . PMID 27340440 .
- ^ Enders, Dieter; Niemeier, Oliver; Henseler, Alexander (2007). "Organocatalysis by N-Heterocyclic Carbenes". Revisões químicas . 107 (12): 5606–5655. doi : 10.1021 / cr068372z . PMID 17956132 .
- ^ Roger Adams, CS Marvel (1921). "Benjoim". Sínteses orgânicas . 1 : 33. doi : 10.15227 / orgsyn.001.0033 . CS1 maint: usa parâmetro de autores ( link )
- ^ Wöhler, Liebig; Liebig (1832). "Untersuchungen über das Radikal der Benzoesäure". Annalen der Pharmacie . 3 (3): 249–282. doi : 10.1002 / jlac.18320030302 . hdl : 2027 / hvd.hxdg3f .
- ^ N. Zinin (1839). "Beiträge zur Kenntniss einiger Verbindungen aus der Benzoylreihe" . Annalen der Pharmacie . 31 (3): 329–332. doi : 10.1002 / jlac.18390310312 .
- ^ N. Zinin (1840). "Ueber einige Zersetzungsprodukte des Bittermandelöls" . Annalen der Pharmacie . 34 (2): 186–192. doi : 10.1002 / jlac.18400340205 .
- ^ Lapworth, A. (1904). "CXXII.- Reações envolvendo a adição de cianeto de hidrogênio a compostos de carbono. Parte II. Cianoidrinas consideradas ácidos complexos" . Journal of the Chemical Society, Transactions . 85 : 1206–1214. doi : 10.1039 / CT9048501206 .
- ^ Knight, Roland; Leeper, F. (1998). "Comparação de sais quirais de tiazólio e triazólio como catalisadores assimétricos para a adição de benjoim". J. Chem. Soc., Perkin Trans. 1 (12): 1891–1894. doi : 10.1039 / A803635G .
- ^ D. Enders, O. Niemeier & T. Balensiefer (2006). "Asymmetric Intramolecular Crossed-Benjoin Reactions by N-Heterocyclic Carbene Catalysis". Edição internacional de Angewandte Chemie . 45 (9): 1463–1467. doi : 10.1002 / anie.200503885 . PMID 16389609 .