Borazina - Borazine
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
1,3,5,2,4,6-Triazatriborinano (apenas pré-selecionado) |
|||
| Outros nomes
Ciclotriborazaneborazol
benzeno inorgânico borazol |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard |
100.169.303 |
||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| B 3 H 6 N 3 | |||
| Massa molar | 80,50 g / mol | ||
| Aparência | Líquido incolor | ||
| Densidade | 0,81 g / cm 3 | ||
| Ponto de fusão | −58 ° C (−72 ° F; 215 K) | ||
| Ponto de ebulição | 53 ° C (127 ° F; 326 K) (55 ° C a 105 Pa) | ||
| -49,6 · 10 −6 cm 3 / mol | |||
| Perigos | |||
| NFPA 704 (diamante de fogo) | |||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
Borazina , também conhecido como borazol , é um composto inorgânico polar com a fórmula química B 3 H 6 N 3 . Neste composto cíclico , as três unidades BH e três unidades NH se alternam. O composto é isoeletrônico e isoestrutural com benzeno . Por esta razão, a borazina é às vezes chamada de “benzeno inorgânico”. Como o benzeno, a borazina é um líquido incolor com cheiro aromático.
Síntese
O composto foi relatado em 1926 pelos químicos Alfred Stock e Erich Pohland por uma reação de diborano com amônia .
A borazina pode ser sintetizada pelo tratamento de diborano e amônia em uma proporção de 1: 2 a 250–300 ° C com uma conversão de 50%.
- 3 B 2 H 6 + 6 NH 3 → 2 B 3 H 6 N 3 + 12 H 2
Uma rota alternativa mais eficiente começa com borohidreto de sódio e sulfato de amônio :
- 6 NaBH 4 + 3 (NH 4 ) 2 SO 4 → 2 B 3 N 3 H 6 + 3 Na 2 SO 4 + 18 H 2
Em um processo de duas etapas para borazina, o tricloreto de boro é primeiro convertido em tricloroborazina:
- 3 BCl 3 + 3 NH 4 Cl → Cl 3 B 3 H 3 N 3 + 9 HCl
As ligações B-Cl são subsequentemente convertidas em ligações BH:
- 2 Cl 3 B 3 H 3 N 3 + 6 NaBH 4 → 2 B 3 H 6 N 3 + 3 B 2 H 6 + 6 NaCl
Estrutura
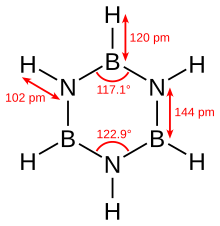
A borazina é isoeletrônica com o benzeno e tem conectividade semelhante, por isso às vezes é chamada de "benzeno inorgânico". Esta comparação não é rigorosamente válida devido à diferença de eletronegatividade entre o boro e o nitrogênio. Determinações estruturais cristalográficas de raios-X mostram que os comprimentos de ligação dentro do anel de borazina são todos equivalentes a 1,429 Å, uma propriedade compartilhada pelo benzeno. No entanto, o anel de borazina não forma um hexágono perfeito. O ângulo de ligação é 117,1 ° nos átomos de boro e 122,9 ° nos nitrogênios, dando à molécula uma simetria distinta.
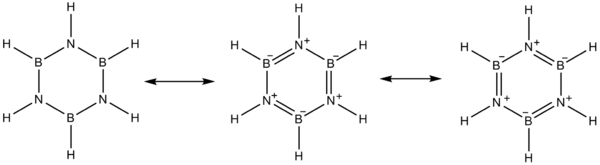
A eletronegatividade do boro (2,04 na escala de Pauling ) comparada à do nitrogênio (3,04) e também a deficiência de elétrons no átomo de boro e o par solitário no nitrogênio favorecem estruturas mesoméricas alternativas para a borazina.
O boro se comporta como um ácido de Lewis e o nitrogênio como uma base de Lewis .
Aromaticidade
Devido às suas semelhanças com o benzeno, houve uma série de análises computacionais e experimentais da aromaticidade da borazina. O número de elétrons pi na borazina obedece à regra 4n + 2, e os comprimentos das ligações BN são iguais, o que sugere que o composto pode ser aromático. A diferença de eletronegatividade entre o boro e o nitrogênio, no entanto, cria um compartilhamento desigual de carga que resulta em ligações com maior caráter iônico e, portanto, espera-se que haja uma deslocalização de elétrons mais pobre do que o análogo totalmente de carbono. A borazina, com uma mudança de entalpia padrão de formação ΔH f de −531 kJ / mol, é termicamente muito estável.
Orbitais de ligação natural (NBO)
A análise do orbital de ligação natural (NBO) sugere aromaticidade fraca em borazina. No modelo NBO, as ligações BN no anel são ligeiramente deslocadas dos eixos nucleares, e B e N têm grandes diferenças de carga. A análise de blindagem química natural (NCS) fornece algumas evidências adicionais para aromaticidade com base na contribuição da ligação BN π para a blindagem magnética. Cálculos baseados em orbitais NBO mostram que esta ligação π permite uma corrente de anel fraca que de alguma forma neutraliza um campo magnético simulado no centro do anel de borazina. Uma pequena corrente de anel sugere alguma deslocalização.
Função de localização de elétrons (ELF)
A análise topológica da ligação em borazina pela função de localização de elétrons (ELF) indica que borazina pode ser descrita como um composto aromático π. No entanto, a ligação na borazina é menos deslocalizada do que no benzeno, com base na diferença nos valores de bifurcação das bacias de elétrons. Valores de bifurcação maiores indicam melhor deslocamento de elétrons, e argumenta-se que quando esse valor de bifurcação é maior que 0,70, a deslocalização é suficiente para designar um composto aromático. Para o benzeno, este valor é 0,91, mas o sistema π da borazina bifurca no valor ELF 0,682. Isso é causado pela diferença na eletronegatividade entre B e N, que produz uma interação de ligação mais fraca do que a interação CC no benzeno, levando ao aumento da localização dos elétrons nas unidades BH e NH. O valor de bifurcação está ligeiramente abaixo do limite de 0,70, o que sugere aromaticidade moderada.
Reatividade
Hidrólise
A borazina hidrolisa prontamente, produzindo ácido bórico, amônia e hidrogênio.
Polimerização
O aquecimento de borazina a 70 ° C expele hidrogênio com formação de poliborazileno:
- n B 3 N 3 H 6 → 1 / n [B 3 N 3 H 4 ] n
Com haletos de hidrogênio e halogênios
Com o cloreto de hidrogênio forma um aduto .
- B 3 N 3 H 6 + 3 HCl → B 3 N 3 H 9 Cl 3
- Reação de adição de borazina com cloreto de hidrogênio
- B 3 N 3 H 9 Cl 3 + NaBH 4 → (BH 4 N) 3
- Redução com borohidreto de sódio
A reação de adição com bromo não requer um catalisador . Borazinas sofrem ataque nucleofílico no boro e ataque eletrofílico no nitrogênio.
Precursor cerâmico
O nitreto de boro pode ser preparado por aquecimento de poliborazileno a 1000 ° C.
Borazinas também são materiais de partida para outras cerâmicas potenciais, como carbonitretos de boro . A borazina também pode ser usada como um precursor para o crescimento de filmes finos de nitreto de boro hexagonal (h-BN) e camadas únicas em superfícies catalíticas como cobre, platina, ferro níquel e muitos mais, com deposição química de vapor (CVD).
O poliborazileno foi proposto como um meio de armazenamento de hidrogênio reciclado para aplicações em veículos de célula de combustível de hidrogênio , usando um processo de "vaso único" para digestão e redução para recriar amônia borano.
Entre outros compostos do tipo BN, borazinas misturadas com amino-nitro substituídas superam os explosivos à base de carbono, como CL-20 .
Compostos relacionados
( C
2H
2B
2N
2) é um anel aromático de seis membros com dois átomos de carbono, dois átomos de nitrogênio e dois átomos de boro em pares opostos.
1,2-Diidro-1,2-azaborina ( C
4BNH
6) é um anel de seis membros com quatro átomos de carbono, um átomo de nitrogênio e um átomo de boro.
Referências
Leitura adicional
- Sneddon LG, Mirabelli MG, Lynch AT, Fazen PJ, Su K, Beck JS (1991). "Precursores poliméricos para cerâmicas à base de boro" (PDF) . Pure Appl. Chem . 63 (3): 407–410. doi : 10.1351 / pac199163030407 . S2CID 53629042 .
- Jeon JK, Uchimaru Y, Kim DP (agosto de 2004). "Síntese de novas cerâmicas de carbonitreto de boro amorfo do copolímero derivado de borazina via hidroboração". Química Inorgânica . 43 (16): 4796–8. doi : 10.1021 / ic035254a . PMID 15285647 .
- Paetzold P (1991). "Novas perspectivas na química do boro-nitrogênio - I" (PDF) . Pure Appl. Chem . 63 (3): 345–350. doi : 10.1351 / pac199163030345 . S2CID 53659373 .
- Islas R (2007). “Borazina: ser ou não aromático”. Química Estrutural . 18 (6): 833–839. doi : 10.1007 / s11224-007-9229-z . S2CID 95098134 .
links externos
![]() Mídia relacionada à borazina no Wikimedia Commons
Mídia relacionada à borazina no Wikimedia Commons