Tricloreto de boro - Boron trichloride
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Tricloreto de boro
|
|||
| Outros nomes
Cloreto de boro (III)
tricloroborano |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100.030.586 |
||
| Número EC | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| BCl 3 | |||
| Massa molar | 117,17 g / mol | ||
| Aparência | Gás incolor, fumaça no ar |
||
| Densidade | 1,326 g / cm 3 | ||
| Ponto de fusão | −107,3 ° C (−161,1 ° F; 165,8 K) | ||
| Ponto de ebulição | 12,6 ° C (54,7 ° F; 285,8 K) | ||
| hidrólise | |||
| Solubilidade | solúvel em CCl 4 , etanol | ||
| -59,9 · 10 −6 cm 3 / mol | |||
|
Índice de refração ( n D )
|
1,00139 | ||
| Estrutura | |||
| Trigonal planar ( D 3h ) | |||
| zero | |||
| Termoquímica | |||
|
Capacidade de calor ( C )
|
107 J / mol K | ||
|
Entropia molar padrão ( S |
206 J / mol K | ||
| -427 kJ / mol | |||
|
Energia livre de Gibbs (Δ f G ˚)
|
-387,2 kJ / mol | ||
| Perigos | |||
| Riscos principais | Pode ser fatal se ingerido ou inalado. Causa queimaduras graves nos olhos, pele, boca, pulmões, etc. O contato com água dá HCl |
||
| Ficha de dados de segurança | ICSC | ||
| Pictogramas GHS |
  
|
||
| Palavra-sinal GHS | Perigo | ||
| H330 , H300 , H314 | |||
| NFPA 704 (diamante de fogo) | |||
| Ponto de inflamação | Não inflamável | ||
| Compostos relacionados | |||
|
Outros ânions
|
Trifluoreto de boro Tribrometo de boro Triiodeto de boro |
||
|
Outros cátions
|
Tricloreto de alumínio Tricloreto de gálio |
||
|
Compostos relacionados
|
Trióxido de boro Tetracloreto de carbono |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
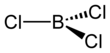
O tricloreto de boro é o composto inorgânico com a fórmula BCl 3 . Este gás incolor é um reagente em síntese orgânica . É altamente reativo com a água.
Produção e estrutura
O boro reage com os halogênios para dar os trihaletos correspondentes. O tricloreto de boro é, no entanto, produzido industrialmente por cloração direta de óxido de boro e carbono a 501 ° C.
- B 2 O 3 + 3 C + 3 Cl 2 → 2 BCl 3 + 3 CO
A reação carbotérmica é análoga ao processo Kroll para a conversão de dióxido de titânio em tetracloreto de titânio. No laboratório, o BF 3 reagido com AlCl 3 dá BCl 3 por meio de troca de halogênio. O BCl 3 é uma molécula trigonal plana como os outros trihaletos de boro e tem um comprimento de ligação de 175pm.
Um grau de ligação π foi proposto para explicar a curta distância B− Cl, embora haja algum debate quanto à sua extensão. Não dimeriza, embora estudos de RMN de misturas de trihaletos de boro mostrem a presença de haletos mistos. A ausência de dimerização contrasta com as tendências de AlCl 3 e GaCl 3 , que formam dímeros ou polímeros com 4 ou 6 centros metálicos coordenados.
Reações
BCl 3 hidrolisa prontamente para dar ácido clorídrico e ácido bórico :
- BCl 3 + 3 H 2 O → B (OH) 3 + 3 HCl
Os álcoois comportam-se de forma análoga, dando origem aos ésteres borato, por exemplo borato de trimetilo .
Como um ácido de Lewis forte , o BCl 3 forma adutos com aminas terciárias , fosfinas , éteres , tioéteres e íons haleto . A formação do aduto é freqüentemente acompanhada por um aumento no comprimento da ligação B-Cl. BCl 3 • S (CH 3 ) 2 (CAS # 5523-19-3) é frequentemente empregado como uma fonte convenientemente manuseada de BCl 3 porque este sólido (p.f. 88-90 ° C) libera BCl 3 :
- (CH 3 ) 2 S · BCl 3 ⇌ (CH 3 ) 2 S + BCl 3
Os cloretos de arila e alquil boro mistos também são conhecidos. O dicloreto de fenilboro está disponível comercialmente. Tais espécies podem ser preparadas pela reação de redistribuição de BCl 3 com reagentes organoestânicos:
- 2 BCl 3 + R 4 Sn → 2 RBCl 2 + R 2 SnCl 2
Redução
A redução de BCl 3 em boro elementar é realizada comercialmente (ver abaixo). No laboratório, quando o tricloreto de boro pode ser convertido em tetracloreto de diboro por aquecimento com cobre metálico:
- 2 BCl 3 + 2 Cu → B 2 Cl 4 + 2 CuCl
B 4 Cl 4 também pode ser preparado desta forma. O tetracloreto de diboro incolor (p.f. -93 ° C) é uma molécula plana no sólido, (semelhante ao tetróxido de dinitrogênio , mas na fase gasosa a estrutura é escalonada. Ele se decompõe em temperatura ambiente para dar uma série de monocloretos com a fórmula geral ( BCl) n , em que n pode ser de 8, 9, 10, ou 11. Os compostos com as fórmulas B 8 Cl 8 e B 9 Cl 9 são conhecidas por conterem gaiolas fechadas de átomos de boro.
Usos
O tricloreto de boro é uma matéria-prima para a produção de boro elementar. Também é usado no refino de ligas de alumínio , magnésio , zinco e cobre para remover nitretos , carbonetos e óxidos de metal fundido. Tem sido usado como um fundente de soldagem para ligas de alumínio, ferro , zinco , tungstênio e monel . As fundições de alumínio podem ser melhoradas tratando-se o fundido com vapores de tricloreto de boro. Na fabricação de resistores elétricos, um filme adesivo de carbono uniforme e duradouro pode ser colocado sobre uma base de cerâmica usando BCl 3 . Ele tem sido usado no campo de combustíveis de alta energia e propelentes de foguetes como fonte de boro para aumentar o valor de BTU. O BCl 3 também é usado na corrosão por plasma na fabricação de semicondutores . Este gás grava os óxidos de metal pela formação de compostos BOCl x voláteis .
O BCl 3 é utilizado como reagente na síntese de compostos orgânicos. Como o brometo correspondente, ele cliva ligações CO em éteres .
Segurança
O BCl 3 é um reagente agressivo que pode formar cloreto de hidrogênio quando exposto à umidade ou álcoois . O aduto de sulfeto de dimetila (BCl 3 SMe 2 ), que é um sólido, é muito mais seguro de usar, quando possível, mas H 2 O irá destruir a porção de BCl 3 enquanto deixa sulfeto de dimetila em solução.
Veja também
Referências
Notas
- ^ Dentro da União Europeia, a seguinte advertência adicional de perigo (EUH014) também deve ser exibida no rótulo: Reage violentamente com a água.
Leitura adicional
- Martin, DR (1944). "Coordination Compounds of Boron Trichloride. I. - A Review". Revisões químicas . 34 (3): 461–473. doi : 10.1021 / cr60109a005 .
- Kabalka, GW; Wu, ZZ; Ju, YH (2003). "The Use of Organoboron Chlorides and Bromides in Organic Synthesis". Journal of Organometallic Chemistry . 680 (1–2): 12–22. doi : 10.1016 / S0022-328X (03) 00209-2 .
links externos