Ácido bromoso - Bromous acid
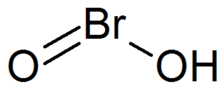
|
|

|
|

|
|
| Nomes | |
|---|---|
|
Nomes IUPAC
hidroxi-λ 3 -bromanona
hidroxidooxidobromina ácido bromoso |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
PubChem CID
|
|
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| HBrO 2 | |
| Massa molar | 112,911 g / mol |
| Base conjugada | Bromite |
| Compostos relacionados | |
|
Outros ânions
|
Ácido bromídrico ; ácido hipobromoso ; ácido brômico ; ácido perbrômico |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O ácido bromo é o composto inorgânico com a fórmula HBrO 2 . É um composto instável, embora sais de sua base conjugada - bromitos - tenham sido isolados. Em solução ácida, os bromitos se decompõem em bromo.
Descoberta
Em 1905, Richards AH comprovou a existência do ácido bromo por meio de uma série de experimentos envolvendo nitrato de prata (AgNO 3 ) e bromo. A reação do excesso de água fria para formar ácido hipobromoso (HBrO), brometo de prata (AgBr) e ácido nítrico (HNO 3 ):
- Br 2 + AgNO 3 + H 2 O → HBrO + AgBr + HNO 3
Richards descobriu que o efeito da adição de bromo líquido em excesso em um nitrato de prata concentrado (AgNO 3 ) resultou em um mecanismo de reação diferente. A partir do número de porções equivalentes de bromo ácido formado a partir da reação anterior, a razão entre oxigênio e bromo foi calculada, com o valor exato de O: Br (0,149975: 0,3745), sugerindo que o composto ácido contém dois átomos de oxigênio para um átomo de bromo. Assim, a estrutura química do composto ácido foi deduzida como HBrO 2 .
De acordo com Richards, o ácido hipobromoso (HBrO) surge pela reação da solução de bromo e nitrato de prata:
- Br 2 + AgNO 3 + H 2 O → HBrO + AgBr + HNO 3
- 2 AgNO 3 + HBrO + Br 2 + H 2 O → HBrO 2 + 2 AgBr + 2 HNO 3
Isomeria
A molécula HBrO 2 tem uma estrutura curvada com ângulos ∠ (H − O − Br) de 106,1 °. HOBrO também adota uma conformação não planar com uma estrutura isomérica (2a) adotando um ângulo diedro ∠ (H − O − Br − O) de 74,2 °. Além disso, as estruturas planas de dois outros isômeros (2b- cis e 2c- trans ) estão em estado de transição para enantiomerização rápida.
Outro estudo identificou três isômeros: HOOBr, HOBrO e HBr (O) O.
Síntese
Uma reação de oxidação entre o ácido hipobromoso (HBrO) e o ácido hipocloroso (HClO) pode ser usada para produzir ácido bromo (HBrO 2 ) e ácido clorídrico (HCl).
- HBrO + HClO → HBrO 2 + HCl
Uma reação redox de ácido hipobromoso (HBrO) pode formar ácido bromo (HBrO 2 ) como seu produto:
- HBrO + H 2 O - 2e - → HBrO 2 + 2H +
A reação de desproporção de dois equivalentes de ácido hipobromoso (HBrO) resulta na formação de ácido bromo (HBrO 2 ) e ácido bromídrico (HBr):
- 2 HBrO → HBrO 2 + HBr
Uma reação de rearranjo, que resulta da proporção sin de ácido brômico (HBrO 3 ) e ácido bromídrico (HBr) dá ácido bromo (HBrO 2 ):
- 2 HBrO 3 + HBr → 3 HBrO 2
Bromito de sódio
Os sais Nabro 2 · 3H 2 O e Ba (BrO 2 ) 2 ? H 2 O foram cristalizados. Após o tratamento dessas soluções aquosas com sais de Pb 2+ , Hg 2+ e Ag + , os bromitos de metais pesados correspondentes precipitam como sólidos.
Reação de Belousov-Zhabotinsky
O ácido bromo é um produto da reação de Belousov-Zhabotinsky resultante da combinação de bromato de potássio, sulfato de cério (IV), ácido propanodioico e ácido cítrico em ácido sulfúrico diluído. O ácido bromo é um estágio intermediário da reação entre o íon bromato ( BrO -
3 ) e bromo (Br - ):
-
Mano -
3 + 2 Br - → HBrO 2 + HBrO
Outras reações relevantes em tais reações oscilantes são:
- HBrO 2 + BrO -
3 + H + → 2 BrO •
2 + H 2 S - 2 HBrO 2 → BrO -
3 + HOBr + H +
Os bromitos reduzem os permanganatos a manganatos (VI):
- 2 MnO -
4 + BrO -
2 + OH - → 2 MnO 2−
4 + BrO -
3 + H 2 S
medição p K a
A constante de dissociação de ácido do ácido bromo, K a =
[H + ] [ BrO -
2 ] / [HBrO 2 ] , foi determinado usando métodos diferentes.
O valor do p K a para o ácido bromoso foi estimado em pesquisas que estudam a decomposição de bromitos. A pesquisa mediu a taxa de decomposição do bromito em função das concentrações de hidrogênio e íons de bromito. Os dados experimentais do log da velocidade inicial foram plotados contra o pH. Usando este método, o valor estimado de p K a para ácido bromo foi de 6,25.
Usando outro método, o pK a para ácido bromo foi medido com base na velocidade inicial da reação entre bromitos de sódio e iodo de potássio em uma faixa de pH de 2,9-8,0, a 25 ° C e força iônica de 0,06 M. A dependência de primeira ordem da velocidade inicial desta reação de desproporção em [H + ] em uma faixa de pH de 4,5–8,0. O valor da constante de dissociação de ácido medido por este método é K a = (3,7 ± 0,9) × 10 −4 M e p K a = 3,43 ± 0,05 .
Reatividade
Em comparação com outros oxidantes centrados no oxigênio (hipohalitos, ânions de peróxidos) e em linha com sua baixa basicidade, o bromito é um nucleófilo bastante fraco. As constantes de taxa de bromito para carbocations e olefinas substituídas por aceitador são de 1–3 ordens de magnitude mais baixas do que as medidas com hipobromito.
