CAMK - CAMK
| Ca 2+ / proteína quinase dependente de calmodulina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| EC nº | 2.7.11.17 | ||||||||
| CAS no. | 97350-82-8 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
CAMK , também escrito como CaMK , é uma abreviatura para a classe de enzimas da proteína quinase dependente de Ca 2+ / calmodulina . CAMKs são ativados por aumentos na concentração de íons de cálcio intracelular (Ca 2+ ) e calmodulina . Quando ativadas, as enzimas transferem fosfatos de ATP para resíduos de serina ou treonina definidos em outras proteínas, de modo que são proteínas quinases específicas de serina / treonina . CAMK ativado está envolvido na fosforilação de fatores de transcrição e, portanto, na regulação da expressão de genes respondentes. CAMK também funciona para regular o ciclo de vida celular (ou seja, morte celular programada), rearranjo da rede citoesquelética da célula e mecanismos envolvidos na aprendizagem e memória de um organismo.
Tipos
Existem 2 tipos comuns de proteínas CAM quinase: CAM quinases especializadas e multifuncionais.
- CAM Quinases específicas de substrato
- têm apenas um alvo que podem fosforilar, como as quinases de cadeia leve da miosina. Este grupo de proteínas inclui CAMK III. Mais sobre o CAMKIII pode ser encontrado neste link.
- CAM Quinases multifuncionais
- têm vários alvos que podem fosforilar e são encontrados em processos que incluem a secreção de neurotransmissores, o metabolismo do glicogênio e a regulação de vários fatores de transcrição. CAMK II é a proteína principal neste subconjunto. Mais sobre o CAMKII pode ser encontrado neste link.
Fosforilação de substrato
Uma vez que as concentrações de cálcio nas células aumentam, as cinases CAM tornam-se saturadas e ligam no máximo quatro moléculas de cálcio. Esta saturação de cálcio ativa a quinase e permite que ela passe por uma mudança conformacional que permite que a quinase se ligue aos seus locais de fosforilação. CAMK remove um grupo fosfato do ATP, normalmente usando um íon Mg 2+ , e o adiciona à proteína CAM, tornando-o ativo. A CAM quinase contém uma alça de glicina altamente concentrada onde o gama-fosfato da molécula de ATP doadora é facilmente capaz de se ligar à enzima que então utiliza o íon metálico para facilitar uma transferência suave de fosfato para a proteína alvo. Essa transferência de fosfato então ativa o alvo da quinase e completa o ciclo de fosforilação.
A Figura 1 mostra como a presença de cálcio ou calmodulina permite a ativação de CAM quinases (CAMK II).
Estrutura
Todas as quinases têm uma estrutura comum de um núcleo catalítico, incluindo um local de ligação de ATP juntamente com um local de ligação de substrato maior. O núcleo catalítico é normalmente composto de fitas β com o local de ligação do substrato composto por hélices α. Quase todas as CAM quinases incluem uma variedade de domínios, incluindo: um domínio catalítico, um domínio regulador, um domínio de associação e um domínio de ligação de cálcio / calmodulina.
- CAMK I
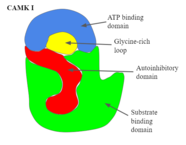
- como mostrado na Figura 2, tem uma estrutura de lóbulo duplo, consistindo em um domínio catalítico de ligação ao substrato e um domínio autoinibitório. Para que o domínio autoinibitório se torne funcional, ele deve fazer com que a proteína se conforme de tal forma que este domínio bloqueie completamente o domínio do substrato de receber novos alvos. A Figura 2 entra em detalhes mostrando a estrutura e os domínios do CAMK I.
- CAMK II
- tem uma variedade de formas diferentes, sendo o CAMK 2A a mais comum, conforme mostrado na Figura 3. O CAMK 2A tem uma estrutura cristalina em forma de anel, composta de grupos funcionais menores. Esses grupos permitem a fosforilação de alvos dependente de CaM, mas também permitem que a estrutura se autofosforile e se torne independente de CaM, como visto na Figura 1. Isso significa que uma vez que a proteína CAMK 2A é inicialmente ativada por cálcio ou calmodulina, ela pode, por sua vez, ativa-se ainda mais, de modo que não se torna inativo mesmo quando está sem cálcio ou calmodulina.
Membros da família
Os membros da classe de enzimas CAMK incluem, mas não estão limitados a:
- CAMKI
- CAMKII
- CAMKIII
- CAMKIV
- CAMKV CaM quinase como vesícula associada
- SCAMK
- Proteína quinase quinase dependente de Ca2 + / calmodulina
Pseudoquinases
As pseudoquinases são pseudoenzimas , proteínas que se assemelham às enzimas estruturalmente, mas não possuem atividade catalítica.
Algumas dessas pseudoquinases relacionadas à família CAMK incluem: