Caenorhabditis elegans -Caenorhabditis elegans
| Caenorhabditis elegans | |
|---|---|

|
|
| Um verme adulto hermafrodita C. elegans | |
|
Classificação científica |
|
| Reino: | Animalia |
| Filo: | Nematoda |
| Classe: | Chromadorea |
| Pedido: | Rhabditida |
| Família: | Rhabditidae |
| Gênero: | Caenorhabditis |
| Espécies: |
C. elegans
|
| Nome binomial | |
|
Caenorhabditis elegans ( Maupas , 1900)
|
|
| Subespécies | |
Caenorhabditis elegans ( / ˌ s i n oʊ r Æ b d aɪ t ə s ɛ l ə do ɡ Æ n s / ) é uma transparente de vida livre nemátodo cerca de 1 mm em comprimento que a vida em ambientes de solo temperado. É a espécie típica de seu gênero. O nome é uma mistura do grego caeno- (recente), rhabditis (semelhante a uma haste) e do latim elegans (elegante). Em 1900, Maupas inicialmente o nomeouRhabditides elegans. Osche o classificou no subgênero Caenorhabditis em 1952 e, em 1955, Dougherty elevou Caenorhabditis ao status de gênero .
C. elegans é um pseudocelomato não segmentado e não possui sistemas respiratórios ou circulatórios. A maioria desses nematóides são hermafroditas e alguns são machos. Os machos têm caudas especializadas para o acasalamento que incluem espículas .
Em 1963, Sydney Brenner propôs pesquisas sobre C. elegans, principalmente na área de desenvolvimento neuronal. Em 1974, ele começou a pesquisar a biologia molecular e do desenvolvimento de C. elegans , que desde então tem sido amplamente usada como organismo modelo . Foi o primeiro organismo multicelular a ter todo o seu genoma sequenciado e, a partir de 2019, é o único organismo a ter seu conectoma ("diagrama de fiação" neuronal) concluído.
Anatomia
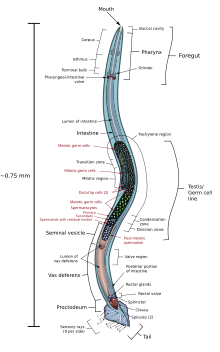
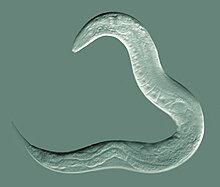
C. elegans é não segmentado , vermiforme e bilateralmente simétrico . Tem uma cutícula (uma cobertura externa dura, como um exoesqueleto ), quatro cordões epidérmicos principais e um pseudoceloma cheio de líquido (cavidade corporal). Ele também tem alguns dos mesmos sistemas de órgãos de animais maiores. Cerca de um em mil indivíduos é do sexo masculino e o restante é hermafrodita. A anatomia básica de C. elegans inclui boca, faringe , intestino , gônada e cutícula colagenosa . Como todos os nematóides, eles não têm sistema circulatório nem respiratório. As quatro bandas de músculos que percorrem toda a extensão do corpo estão conectadas a um sistema neural que permite aos músculos moverem o corpo do animal apenas como flexão dorsal ou flexão ventral, mas não para a esquerda ou direita, exceto para a cabeça, onde os quatro músculos quadrantes são ligados independentemente um do outro. Quando uma onda de contrações do músculo dorsal / ventral prossegue da parte de trás para a frente do animal, o animal é impelido para trás. Quando uma onda de contrações é iniciada na frente e prossegue posteriormente ao longo do corpo, o animal é impelido para a frente. Por causa desse viés dorsal / ventral nas curvas do corpo, qualquer indivíduo vivo e em movimento tende a se deitar tanto sobre o lado esquerdo quanto sobre o direito quando observado cruzando uma superfície horizontal. Acredita-se que um conjunto de cristas nas laterais da cutícula do corpo, a asa, dê ao animal tração adicional durante esses movimentos de flexão.
Em relação ao metabolismo lipídico, C. elegans não possui nenhum tecido adiposo especializado, pâncreas , fígado ou mesmo sangue para fornecer nutrientes em comparação com os mamíferos. Em vez disso, os lipídios neutros são armazenados no intestino, na epiderme e nos embriões. A epiderme corresponde aos adipócitos de mamíferos por ser o principal depósito de triglicerídeos .
A faringe é uma bomba alimentar muscular na cabeça de C. elegans , que tem um corte transversal triangular. Isso tritura a comida e a transporta diretamente para o intestino. Um conjunto de "células valvares" conecta a faringe ao intestino, mas não se sabe como essa válvula funciona. Após a digestão, o conteúdo do intestino é liberado pelo reto, como acontece com todos os outros nematóides. Não existe conexão direta entre a faringe e o canal excretor , que atua na liberação de urina líquida.
Os machos têm uma gônada de um lóbulo, um canal deferente e uma cauda especializada para acasalamento, que incorpora espículas . Os hermafroditas têm dois ovários , ovidutos e espermatecas e um único útero .
Os neurônios de C. elegans contêm dendritos que se estendem da célula para receber neurotransmissores e um processo que se estende até o anel nervoso (o "cérebro") para uma conexão sináptica entre os neurônios. A maior diferença é que C. elegans tem neurônios motores excitatórios e inibitórios, conhecidos como neurônios colinérgicos e gabaérgicos , que simplesmente agem como um regulador adicional para a minúscula criatura. Eles não têm influência sobre o sistema nervoso, além de regular os impulsos dos neurônios.
Grânulos intestinais
Numerosos grânulos intestinais estão presentes no intestino de C. elegans , cujas funções ainda não são totalmente conhecidas, assim como muitos outros aspectos desse nematóide, apesar dos muitos anos que vem sendo estudado. Esses grânulos intestinais são encontrados em todas as ordens Rhabditida. São muito semelhantes aos lisossomos por apresentarem interior ácido e capacidade de endocitose , mas são consideravelmente maiores, reforçando a ideia de serem organelas de armazenamento. Uma característica notável dos grânulos é que, quando observados sob luz ultravioleta , eles reagem emitindo uma fluorescência azul intensa . Outro fenômeno visto é denominado 'fluorescência da morte'. Conforme os vermes morrem, uma explosão dramática de fluorescência azul é emitida. Essa fluorescência de morte normalmente ocorre em uma onda anterior para posterior que se move ao longo do intestino e é vista em vermes jovens e idosos, sujeitos a lesões letais ou morrendo pacificamente de velhice.
Muitas teorias foram postuladas sobre as funções dos grânulos intestinais, com as primeiras sendo eliminadas por descobertas posteriores. Acredita-se que eles armazenem zinco como uma de suas funções. Uma análise química recente identificou o material fluorescente azul que eles contêm como uma forma glicosilada de ácido antranílico (AA). A necessidade de grandes quantidades de AA que os muitos grânulos intestinais contêm é questionada. Uma possibilidade é que o AA seja antibacteriano e usado na defesa contra patógenos invasores. Outra possibilidade é que os grânulos forneçam fotoproteção; as explosões de fluorescência AA implicam na conversão de luz ultravioleta prejudicial em luz visível relativamente inofensiva. Isso é visto como uma possível ligação com os melanossomos contendo melanina .
Reprodução
O verme hermafrodita é considerado uma forma especializada de fêmea autofértil, pois seu soma é feminino. A linha germinativa hermafrodita produz gametas masculinos primeiro e põe ovos através de seu útero após a fertilização interna. Os hermafroditas produzem todos os seus espermatozoides no estágio L4 (150 células espermáticas por braço gonadal) e então produzem apenas oócitos . A gônada hermafrodita atua como um ovoteste, com os espermatozoides sendo armazenados na mesma área da gônada que os oócitos até que o primeiro oócito empurre o esperma para dentro da espermateca (uma câmara onde os oócitos são fertilizados pelo esperma).
O homem pode inseminar o hermafrodita, que usará preferencialmente o esperma masculino (ambos os tipos de espermatozoides são armazenados na espermateca).
O esperma de C. elegans é amebóide, sem flagelos e acrossomas . Quando auto-inseminado, o verme do tipo selvagem põe cerca de 300 ovos. Quando inseminada por um macho, o número de descendentes pode ultrapassar 1.000. Os hermafroditas normalmente não acasalam com outros hermafroditas. A 20 ° C, a cepa de laboratório de C. elegans (N2) tem uma vida útil média em torno de 2–3 semanas e um tempo de geração de 3 a 4 dias.
C. elegans tem cinco pares de autossomos e um par de cromossomos sexuais . Sexo em C. elegans é baseado em um sistema de determinação de sexo X0 . Os hermafroditas de C. elegans têm um par correspondente de cromossomos sexuais (XX); os raros machos têm apenas um cromossomo sexual (X0).
Determinação sexual
C. elegans são principalmente organismos hermafroditas, produzindo espermatozoides e ovócitos . Os machos ocorrem na população em uma taxa de aproximadamente 1 em 200 hermafroditas, mas os dois sexos são altamente diferenciados. Os machos diferem de suas contrapartes hermafroditas porque são menores e podem ser identificados pelo formato da cauda. C.elegans se reproduzem por meio de um processo chamado androdioicia . Isso significa que eles podem se reproduzir de duas maneiras: através da autofecundação em hermafroditas ou através da reprodução de hermafroditas com machos. Os machos são produzidos por meio da não disjunção dos cromossomos X durante a meiose. Os vermes que se reproduzem por autofecundação estão em risco de alto desequilíbrio de ligação, o que leva a uma menor diversidade genética nas populações e a um aumento no acúmulo de alelos deletérios . Em C. elegans , a determinação somática do sexo é atribuída ao gene tra-1 . O tra-1 é um gene dentro da via de determinação do sexo do fator de transcrição TRA-1 que é regulado pós-transcricionalmente e atua promovendo o desenvolvimento feminino. Nos hermafroditas (XX), há altos níveis de atividade do tra-1 , que produz o sistema reprodutor feminino e inibe o desenvolvimento masculino. Em um determinado momento de seu ciclo de vida, um dia antes da idade adulta, os hermafroditas podem ser identificados pela adição de uma vulva próxima à cauda. Nos machos (XO), existem baixos níveis de atividade tra-1 , resultando em um sistema reprodutor masculino. Pesquisas recentes mostraram que existem três outros genes, fem-1, fem-2 e fem-3, que regulam negativamente a via TRA-1 e agem como o determinante final do sexo em C. elegans .
Evolução
O sistema de determinação do sexo em C. elegans é um tópico que interessa aos cientistas há anos. Uma vez que C. elegans é usado como um organismo modelo, qualquer informação descoberta sobre a maneira como seu sistema de determinação de sexo pode ter evoluído poderia promover a mesma pesquisa de biologia evolutiva em outros organismos. Depois de quase 30 anos de pesquisa, os cientistas começaram a juntar as peças na evolução de tal sistema. O que eles descobriram é que existe um caminho complexo envolvido que possui várias camadas de regulação. O organismo intimamente relacionado Caenorhabditis briggsae foi estudado extensivamente e toda a sua sequência do genoma ajudou a juntar as peças que faltavam na evolução da determinação do sexo de C. elegans . Foi descoberto que dois genes foram assimilados, fazendo com que as proteínas XOL-1 e MIX-1 tivessem um efeito na determinação do sexo em C. elegans também. Mutações na via XOL-1 levam à feminização em C. elegans. O gene mix-1 é conhecido por hipoativar o cromossomo X e regula a morfologia da cauda masculina em C. elegans. Olhando para o nematóide como um todo, o sexo masculino e hermafrodita provavelmente evoluiu de uma evolução paralela. A evolução paralela é definida como características semelhantes que evoluem de um ancestral em condições semelhantes; em poucas palavras, as duas espécies evoluem de maneiras semelhantes ao longo do tempo. Um exemplo disso seriam os mamíferos marsupiais e placentários . Os cientistas também levantaram a hipótese de que a reprodução assexuada hermafrodita , ou "autofecundação", poderia ter evoluído de forma convergente ao estudar espécies semelhantes a C. elegans. Outros estudos sobre a evolução da determinação do sexo sugerem que os genes que envolvem os espermatozoides evoluem a uma taxa mais rápida do que os genes femininos. No entanto, os genes do esperma no cromossomo X reduziram as taxas de evolução. Os genes do esperma têm sequências de codificação curtas, alta polarização de códons e representação desproporcional entre os genes órfãos. Essas características dos genes do esperma podem ser a razão de suas altas taxas de evolução e também podem sugerir como os genes do esperma evoluíram a partir de vermes hermafroditas. No geral, os cientistas têm uma ideia geral da via de determinação do sexo em C. elegans , no entanto, a evolução de como essa via surgiu ainda não está bem definida.
Desenvolvimento
Desenvolvimento embrionário
O zigoto fertilizado sofre clivagem holoblástica rotacional .
A entrada do esperma no ovócito começa a formação de um eixo anterior-posterior. O centro organizador do microtúbulo do espermatozóide direciona o movimento do pró - núcleo do esperma para o futuro pólo posterior do embrião, enquanto também incita o movimento das proteínas PAR , um grupo de fatores de determinação citoplasmática, para seus respectivos locais apropriados. Como resultado da diferença na distribuição da proteína PAR, a primeira divisão celular é altamente assimétrica . A embriogênese de C. elegans está entre os exemplos mais bem compreendidos de divisão celular assimétrica.
Todas as células da linha germinativa surgem de uma única célula germinativa primordial , chamada célula P4 , estabelecida no início da embriogênese . Esta célula primordial se divide para gerar dois precursores da linha germinativa que não se dividem mais até depois da eclosão.
Formação do eixo
As células-filhas resultantes da primeira divisão celular são chamadas de célula AB (contendo PAR-6 e PAR-3) e célula P1 (contendo PAR-1 e PAR-2). Uma segunda divisão celular produz as células ABp e ABa da célula AB e as células EMS e P2 da célula P1. Essa divisão estabelece o eixo dorsal-ventral, com a célula ABp formando o lado dorsal e a célula EMS marcando o lado ventral. Por meio da sinalização Wnt , a célula P2 instrui a célula EMS a se dividir ao longo do eixo ântero-posterior. Por meio da sinalização Notch , a célula P2 especifica diferencialmente as células ABp e ABa, que definem ainda mais o eixo dorsal-ventral. O eixo esquerda-direita também se torna aparente no início da embriogênese, embora não esteja claro exatamente quando o eixo é determinado especificamente. No entanto, a maioria das teorias do desenvolvimento do eixo LR envolve algum tipo de diferença nas células derivadas da célula AB.
Gastrulação
A gastrulação ocorre depois que o embrião atinge o estágio de 24 células. C. elegans é uma espécie de protostomo , então o blastóporo eventualmente forma a boca. A involução para o blastóporo começa com o movimento das células da endoderme e subsequente formação do intestino, seguida pelo precursor da linha germinativa P4 e, finalmente, pelas células mesodermais , incluindo as células que eventualmente formam a faringe. A gastrulação termina quando a epibolia dos hipoblastos fecha o blastóporo.
Desenvolvimento pós-embrionário
Em condições ambientais favoráveis à reprodução , as larvas eclodidas se desenvolvem em quatro estágios larvais - L1, L2, L3 e L4 - em apenas 3 dias a 20 ° C. Quando as condições são estressadas, como na insuficiência alimentar, densidade populacional excessiva ou alta temperatura, C. elegans pode entrar em um terceiro estágio larval alternativo, L2d, chamado de estágio dauer ( Dauer é permanente em alemão). Um feromônio dauer específico regula a entrada no estado dauer. Este feromônio é composto de derivados semelhantes do açúcar 3,6-didesoxi, ascarilose . Ascarosídeos, nomeados em homenagem à base ascilarlose, estão envolvidos em muitos comportamentos sociais e específicos do sexo. Dessa forma, eles constituem uma linguagem química que C. elegans usa para modular vários fenótipos. As larvas Dauer são resistentes ao estresse; eles são magros e suas bocas são seladas com uma cutícula característica e não podem comer. Eles podem permanecer nesta fase por alguns meses. O estágio termina quando as condições melhoram e favorecem o crescimento da larva, agora mudando para o estágio L4, embora o desenvolvimento da gônada seja interrompido no estágio L2.
Cada transição de estágio é pontuada por uma muda da cutícula transparente do verme. As transições por meio desses estágios são controladas por genes da via heterocrônica, um conjunto de fatores regulatórios conservado evolutivamente. Muitos genes heterocrônicos codificam para microRNAs , que reprimem a expressão de fatores de transcrição heterocrônicos e outros miRNAs heterocrônicos. miRNAs foram descobertos originalmente em C. elegans. Eventos importantes de desenvolvimento controlados por genes heterocrônicos incluem a divisão e eventual fusão sincicial das células hipodérmicas e sua secreção subseqüente da alae em adultos jovens. Acredita-se que a via heterocrônica represente um predecessor evolutivamente conservado dos relógios circadianos .
Alguns nematóides têm um número fixo de células determinado geneticamente, fenômeno conhecido como eutamente . O adulto C. elegans hermafrodita tem 959 células somáticas e o homem 1033 células, embora tenha sido sugerido que o número de suas células intestinais pode aumentar de um a três em resposta aos micróbios intestinais experimentados pelas mães. Grande parte da literatura descreve o número de células em homens como 1031, mas a descoberta de um par de neurônios MCM esquerdo e direito aumentou o número em dois em 2015. O número de células não muda depois que a divisão celular cessa no final da larva período, e o crescimento subsequente é devido apenas a um aumento no tamanho das células individuais.
Ecologia
As diferentes espécies de Caenorhabditis ocupam vários ambientes ricos em nutrientes e bactérias. Eles se alimentam das bactérias que se desenvolvem na matéria orgânica em decomposição ( microbivoria ). O solo carece de matéria orgânica suficiente para sustentar populações autossustentáveis. C. elegans pode sobreviver com uma dieta de uma variedade de bactérias, mas sua ecologia selvagem é amplamente desconhecida. A maioria das cepas de laboratório foi retirada de ambientes artificiais, como jardins e pilhas de composto . Mais recentemente, descobriu-se que C. elegans se desenvolve em outros tipos de matéria orgânica, especialmente em frutas podres.
C. elegans também pode usar diferentes espécies de levedura , incluindo Cryptococcus laurentii e C. kuetzingii , como única fonte de alimento. Embora seja um bacterívoro , C. elegans pode ser morto por uma série de bactérias patogênicas, incluindo patógenos humanos, como Staphylococcus aureus , Pseudomonas aeruginosa , Salmonella enterica ou Enterococcus faecalis .
Invertebrados como milípedes , insetos , isópodes e gastrópodes podem transportar larvas dauer para vários locais adequados. As larvas também se alimentam de seus hospedeiros quando morrem.
Os nematóides podem sobreviver à dessecação e, em C. elegans , o mecanismo para essa capacidade foi demonstrado ser proteínas abundantes da embriogênese tardia .
C. elegans , como outros nematóides, pode ser comido por nematóides predadores e outros onívoros, incluindo alguns insetos.
O vírus Orsay é um vírus que afeta C. elegans , bem como o vírus Caenorhabditis elegans Cer1 e o vírus Caenorhabditis elegans Cer13 .
- Interações com fungos
Isolados selvagens de Caenorhabditis elegans são regularmente encontrados com infecções por fungos Microsporidia . Uma dessas espécies, Nematocida parisii , replica-se nos intestinos de C. elegans .
Arthrobotrys oligospora é o organismo modelo para as interações entre fungos e nematóides. É o nematóide mais comum e difundido que captura o fungo.
Use como um organismo modelo
Em 1963, Sydney Brenner propôs o uso de C. elegans como organismo modelo para a investigação principalmente do desenvolvimento neural em animais. É um dos organismos mais simples com sistema nervoso . Os neurônios não disparam potenciais de ação e não expressam quaisquer canais de sódio dependentes de voltagem . No hermafrodita, esse sistema compreende 302 neurônios, cujo padrão foi mapeado de forma abrangente, no que é conhecido como conectoma , e mostrado como uma rede de pequeno mundo .
A pesquisa explorou os mecanismos neurais e moleculares que controlam vários comportamentos de C. elegans , incluindo quimiotaxia , termotaxia , mecanotransdução , aprendizagem , memória e comportamento de acasalamento . Em 2019, o conectoma do homem foi publicado com uma técnica distinta da usada para o hermafrodita. O mesmo artigo usou a nova técnica para refazer o conectoma hermafrodita, encontrando 1.500 novas sinapses.
Tem sido usado como um organismo modelo para estudar mecanismos moleculares em doenças metabólicas. Brenner também o escolheu porque é fácil de cultivar em grandes populações e conveniente para análises genéticas. É um organismo eucariótico multicelular , mas simples o suficiente para ser estudado em grande detalhe. A transparência de C. elegans facilita o estudo da diferenciação celular e outros processos de desenvolvimento no organismo intacto. As espículas no homem distinguem claramente os homens das mulheres. As linhagens são baratas de se reproduzir e podem ser congeladas. Quando subsequentemente descongelados, eles permanecem viáveis, permitindo o armazenamento por longo prazo. A manutenção é fácil quando comparada a outros organismos modelo multicelulares. Algumas centenas de nemátodos podem ser mantidos em uma única placa de ágar e meio de crescimento adequado. Brenner descreveu o uso de um mutante de E. coli - OP50. OP50 é um organismo que necessita de uracila e sua deficiência na placa evita o crescimento excessivo de bactérias que obscureceriam os vermes. O uso de OP50 não exige nenhuma medida de segurança laboratorial importante, uma vez que não é patogênico e pode ser facilmente cultivado em meio Luria-Bertani (LB) durante a noite.
Mapeamento de linhagem celular
O destino de desenvolvimento de cada célula somática (959 no hermafrodita adulto; 1031 no homem adulto) foi mapeado. Esses padrões de linhagem celular são amplamente invariáveis entre os indivíduos, enquanto nos mamíferos, o desenvolvimento celular depende mais de sinais celulares do embrião.
Como mencionado anteriormente, as primeiras divisões celulares da embriogênese inicial em C. elegans estão entre os exemplos mais bem compreendidos de divisões celulares assimétricas , e o verme é um sistema modelo muito popular para estudar a biologia do desenvolvimento.
Morte celular programada
A morte celular programada ( apoptose ) elimina muitas células adicionais (131 no hermafrodita, a maioria das quais, de outra forma, se tornariam neurônios ); esta "previsibilidade apoptótica" tem contribuído para a elucidação de alguns genes apoptóticos . Genes que promovem a morte celular e um único inibidor da morte celular foram identificados.
Interferência de RNA e silenciamento de genes
Interferência de RNA (RNAi) é um método relativamente simples de interromper a função de genes específicos. Silenciar a função de um gene às vezes pode permitir que um pesquisador inferir sua possível função. O nematóide pode ser embebido, injetado ou alimentado com bactérias geneticamente transformadas que expressam o RNA de fita dupla de interesse, cuja sequência complementa a sequência do gene que o pesquisador deseja desativar. O RNAi surgiu como uma ferramenta poderosa no estudo da genômica funcional. C. elegans foi usado para analisar funções de genes e reivindicar a promessa de descobertas futuras nas interações genéticas sistemáticas.
A absorção ambiental de RNAi é muito pior em outras espécies de vermes do gênero Caenorhabditis . Embora a injeção de RNA na cavidade corporal do animal induza o silenciamento de genes na maioria das espécies, apenas C. elegans e alguns outros nematóides distantemente relacionados podem absorver RNA das bactérias que comem para RNAi. Essa capacidade foi mapeada para um único gene, o sid-2 , que, quando inserido como um transgene em outras espécies, permite que eles capturem RNA para RNAi como o C. elegans faz.
Divisão celular e ciclo celular
A pesquisa em meiose foi consideravelmente simplificada, uma vez que o núcleo de cada célula germinativa está na mesma posição conforme se move para baixo na gônada, portanto, está no mesmo estágio da meiose. Em uma fase inicial da meiose, os oócitos tornam-se extremamente resistentes à radiação e essa resistência depende da expressão dos genes rad51 e atm, que têm papéis fundamentais no reparo recombinacional. O gene mre-11 também desempenha um papel crucial no reparo recombinacional de danos ao DNA durante a meiose. Um estudo da frequência de cruzamento em populações naturais mostrou que autofecundação é o modo de reprodução predominante em C. elegans , mas que eventos de cruzamento não frequentes ocorrem a uma taxa em torno de 1%. Meioses que resultam em autofecundação provavelmente não contribuem significativamente para a variabilidade genética benéfica, mas essas meioses podem fornecer o benefício adaptativo do reparo recombinacional de danos ao DNA que surgem, especialmente sob condições estressantes.
Abuso e dependência de drogas
A dependência da nicotina também pode ser estudada usando C. elegans porque exibe respostas comportamentais à nicotina semelhantes às dos mamíferos. Essas respostas incluem resposta aguda, tolerância, abstinência e sensibilização.
Bancos de dados biológicos
Como para a maioria dos organismos-modelo, os cientistas que trabalham no campo são a curadoria de um banco de dados online dedicado e o WormBase é para C. elegans . O WormBase tenta reunir todas as informações publicadas sobre C. elegans e outros nematóides relacionados. O site deles anunciou uma recompensa de US $ 4.000 para a descoberta de uma nova espécie de nematóide intimamente relacionado. Essa descoberta ampliaria as oportunidades de pesquisa com o worm.
Envelhecimento
C. elegans tem sido um organismo modelo para pesquisas sobre envelhecimento ; por exemplo, a inibição de uma via de sinalização do fator de crescimento semelhante à insulina demonstrou aumentar a expectativa de vida do adulto três vezes; enquanto a alimentação com glicose promove o estresse oxidativo e reduz o tempo de vida do adulto pela metade. Da mesma forma, a degradação induzida de um receptor de insulina / IGF-1 mais tarde na vida estendeu drasticamente a expectativa de vida dos vermes.
A capacidade de reparar danos ao DNA pelo processo de reparo por excisão de nucleotídeos diminui com a idade.
C. elegans exposto a 5 mM de cloreto de lítio (LiCl) mostrou longevidade prolongada. Quando exposto a 10μM de LiCl, redução da mortalidade foi observada, mas não com 1μM.
C. elegans tem sido fundamental na identificação das funções de genes implicados na doença de Alzheimer , como a presenilina . Além disso, uma extensa pesquisa sobre C. elegans identificou proteínas de ligação ao RNA como fatores essenciais durante a linha germinativa e o desenvolvimento embrionário inicial.
Dormir
C. elegans é notável nos estudos do sono em animais como o organismo mais primitivo a exibir estados semelhantes ao sono. Em C. elegans , uma fase letárgica ocorre pouco antes de cada muda . Também foi demonstrado que C. elegans dorme após exposição a estresse físico, incluindo choque térmico, radiação ultravioleta e toxinas bacterianas.
Biologia sensorial
Embora o verme não tenha olhos, descobriu-se que ele é sensível à luz devido a um terceiro tipo de proteína fotorreceptora animal sensível à luz , LITE-1 , que é 10 a 100 vezes mais eficiente na absorção de luz do que os outros dois tipos de fotopigmentos ( opsinas e criptocromos ) encontrados no reino animal.
C. elegans é notavelmente hábil em tolerar aceleração. Pode suportar 400.000 g , de acordo com geneticistas da Universidade de São Paulo no Brasil. Em um experimento, 96% deles ainda estavam vivos sem efeitos adversos após uma hora em uma ultracentrífuga.
Pesquisa de voo espacial
C. elegans virou notícia quando foram descobertos espécimes que sobreviveram ao desastre do ônibus espacial Columbia em fevereiro de 2003. Mais tarde, em janeiro de 2009, amostras vivas de C. elegans da Universidade de Nottingham foram anunciadas para passar duas semanas na Estação Espacial Internacional naquele mês de outubro, em um projeto de pesquisa espacial para explorar os efeitos da gravidade zero no desenvolvimento muscular e na fisiologia. A pesquisa era principalmente sobre a base genética da atrofia muscular , que se relaciona a voos espaciais ou ser enfermo, geriátrico ou diabético . Descendentes dos vermes a bordo do Columbia em 2003 foram lançados no espaço no Endeavour para a missão STS-134 . Experimentos adicionais sobre distrofia muscular durante o vôo espacial serão realizados a bordo da ISS a partir de dezembro de 2018.
Genética
Genoma

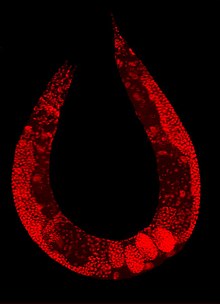
Cariótipo de C. elegans
explicação das cores
Cromossomos mitóticos de Caenorhabditis elegans. DNA (vermelho) / Kinetochores (verde). Organismos holocêntricos , incluindo C. elegans , montam cinetóforos difusos ao longo de toda a face polar de cada cromátide irmã.
| |
| ID do genoma NCBI | 41 |
|---|---|
| Ploidia | diplóide |
| Tamanho do genoma | 101,169 Mb (haplóide) |
| Número de cromossomos | 5 pares de autossomos (I, II, III, IV e V) + 1 ou 2 cromossomos sexuais (X) |
| Ano de conclusão | 1998 |
| Organela sequenciada | mitocôndria |
| Tamanho da organela | 0,01 Mb |
C. elegans foi o primeiro organismo multicelular a ter todo o seu genoma sequenciado . A sequência foi publicada em 1998, embora algumas pequenas lacunas estivessem presentes; a última lacuna foi concluída em outubro de 2002.
Tamanho e conteúdo genético
O genoma de C. elegans tem cerca de 100 milhões de pares de bases e consiste em seis pares de cromossomos em hermafroditas ou cinco pares de autossomos com cromossomo XO em C.elegans masculinos e um genoma mitocondrial . Sua densidade gênica é de cerca de um gene por cinco pares de base quilo . Os íntrons constituem 26% e as regiões intergênicas 47% do genoma. Muitos genes são organizados em clusters e quantos deles são operons não está claro. C. elegans e outros nematóides estão entre os poucos eucariotos atualmente conhecidos por terem operons; estes incluem tripanossomos , platelmintos (notavelmente o trematódeo Schistosoma mansoni ) e um tunicado cordado primitivo Oikopleura dioica . É provável que muitos outros organismos tenham esses operons.
O genoma contém cerca de 20.470 genes codificadores de proteínas . Cerca de 35% dos genes de C. elegans possuem homólogos humanos . Notavelmente, foi demonstrado que os genes humanos substituem repetidamente seus homólogos de C. elegans quando introduzidos em C. elegans . Por outro lado, muitos genes de C. elegans podem funcionar de forma semelhante aos genes de mamíferos.
O número de genes de RNA conhecidos no genoma aumentou muito devido à descoberta de 2006 de uma nova classe chamada genes 21U-RNA , e acredita-se que o genoma contenha mais de 16.000 genes de RNA, contra apenas 1.300 em 2005.
Os curadores científicos continuam avaliando o conjunto de genes conhecidos; novos modelos de genes continuam a ser adicionados e os incorretos modificados ou removidos.
A sequência do genoma de C. elegans de referência continua a mudar à medida que novas evidências revelam erros no sequenciamento original. A maioria das mudanças são pequenas, adicionando ou removendo apenas alguns pares de bases de DNA. Por exemplo, a versão WS202 do WormBase (abril de 2009) adicionou dois pares de bases à sequência do genoma. Às vezes, mudanças mais extensas são feitas conforme observado no lançamento do WS197 de dezembro de 2008, que adicionou uma região de mais de 4.300 bp à sequência.
Genomas relacionados
Em 2003, a sequência do genoma do nematóide C. briggsae também foi determinada, permitindo aos pesquisadores estudar a genômica comparativa desses dois organismos. As sequências do genoma de mais nematóides do mesmo gênero , por exemplo, C. remanei , C. japonica e C. brenneri (em homenagem a Brenner), também foram estudadas usando a técnica de sequenciamento shotgun . Essas sequências agora foram concluídas.
Outros estudos genéticos
Em 2014, C. elegans é a espécie mais basal no grupo 'Elegans' (10 espécies) do supergrupo 'Elegans' (17 espécies) em estudos filogenéticos. Ele forma um ramo próprio distinto de qualquer outra espécie do grupo.
O transposon Tc1 é um transposon de DNA ativo em C. elegans .
Comunidade científica
Em 2002, o Prêmio Nobel de Fisiologia ou Medicina foi concedido a Sydney Brenner , H. Robert Horvitz e John Sulston por seu trabalho na genética do desenvolvimento de órgãos e morte celular programada em C. elegans . O Prêmio Nobel de Fisiologia ou Medicina de 2006 foi concedido a Andrew Fire e Craig C. Mello por sua descoberta da interferência de RNA em C. elegans . Em 2008, Martin Chalfie compartilhou o Prêmio Nobel de Química por seu trabalho sobre a proteína fluorescente verde ; algumas das pesquisas envolveram o uso de C. elegans .
Muitos cientistas que pesquisam C. elegans estão intimamente ligados a Sydney Brenner, com quem quase todas as pesquisas neste campo começaram na década de 1970; eles trabalharam como pós - doutorado ou pesquisador de pós - graduação no laboratório de Brenner ou no laboratório de alguém que já trabalhou com Brenner. A maioria dos que trabalharam em seu laboratório mais tarde estabeleceram seus próprios laboratórios de pesquisa de vermes, criando assim uma "linhagem" bastante bem documentada de cientistas de C. elegans , que foi registrada no banco de dados WormBase com alguns detalhes no Encontro Internacional de Worm de 2003.
Veja também
Referências
Leitura adicional
- Bird J, Bird AC (1991). A estrutura dos nematóides . Academic Press . pp. 1, 69–70, 152–153, 165, 224–225. ISBN 978-0-12-099651-3.
- Hope, IA (1999). C. elegans : uma abordagem prática . Oxford University Press . pp. 1–6. ISBN 978-0-19-963738-6.
- Riddle DL, Blumenthal T, Meyer RJ, Priess JR (1997). C. elegans II . Cold Spring Harbor Laboratory Press . pp. 1–4, 679–683. ISBN 978-0-87969-532-3.
links externos
| Scholia tem um perfil de táxon para Caenorhabditis elegans . |
| Scholia tem um perfil de tópico para Caenorhabditis elegans . |
- Brenner S (2002) Nature's Gift to Science. No. http://nobelprize.org/nobel_prizes/medicine/laureates/2002/brenner-lecture.pdf (também palestras Horvitz e Sulston)
- WormBase - um extenso banco de dados online que cobre a biologia e genômica de C. elegans e outros nematóides
- WormAtlas - banco de dados online sobre todos os aspectos da anatomia de C. elegans com explicações detalhadas e imagens de alta qualidade
- WormBook - revisão online da biologia de C. elegans
- AceView WormGenes - outro banco de dados de genoma para C. elegans , mantido no NCBI
- C. elegans II - um livro online gratuito.
- WormWeb Neural Network - uma ferramenta online para visualizar e navegar no conectoma de C. elegans
- Filmes de C. elegans - uma introdução visual a C. elegans
- Visualize a montagem do genoma ce11 no navegador do genoma UCSC .
- Caenorhabditis elegans em eppo.int ( código EPPO CAEOEL)