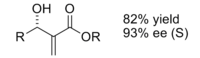Ácido quiral de Lewis - Chiral Lewis acid
Os ácidos de Lewis quirais (CLAs) são um tipo de catalisador de ácido de Lewis . Esses ácidos afetam a quiralidade do substrato à medida que reagem com ele. Em tais reações, a síntese favorece a formação de um enantiômero ou diastereômero específico . O método é uma reação de síntese assimétrica enantiosseletiva . Uma vez que afetam a quiralidade, eles produzem produtos opticamente ativos a partir de materiais de partida opticamente inativos ou mistos. Este tipo de formação preferencial de um enantiômero ou diastereômero sobre o outro é formalmente conhecido como indução assimétrica . Nesse tipo de ácido de Lewis, o átomo que aceita elétrons é tipicamente um metal, como índio , zinco , lítio , alumínio , titânio ou boro . Os ligantes de alteração quiral empregados para sintetizar esses ácidos geralmente têm vários locais básicos de Lewis (geralmente um diol ou uma estrutura de dinitrogênio) que permitem a formação de uma estrutura de anel envolvendo o átomo de metal.
Os ácidos de Lewis Achiral têm sido usados há décadas para promover a síntese de misturas racêmicas em uma miríade de reações diferentes. Desde 1960, os químicos têm usado ácidos de Lewis Chiral para induzir reações enantiosseletivas. Isso é útil quando o produto desejado é um enantiômero específico, como é comum na síntese de drogas. Os tipos de reação comuns incluem reações de Diels-Alder , a reação eno , reações de cicloadição [2 + 2] , hidrocianação de aldeídos e, mais notavelmente, epoxidações de Sharpless .
Teoria
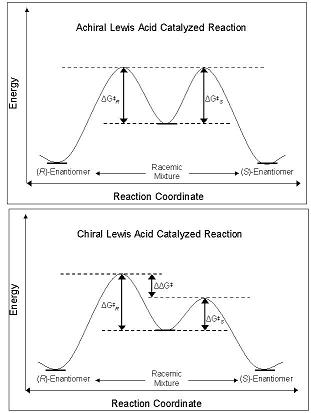
A enantiosseletividade dos CLAs deriva de sua capacidade de perturbar a barreira de energia livre junto com a via das coordenadas da reação que leva ao enantiômero R ou S. Os diastereômeros e enantiômeros do estado fundamental têm energia igual no estado fundamental e, quando reagidos com um ácido de Lewis aquiral, seus intermediários diastereoméricos, estados de transição e produtos também têm energia igual. Isso leva à produção de misturas racêmicas . Porém, quando um CLA é utilizado na mesma reação, a barreira energética de formação de um diastereômero é menor que a de outro; a reação está sob controle cinético . Se a diferença nas barreiras de energia entre os estados de transição diastereoméricos são de magnitude suficiente, então um alto excesso enantiomérico de um isômero é observado.
Síntese assimétrica
Reação de Diels-Alder
As reações de Diels-Alder ocorrem entre um dieno conjugado e um alceno (comumente conhecido como dienófilo ). Este processo de cicloadição permite a formação estereosseletiva de anéis de ciclohexênio capazes de possuir até quatro centros estereogênicos contíguos.
As reações de Diels-Alder podem levar à formação de uma variedade de isômeros e estereoisômeros estruturais. A teoria orbital molecular considera que o estado de transição endo, ao invés do estado de transição exo, é favorecido (regra de adição de endo). Além disso, interações orbitais secundárias aumentadas foram postuladas como a fonte de diastereosseleção endo melhorada.
Normalmente, os CLAs são empregados para ativar o dienófilo. Um catalisador CLA típico é derivado de um centro de Mg 2+ tornado quiral por ligação de um binol - éster de fosfato. Os CLAs foram aplicados a várias reações intramoleculares de Diels-Alder.
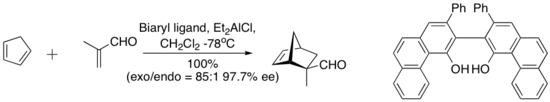
Um complexo derivado de cloreto de dietilalumínio e um ligante biaril “abobadado” abaixo catalisa a reação enantiosseletiva de Diels-Alder entre o ciclopentadieno e a metacroleína. O ligando quiral é recuperado quantitativamente pelo gel de sílica cromatografia .
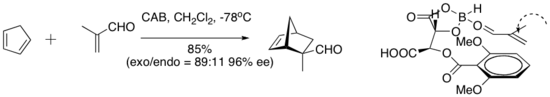
O complexo quiral (aciloxi) borano (CAB) é eficaz na catalisação de uma série de reações de Diels-Alder com aldeído. Experimentos espectroscópicos de NMR indicaram proximidade do aldeído e do anel aril. O empilhamento de Pi entre o grupo aril e o aldeído foi sugerido como uma característica organizacional que confere alta enantiosseletividade à cicloadição.
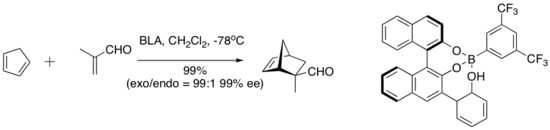
O ácido de Lewis quiral assistido por ácido de Bronsted (BLA) catalisa várias reações de cicloadição de dieno-aldeído.
Reação aldólica
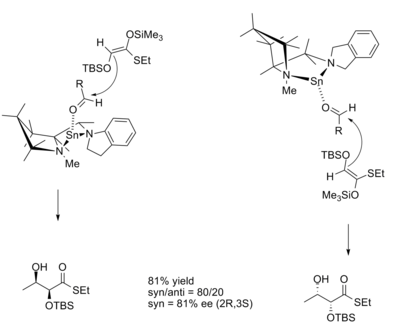
Na reação aldólica , a diastereosseletividade do produto é freqüentemente ditada pela geometria do enolato. O modelo Zimmerman-Traxler prevê que o Z enolato dará syn produtos, e que os enolatos E dará anti produtos. As reações catalisadas por CLAs à base de estanho permitem que os produtos se desviem desse padrão.
As estruturas de transição para reações com os enantiômeros do catalisador R e S são:
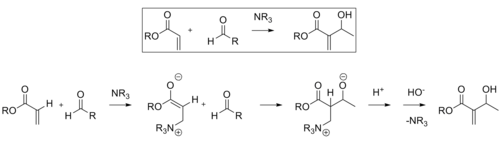
Reação Baylis-Hillman
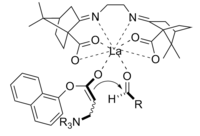
A reação de Baylis-Hillman é uma rota para a formação da ligação CC entre uma carbonila alfa, beta-insaturada e um aldeído , que requer um catalisador nucleofílico , geralmente uma amina terciária , para uma adição e eliminação do tipo Michael. A estereosseletividade dessas reações é geralmente pobre. Demonstrou-se que os CLAs contendo lantânio (III) melhoram a estereosseletividade. Da mesma forma, uma amina quiral também pode ser usada para atingir estereosseletividade.
O produto obtido pela reação com o catalisador quiral foi obtido com bom rendimento e excelente enantiosseletividade.
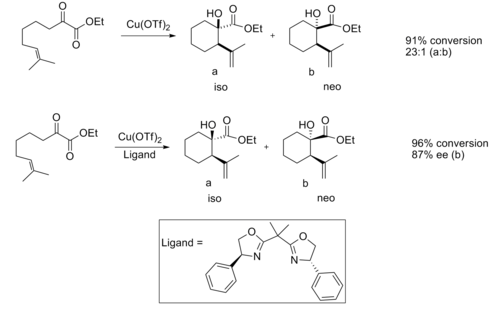
Reação de Ene
Os ácidos de Lewis quirais provaram ser úteis na reação eno . Quando catalisada por um ácido de Lewis aquiral, a reação normalmente fornece boa diastereosseletividade.
Foi observada boa enantiosseletividade quando um catalisador ácido de Lewis quiral é usado.
Acredita-se que a enantiosseletividade seja devida às interações estéricas entre o grupo metil e fenil , o que torna a estrutura de transição do produto iso consideravelmente mais favorável.
Ácidos de Lewis aquirais em síntese estereosseletiva
Em alguns casos, um ácido de Lewis aquiral pode fornecer boa estereosseletividade. Kimura et al. demonstraram o acoplamento regio e diastereosseletivo de 1,3- dienos com aldeídos usando um catalisador de níquel .