Acetato de cromo (II) - Chromium(II) acetate
|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Hidrato de acetato de cromo (II)
|
|
| Outros nomes
acetato de
cromo , diacetato de cromo , etanoato de cromo (II) |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.224.848 |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 8 H 16 Cr 2 O 10 | |
| Massa molar | 376,198 g · mol −1 |
| Aparência | sólido vermelho-tijolo |
| Densidade | 1,79 g / cm 3 |
| Ponto de fusão | desidrata |
| solúvel em água quente, MeOH | |
| -5104,0 · 10 −6 cm 3 / mol | |
| Estrutura | |
| monoclínico | |
| octaédrico contando a ligação Cr-Cr |
|
| ligação Cr-Cr quádrupla | |
| 0 D | |
| Perigos | |
| Riscos principais | poderia reagir exotermicamente no ar |
| Compostos relacionados | |
|
Compostos relacionados
|
Rh 2 (OAc) 4 (H 2 O) 2 Cu 2 (OAc) 4 (H 2 O) 2 , acetato de molibdênio (II) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
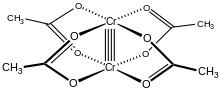
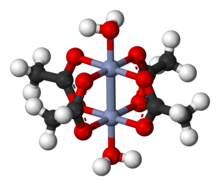
O acetato hidratado de cromo (II) , também conhecido como acetato crômico , é o composto de coordenação com a fórmula Cr 2 (CH 3 CO 2 ) 4 (H 2 O) 2 . Esta fórmula é comumente abreviada como Cr 2 (OAc) 4 (H 2 O) 2 . Este composto de cor vermelha apresenta uma ligação quádrupla . A preparação do acetato crômico já foi um teste padrão das habilidades sintéticas dos alunos devido à sua sensibilidade ao ar e às mudanças dramáticas de cor que acompanham sua oxidação. Existe nas formas dihidratada e anidra .
Cr 2 (OAc) 4 (H 2 O) 2 é um pó diamagnético avermelhado , embora cristais tabulares em forma de diamante possam ser cultivados. Consistente com o fato de que não é iônico , o Cr 2 (OAc) 4 (H 2 O) 2 apresenta baixa solubilidade em água e metanol .
Estrutura
A molécula Cr 2 (OAc) 4 (H 2 O) 2 contém dois átomos de cromo , duas moléculas ligadas de água e quatro ligantes de ligação de acetato . O ambiente de coordenação em torno de cada átomo de cromo consiste em quatro átomos de oxigênio (um de cada ligante de acetato) em um quadrado, uma molécula de água (em uma posição axial) e o outro átomo de cromo (oposto à molécula de água), dando a cada centro de cromo um geometria octaédrica . Os átomos de cromo são unidos por uma ligação quádrupla, e a molécula tem simetria D 4h (ignorando a posição dos átomos de hidrogênio). A mesma estrutura básica é adotada por Rh 2 (OAc) 4 (H 2 O) 2 e Cu 2 (OAc) 4 (H 2 O) 2 , embora essas espécies não tenham tais contatos M – M curtos.
A ligação quádrupla entre os dois átomos de cromo surge da sobreposição de quatro orbitais d em cada metal com os mesmos orbitais no outro metal: os orbitais d z 2 se sobrepõem para dar um componente de ligação sigma , os orbitais d xz e d yz se sobrepõem para fornecer dois componentes de ligação pi , e os orbitais d xy fornecem uma ligação delta . Esta ligação quádrupla também é confirmada pelo baixo momento magnético e a curta distância intermolecular entre os dois átomos de 236,2 ± 0,1 pm . As distâncias Cr – Cr são ainda mais curtas, sendo 184 pm o registro, quando o ligante axial está ausente ou o carboxilato é substituído por ligantes nitrogenados isoeletrônicos.
História
Eugène-Melchior Péligot relatou pela primeira vez um acetato de cromo (II) em 1844. Seu material era aparentemente o Cr 2 (OAc) 4 (H 2 O) 2 dimérico . A estrutura incomum, assim como a do acetato de cobre (II) , foi descoberta em 1951.
Preparação
A preparação geralmente começa com a redução de uma solução aquosa de um composto de Cr (III) usando zinco . A solução azul resultante é tratada com acetato de sódio , o que resulta na rápida precipitação do acetato crômico como um pó vermelho brilhante.
- 2 Cr 3+ + Zn → 2 Cr 2+ + Zn 2+
- 2 Cr 2+ + 4 OAc - + 2 H 2 O → Cr 2 (OAc) 4 (H 2 O) 2
A síntese de Cr 2 (OAc) 4 (H 2 O) 2 tem sido tradicionalmente usada para testar as habilidades sintéticas e a paciência de estudantes de laboratório inorgânico em universidades porque a introdução acidental de uma pequena quantidade de ar no aparelho é prontamente indicada pelo descoloração do produto vermelho brilhante. A forma anidra de acetato de cromo (II), e também carboxilatos de cromo (II) relacionados, pode ser preparada a partir do cromoceno :
- 4 RCO 2 H + 2 Cr (C 5 H 5 ) 2 → Cr 2 (O 2 CR) 4 + 4 C 5 H 6
Este método fornece derivados anidros de uma maneira direta.
Por ser tão facilmente preparado, Cr 2 (OAc) 4 (H 2 O) 2 é um material de partida para outros compostos de cromo (II). Além disso, muitos análogos foram preparados usando outros ácidos carboxílicos no lugar do acetato e usando diferentes bases no lugar da água.
Formulários
O acetato de cromo (II) tem poucas aplicações práticas. Tem sido usado para desalogenar compostos orgânicos, como α-bromocetonas e clorohidrinas . As reações parecem proceder via 1e - passos, e produtos de rearranjo às vezes são observados.
Como o composto é um bom agente redutor, ele reduzirá o O 2 encontrado no ar e pode ser usado como depurador de oxigênio.
Veja também
Referências
Leitura adicional
- Rice, Steven F .; Wilson, Randall B .; Solomon, Edward I. (1980). "Electronic Absorption Spectrum of Chromous Acetate Dihydrate and Related Binuclear Chromous Carboxylates". Inorg. Chem. 19 (11): 3425–3431. doi : 10.1021 / ic50213a042 . CS1 maint: parâmetro desencorajado ( link )
links externos
- http://www.molecules.org/coordcpds.html#Cr2OAc4H2O
- http://alpha.chem.umb.edu/chemistry/ch370/documents/CH371chromiumacetate06.pdf (desatualizado)
- http://wwwchem.uwimona.edu.jm/courses/chromium.pdf
| AcOH | Ele | |||||||||||||||||||
| LiOAc |
Be (OAc) 2 BeAcOH |
B (OAc) 3 |
AcOAc ROAc |
NH 4 OAc | AcOOH | FAc | Ne | |||||||||||||
| NaOAc | Mg (OAc) 2 |
Al (OAc) 3 ALSOL Al (OAc) 2 OH Al 2 SO 4 (OAc) 4 |
Si | P | S | ClAc | Ar | |||||||||||||
| KOAc | Ca (OAc) 2 | Sc (OAc) 3 | Ti (OAc) 4 | VO (OAc) 3 |
Cr (OAc) 2 Cr (OAc) 3 |
Mn (OAc) 2 Mn (OAc) 3 |
Fe (OAc) 2 Fe (OAc) 3 |
Co (OAc) 2 | Ni (OAc) 2 | Cu (OAc) 2 | Zn (OAc) 2 | Ga (OAc) 3 | Ge | As (OAc) 3 | Se | BrAc | Kr | |||
| RbOAc | Sr (OAc) 2 | Y (OAc) 3 | Zr (OAc) 4 | Nb | Mo (OAc) 2 | Tc |
Ru 2 (OAc) 4 Cl Ru (OAc) 3 |
Rh 2 (OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | Dentro |
Sn (OAc) 2 Sn (OAc) 4 |
Sb (OAc) 3 | Te | IAc | Xe | |||
| CsOAc | Ba (OAc) 2 | * | Lu (OAc) 3 | Hf | Ta | C | Ré | Os | Ir | Pt (OAc) 2 | Au |
Hg 2 (OAc) 2 , Hg (OAc) 2 |
TlOAc Tl (OAc) 3 |
Pb (OAc) 2 Pb (OAc) 4 |
Bi (OAc) 3 | Po | No | Rn | ||
| Fr | Ra | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| * | La (OAc) 3 | Ce (OAc) x | Pr | WL | PM | Sm (OAc) 3 | Eu (OAc) 3 | Gd (OAc) 3 | Tb | Dy (OAc) 3 | Ho (OAc) 3 | Er | Tm | Yb (OAc) 3 | ||||||
| ** | Ac | º | Pa | UO 2 (OAc) 2 | Np | Pu | Sou | Cm | Bk | Cf | Es | Fm | Md | Não | ||||||

