Cromóforo - Chromophore

Um cromóforo é a parte de uma molécula responsável por sua cor . A cor que é vista por nossos olhos é aquela não absorvida pelo objeto refletivo dentro de um determinado espectro de comprimento de onda da luz visível . O cromóforo é uma região da molécula onde a diferença de energia entre dois orbitais moleculares separados está dentro da faixa do espectro visível. A luz visível que atinge o cromóforo pode, portanto, ser absorvida pela excitação de um elétron de seu estado fundamental para um estado excitado . Em moléculas biológicas que servem para capturar ou detectar energia luminosa, o cromóforo é a porção que causa uma mudança conformacional da molécula quando atingida pela luz.

Cromóforos conjugados do sistema pi-bond


Assim como dois orbitais p adjacentes em uma molécula formarão uma ligação pi , três ou mais orbitais p adjacentes em uma molécula podem formar um sistema pi conjugado . Em um sistema pi conjugado, os elétrons são capazes de capturar certos fótons à medida que os elétrons ressoam ao longo de uma certa distância dos orbitais p - semelhante a como uma antena de rádio detecta fótons ao longo de seu comprimento. Normalmente, quanto mais conjugado (mais longo) for o sistema pi, mais longo o comprimento de onda do fóton pode ser capturado. Em outras palavras, com cada ligação dupla adjacente adicionada que vemos em um diagrama de molécula, podemos prever que o sistema terá progressivamente mais probabilidade de parecer amarelo aos nossos olhos, pois é menos provável de absorver luz amarela e mais provável de absorver luz vermelha. ("Os sistemas conjugados com menos de oito ligações duplas conjugadas absorvem apenas na região ultravioleta e são incolores ao olho humano", "Os compostos que são azuis ou verdes normalmente não dependem apenas das ligações duplas conjugadas.")
Nos cromóforos conjugados , os elétrons saltam entre níveis de energia que são orbitais pi estendidos , criados por uma série de ligações simples e duplas alternadas , geralmente em sistemas aromáticos . Exemplos comuns incluem retinal (usado no olho para detectar luz), vários corantes de alimentos , corantes de tecidos ( compostos azo ), indicadores de pH , licopeno , β-caroteno e antocianinas . Vários fatores na estrutura de um cromóforo determinam em qual região de comprimento de onda em um espectro o cromóforo irá absorver. Alongar ou estender um sistema conjugado com mais ligações insaturadas (múltiplas) em uma molécula tenderá a deslocar a absorção para comprimentos de onda mais longos. As regras de Woodward-Fieser podem ser usadas para aproximar o comprimento de onda de absorção máximo visível no ultravioleta em compostos orgânicos com sistemas de ligação pi conjugados.
Alguns deles são cromóforos complexos de metal, que contêm um metal em um complexo de coordenação com ligantes. Exemplos são a clorofila , que é usada pelas plantas para fotossíntese e hemoglobina , o transportador de oxigênio no sangue de animais vertebrados. Nestes dois exemplos, um metal é complexado no centro de um anel macrociclo de tetrrapirrol : o metal sendo o ferro no grupo heme (ferro em um anel de porfirina ) da hemoglobina, ou magnésio complexado em um anel do tipo clorina no caso da clorofila . O sistema de ligação pi altamente conjugado do anel macrociclo absorve a luz visível. A natureza do metal central também pode influenciar o espectro de absorção do complexo metal-macrociclo ou propriedades, como o tempo de vida no estado excitado. A porção tetrapirrol em compostos orgânicos que não é macrocíclica, mas ainda tem um sistema de ligação pi conjugado ainda atua como um cromóforo. Exemplos de tais compostos incluem bilirrubina e urobilina , que exibem uma cor amarela.
Auxocromo
Um auxocromo é um grupo funcional de átomos ligados ao cromóforo que modifica a capacidade do cromóforo de absorver luz, alterando o comprimento de onda ou a intensidade da absorção.
Halocromismo
Halocromismo ocorre quando uma substância muda de cor conforme o pH muda. Esta é uma propriedade dos indicadores de pH , cuja estrutura molecular muda com certas mudanças no pH circundante. Esta mudança na estrutura afeta um cromóforo na molécula indicadora de pH. Por exemplo, a fenolftaleína é um indicador de pH cuja estrutura muda conforme o pH muda, conforme mostrado na tabela a seguir:
| Estrutura | 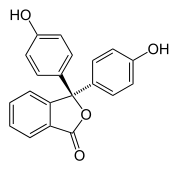 |

|
|---|---|---|
| pH | 0-8,2 | 8,2-12 |
| Condições | ácido ou quase neutro | básico |
| Nome da cor | incolor | rosa para fúcsia |
| Cor |
Em uma faixa de pH de cerca de 0-8, a molécula tem três anéis aromáticos todos ligados a um átomo de carbono hibridizado sp 3 tetraédrico no meio, o que não faz a ligação π no conjugado dos anéis aromáticos. Por causa de sua extensão limitada, os anéis aromáticos absorvem apenas a luz na região ultravioleta e, portanto, o composto parece incolor na faixa de pH 0-8. No entanto, à medida que o pH aumenta além de 8,2, esse carbono central torna-se parte de uma ligação dupla, tornando-se hibridizado com sp 2 e deixando um orbital sobreposto à ligação π nos anéis. Isso faz com que os três anéis se conjugem para formar um cromóforo estendido, absorvendo luz visível de comprimento de onda mais longo para mostrar uma cor fúcsia. Em faixas de pH fora de 0-12, outras alterações na estrutura molecular resultam em outras alterações de cor; veja detalhes sobre fenolftaleína .
Comprimentos de onda de absorção de cromóforo comuns
| Grupo funcional ou composto | Comprimento de onda de absorção |
|---|---|
| Azul de bromofenol (forma amarela) | 591 nm |
Veja também
Referências
links externos
- Causas da cor : mecanismos físicos pelos quais a cor é gerada.
- Eletrônicos nanodimensionados de alta velocidade podem ser possíveis com os cromóforos - Azonano.com

