Cisplatina - Cisplatin
 | |||
| |||
| Dados clínicos | |||
|---|---|---|---|
| Nomes comerciais | Platinol, outros | ||
| Outros nomes | Cisplatina, platamina, neoplatina, cismaplat, cis- diaminodicloroplatina (II) (CDDP) | ||
| AHFS / Drugs.com | Monografia | ||
| MedlinePlus | a684036 | ||
| Dados de licença | |||
Categoria de gravidez |
|||
| Vias de administração |
Intravenoso | ||
| Código ATC | |||
| Status legal | |||
| Status legal | |||
| Dados farmacocinéticos | |||
| Biodisponibilidade | 100% (IV) | ||
| Ligação proteica | > 95% | ||
| Meia-vida de eliminação | 30-100 horas | ||
| Excreção | Renal | ||
| Identificadores | |||
| |||
| Número CAS | |||
| PubChem CID | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| ChEBI | |||
| Painel CompTox ( EPA ) | |||
| ECHA InfoCard |
100.036.106 |
||
| Dados químicos e físicos | |||
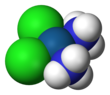
| Fórmula | [Pt (NH 3 ) 2 Cl 2 ] | ||
| Massa molar | 300,05 g · mol −1 | ||
| Modelo 3D ( JSmol ) | |||
| |||
| |||
|
| |||
A cisplatina é um medicamento quimioterápico usado para tratar vários tipos de câncer . Estes incluem o cancro testicular , cancro do ovário , cancro cervical , cancro da mama , cancro da bexiga , cancro da cabeça e pescoço , cancro do esófago , cancro do pulmão , mesotelioma , tumores cerebrais e de neuroblastoma . É administrado por injeção numa veia .
Os efeitos colaterais comuns incluem supressão da medula óssea , problemas de audição , danos aos rins e vômitos . Outros efeitos colaterais graves incluem dormência, dificuldade para andar, reações alérgicas , problemas eletrolíticos e doenças cardíacas . O uso durante a gravidez pode causar danos ao bebê. A cisplatina faz parte da família de medicamentos antineoplásicos à base de platina . Ele age em parte ligando-se ao DNA e inibindo sua replicação .
A cisplatina foi descoberta em 1845 e licenciada para uso médico em 1978 e 1979. Está na Lista de Medicamentos Essenciais da Organização Mundial de Saúde .
Uso médico
A cisplatina é administrada por via intravenosa como infusão de curto prazo em solução salina normal para o tratamento de malignidades sólidas e hematológicas. É usado para tratar vários tipos de câncer, incluindo sarcomas , alguns carcinomas (por exemplo, câncer de células pequenas do pulmão , carcinoma de células escamosas de cabeça e pescoço e câncer de ovário ), linfomas , câncer de bexiga , câncer cervical e tumores de células germinativas .
A cisplatina é particularmente eficaz contra o câncer testicular; sua adoção aumentou a taxa de cura de 10% para 85%.
Além disso, a cisplatina é usada na terapia Auger .
Efeitos colaterais
A cisplatina tem vários efeitos colaterais que podem limitar seu uso:
- A nefrotoxicidade (lesão renal) é uma grande preocupação. A dose deve ser reduzida quando a função renal da pessoa estiver comprometida. A hidratação adequada é usada em um esforço para prevenir danos. A amifostina foi estudada em um esforço para prevenir problemas. A nefrotoxicidade é um efeito colateral limitante da dose.
- A neurotoxicidade (lesão do nervo) pode ser antecipada através da realização de estudos de condução nervosa antes e após o tratamento. Os efeitos colaterais neurológicos comuns da cisplatina incluem percepção visual e distúrbios auditivos, que podem ocorrer logo após o início do tratamento. Embora o desencadeamento da apoptose por meio da interferência com a replicação do DNA continue sendo o mecanismo primário da cisplatina, não se descobriu que isso contribui para os efeitos colaterais neurológicos. Estudos recentes demonstraram que a cisplatina inibe de forma não competitiva um transportador de íons sódio-hidrogênio mecanossensível arquetípico ligado à membrana, conhecido como NHE-1 . É encontrada principalmente nas células do sistema nervoso periférico, que se agregam em grande número perto dos centros de recepção de estímulos oculares e aurais. Essa interação não competitiva tem sido associada a desequilíbrios hidroeletrolíticos e alterações do citoesqueleto, ambos confirmados in vitro e in vivo. No entanto, descobriu-se que a inibição de NHE-1 é dependente da dose (meia inibição = 30 μg / mL) e reversível.
- Náuseas e vômitos : a cisplatina é um dos agentes quimioterápicos mais emetogênicos, mas esse sintoma é tratado com antieméticos profiláticos ( ondansetron , granissetron , etc.) em combinação com corticosteroides . O aprepitant combinado com ondansetron e dexametasona demonstrou ser melhor para quimioterapia altamente emetogênica do que apenas ondansetron e dexametasona .
- Ototoxicidade (perda auditiva): não existe atualmente um tratamento eficaz para prevenir este efeito colateral, que pode ser grave, embora haja investigação em andamento de injeções de acetilcisteína como medida preventiva. A análise audiométrica pode ser necessária para avaliar a gravidade da ototoxicidade. Outros medicamentos (como a classe dos antibióticos aminoglicosídeos) também podem causar ototoxicidade, e a administração dessa classe de antibióticos em pacientes que recebem cisplatina geralmente é evitada. A ototoxicidade tanto dos aminoglicosídeos quanto da cisplatina pode estar relacionada à capacidade de se ligar à melanina na estria vascular do ouvido interno ou à geração de espécies reativas de oxigênio .
- Perturbação eletrolítica : a cisplatina pode causar hipomagnesemia, hipocaliemia e hipocalcemia. A hipocalcemia parece ocorrer em pessoas com baixo nível de magnésio sérico secundário à cisplatina, portanto, não é principalmente devido à cisplatina.
- A anemia hemolítica pode ser desenvolvida após vários cursos de cisplatina. É sugerido que um anticorpo reagindo com uma membrana de células vermelhas de cisplatina é responsável pela hemólise .
Farmacologia
A cisplatina interfere na replicação do DNA, que mata as células de proliferação mais rápida, que em teoria são cancerosas. Após a administração, um íon cloreto é lentamente deslocado pela água para dar o complexo aquático cis - [PtCl (NH 3 ) 2 (H 2 O)] + , em um processo denominado aquation . A dissociação do cloreto é favorecida dentro da célula porque a concentração intracelular de cloreto é de apenas 3–20% da concentração de cloreto de aproximadamente 100 mM no fluido extracelular.
A molécula de água em cis - [PtCl (NH 3 ) 2 (H 2 O)] + é ela própria facilmente deslocada pelas bases N - heterocíclicas no DNA . A guanina liga-se preferencialmente. Após a formação de [PtCl (guanina-DNA) (NH 3 ) 2 ] + , a reticulação pode ocorrer por meio do deslocamento do outro cloreto, normalmente por outra guanina. A cisplatina reticula o DNA de várias maneiras diferentes, interferindo na divisão celular por mitose . O DNA danificado desencadeia mecanismos de reparo de DNA , que por sua vez ativam a apoptose quando o reparo se mostra impossível. Em 2008, os pesquisadores conseguiram mostrar que a apoptose induzida pela cisplatina em células de câncer de cólon humano depende da serina-protease mitocondrial Omi / Htra2 . Uma vez que isso foi demonstrado apenas para células de carcinoma do cólon, permanece uma questão em aberto se a proteína Omi / Htra2 participa da apoptose induzida por cisplatina em carcinomas de outros tecidos.
As mais notáveis entre as mudanças no DNA são as ligações cruzadas 1,2-intra-strand com bases purinas . Estes incluem adutos 1,2-intra-camada d ( Gp G) que formam quase 90% dos adutos e os adutos menos comuns 1,2-intra-camada d ( Ap G). Adutos 1,3-intrastrando d (GpXpG) ocorrem, mas são prontamente excisados pelo reparo por excisão de nucleotídeos ( NER ). Outros adutos incluem reticulações entre cadeias e adutos não funcionais que foram postulados para contribuir para a atividade da cisplatina. A interação com proteínas celulares, particularmente proteínas do domínio HMG , também foi avançada como um mecanismo de interferência na mitose, embora este provavelmente não seja seu método de ação principal.
Resistência à cisplatina
A quimioterapia combinada com cisplatina é a base do tratamento de muitos tipos de câncer. A responsividade inicial da platina é alta, mas a maioria dos pacientes com câncer eventualmente terá recidiva com doença resistente à cisplatina. Muitos mecanismos de resistência à cisplatina têm sido propostos, incluindo mudanças na captação celular e no efluxo do fármaco, aumento da desintoxicação do fármaco, inibição da apoptose e aumento do reparo do DNA . A oxaliplatina é ativa em células de câncer altamente resistentes à cisplatina no laboratório; entretanto, há poucas evidências de sua atividade no tratamento clínico de pacientes com câncer resistente à cisplatina. O fármaco paclitaxel pode ser útil no tratamento do cancro resistente à cisplatina; o mecanismo para esta atividade é desconhecido.
Transplatina
A transplatina , o estereoisômero trans da cisplatina, tem a fórmula trans - [PtCl 2 (NH 3 ) 2 ] e não exibe um efeito farmacológico comparativamente útil. Dois mecanismos foram sugeridos para explicar o efeito anticâncer reduzido da transplatina. Em primeiro lugar, acredita-se que o arranjo trans dos ligantes cloro confere à transplatina maior reatividade química, fazendo com que a transplatina seja desativada antes de atingir o DNA onde a cisplatina exerce sua ação farmacológica. Em segundo lugar, a estereoconformação da transplatina é tal que é incapaz de formar os adutos 1,2-intrastrando d (GpG) característicos formados pela cisplatina em abundância.
Estrutura molecular
A cisplatina é o complexo de coordenação quadrada plana cis- [Pt (NH 3 ) 2 Cl 2 ]. O prefixo cis indica o isômero cis no qual dois ligantes semelhantes estão em posições adjacentes. O nome químico sistemático desta molécula é cis- diaminodicloroplatina, onde ammina com dois m's indica um ligante de amônia (NH 3 ) , em oposição a uma amina orgânica com um m.
História
O composto cis - [Pt (NH 3 ) 2 Cl 2 ] foi descrito pela primeira vez por Michele Peyrone em 1845, e conhecido por muito tempo como sal de Peyrone. A estrutura foi deduzida por Alfred Werner em 1893. Em 1965, Barnett Rosenberg , Van Camp et al. da Michigan State University descobriram que a eletrólise de eletrodos de platina gerou um complexo de platina solúvel que inibiu a fissão binária em bactérias Escherichia coli ( E. coli ). Embora o crescimento das células bacterianas continuasse, a divisão celular foi interrompida, as bactérias crescendo como filamentos com até 300 vezes seu comprimento normal. O complexo octaédrico de Pt (IV) cis - [PtCl 4 (NH 3 ) 2 ], mas não o isômero trans , foi considerado eficaz em forçar o crescimento filamentoso de células de E. coli . O complexo quadrado plano de Pt (II), cis - [PtCl 2 (NH 3 ) 2 ] revelou-se ainda mais eficaz em forçar o crescimento dos filamentos. Esse achado levou à observação de que cis - [PtCl 2 (NH 3 ) 2 ] foi de fato altamente eficaz na regressão da massa de sarcomas em ratos . A confirmação desta descoberta e a extensão dos testes a outras linhas de células tumorais lançaram as aplicações medicinais da cisplatina. A cisplatina foi aprovada para uso em câncer testicular e de ovário pela Food and Drug Administration dos EUA em 19 de dezembro de 1978. e no Reino Unido (e em vários outros países europeus) em 1979. A cisplatina foi a primeira a ser desenvolvida. Em 1983, o oncologista pediátrico Roger Packer começou a incorporar cisplatina à quimioterapia adjuvante para o tratamento do meduloblastoma infantil . O novo protocolo que ele desenvolveu levou a um aumento acentuado nas taxas de sobrevida livre de doença para pacientes com meduloblastoma, até cerca de 85%. O Protocolo Packer desde então se tornou um tratamento padrão para meduloblastoma. Da mesma forma, descobriu-se que a cisplatina é particularmente eficaz contra o câncer testicular , onde seu uso aumentou a taxa de cura de 10% para 85%.
Recentemente, alguns pesquisadores investigaram em nível pré-clínico novas formas de pró- drogas de cisplatina em combinação com nanomateriais , a fim de localizar a liberação da droga no alvo.
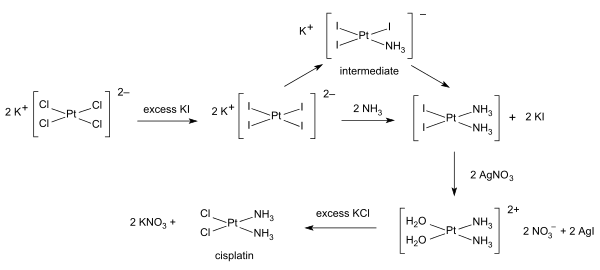
Síntese
As sínteses da cisplatina partem do tetracloroplatinato de potássio . Vários procedimentos estão disponíveis. Um obstáculo é a formação fácil do sal verde de Magnus (MGS), que tem a mesma fórmula empírica da cisplatina. A forma tradicional de evitar o MGS envolve a conversão de K 2 PtCl 4 em K 2 PtI 4 , conforme descrito originalmente por Dhara. A reação com amônia forma PtI 2 (NH 3 ) 2 que é isolado como um composto amarelo. Quando o nitrato de prata em água é adicionado, o iodeto de prata insolúvel precipita e o [Pt (OH 2 ) 2 (NH 3 ) 2 ] (NO 3 ) 2 permanece na solução. A adição de cloreto de potássio formará o produto final que precipita. No intermediário triiodo, a adição do segundo ligante de amônia é governada pelo efeito trans .
Foi desenvolvida uma síntese one-pot de cisplatina a partir de K 2 PtCl 4 . Ele depende da liberação lenta de amônia do acetato de amônio.
Veja também
Referências
Leitura adicional
- Riddell IA, Lippard SJ (2018). "Cisplatina e oxaliplatina: nosso entendimento atual de suas ações". Em Sigel A, Sigel H, Freisinger E, Sigel RK (eds.). Metalofármacos: Desenvolvimento e Ação de Agentes Anticâncer . Íons metálicos em ciências da vida . 18 . Berlim: de Gruyter GmbH. pp. 1–42. doi : 10.1515 / 9783110470734-007 . ISBN 978-3-11-046984-4. PMID 29394020 .
links externos
- "Cisplatina" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.
- Monografia IARC: "Cisplatina"