Fluoreto de cobalto (II) - Cobalt(II) fluoride
|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Fluoreto de cobalto (II)
|
|
| Outros nomes
difluoreto de cobalto
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.030.044 |
| Número EC | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Co F 2 | |
| Massa molar | 96,93 g / mol |
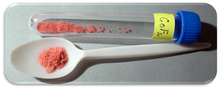
| Aparência | Sólido cristalino vermelho |
| Densidade | 4,46 g / cm 3 (anidro) 2,22 g / cm 3 (tetra-hidrato) |
| Ponto de fusão | 1.217 ° C (2.223 ° F; 1.490 K) |
| Ponto de ebulição | 1.400 ° C (2.550 ° F; 1.670 K) |
| 1,4 g / 100 mL (25 ° C) | |
| Solubilidade | solúvel em HF insolúvel em álcool , éter , benzeno |
| + 9490,0 · 10 −6 cm 3 / mol | |
| Estrutura | |
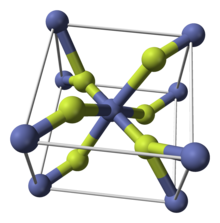
| tetragonal (a, hidratado) ortorrômbico (tetrahidrato) |
|
| Perigos | |
| NFPA 704 (diamante de fogo) | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
oral (rato): 150 mg / kg |
| Compostos relacionados | |
|
Outros ânions
|
Óxido de cobalto (II) , cloreto de cobalto (II) |
|
Outros cátions
|
fluoreto de ferro (II) , fluoreto de níquel (II) |
|
Compostos relacionados
|
trifluoreto de cobalto |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O fluoreto de cobalto (II) é um composto químico com a fórmula (CoF 2 ). É um composto sólido cristalino rosa que é antiferromagnético em baixas temperaturas (T N = 37,7 K). A fórmula é dada tanto para o cristal tetragonal vermelho, (CoF 2 ), quanto para o cristal ortogonal tetra-hidratado vermelho, (CoF 2 · 4H 2 O ) O CoF 2 é usado em campos sensíveis ao oxigênio, nomeadamente na produção de metal. Em baixas concentrações, tem usos para a saúde pública. CoF 2 é moderadamente solúvel em água. O composto pode ser dissolvido em ácido mineral quente e se decompõe em água fervente. Ainda assim, o hidrato é solúvel em água, especialmente as formas di-hidrato CoF 2 · 2H 2 O e tri-hidratado CoF 2 · 3H 2 O do composto. O hidrato também se decompõe com o calor.
Preparação
O fluoreto de cobalto (II) pode ser preparado a partir de cloreto de cobalto (II) anidro ou óxido de cobalto (II) em uma corrente de fluoreto de hidrogênio :
- CoCl 2 + 2HF → CoF 2 + 2HCl
- CoO + 2HF → CoF 2 + H 2 O
É produzido na reação do fluoreto de cobalto (III) com a água.
O fluoreto de tetraidrato de cobalto (II) é formado pela dissolução do cobalto (II) em ácido fluorídrico. O fluoreto anidro pode ser extraído por desidratação . Outra síntese pode ocorrer em temperaturas mais altas. Foi demonstrado que a 500 ° C o flúor se combinará com o cobalto produzindo uma mistura de CoF 2 e CoF 3 .
Usos
O fluoreto de cobalto (II) pode ser usado como um catalisador para ligas de metais. Ele também é usado para deposição ótica, o que melhora tremendamente a qualidade ótica. O fluoreto de cobalto (II) está disponível na maioria dos volumes em uma composição de altíssima pureza. As composições de alta pureza melhoram as qualidades ópticas e sua utilidade como padrão.
Análise
Para analisar este composto, o fluoreto de cobalto (II) pode ser dissolvido em ácido nítrico. A solução é então diluída com água até a concentração apropriada para espectrofotometria AA ou ICP para o cobalto. Uma pequena quantidade de sal pode ser dissolvida em água fria e analisada quanto ao íon fluoreto por um eletrodo seletivo de íon fluoreto ou cromatografia iônica .
Propriedades quimicas
CoF 2 é um ácido de Lewis fraco . Os complexos de cobalto (II) são geralmente octaédricos ou tetraédricos. Como uma espécie de 19 elétrons, é um bom agente redutor, bastante oxidável em um composto de 18 elétrons. O fluoreto de cobalto (II) pode ser reduzido por hidrogênio a 300 ° C.
Referências
- ^ Pradyot Patnaik (2002), Handbook of Inorganic Chemicals , McGraw-Hill Professional, ISBN 978-0-07-049439-8
- ^ Pashkevich, DS; Radchenko SM; Mukhortov, DA, "Título do artigo Troca de calor entre o pó de fluoreto de cobalto (II) e a parede do cilindro rotativo" (PDF) , Russian Journal of Applied Chemistry , Consultants Bureau, ISSN 1070-4272 , arquivado do original (PDF) em 2004 -09-29 , recuperado 2007-03-07
- ^ Ashcroft / Mermin: Solid State Physics (Tab. 33.2)
- ^ JC Bailar (1973), Comprehensive Inorganic Chemistry , Pergoamon

