Criptosporidiose - Cryptosporidiosis
| Criptosporidiose | |
|---|---|
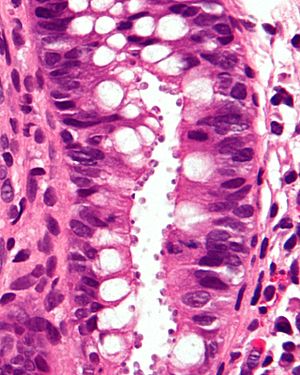 | |
| Micrografia mostrando criptosporidiose. Os cryptosporidium são os corpos pequenos e redondos em vacúolos apicais na superfície do epitélio. Mancha H&E . Biópsia do cólon . | |
| Especialidade | Doença infecciosa |
| Sintomas | Diarreia aquosa, náuseas, dor abdominal, febre |
| Causas | Infecção por Cryptosporidium |
| Fatores de risco | Imunocompromisação |
| Prevenção | Evite água contaminada |
| Tratamento | Nitazoxanida |
A criptosporidiose , às vezes chamada informalmente de cripto , é uma doença parasitária causada por Cryptosporidium , um gênero de protozoários parasitas do filo Apicomplexa . Afeta o intestino delgado distal e pode afetar o trato respiratório em indivíduos imunocompetentes (ou seja, indivíduos com um sistema imunológico funcionando normal ) e imunocomprometidos (por exemplo, pessoas com HIV / AIDS ou doenças autoimunes ), resultando em diarreia aquosa com ou sem um tosse inexplicada. Em indivíduos imunossuprimidos, os sintomas são particularmente graves e podem ser fatais. É transmitido principalmente pela via fecal-oral , frequentemente por meio de água contaminada; evidências recentes sugerem que também pode ser transmitido por fômites contaminados com secreções respiratórias.
Cryptosporidium é comumente isolado em pacientes HIV-positivos que apresentam diarreia. Apesar de não ter sido identificada até 1976, é uma das doenças de veiculação hídrica mais comum e é encontrada em todo o mundo. A infecção começa quando um ser humano consome alimentos ou água contendo cistos do organismo Cryptosporidium .
sinais e sintomas
A criptosporidiose pode ocorrer como uma infecção assintomática , uma infecção aguda (ou seja, duração menor que 2 semanas), como infecções agudas recorrentes nas quais os sintomas reaparecem após um breve período de recuperação por até 30 dias, e como uma infecção crônica (ou seja, duração mais de 2 semanas) em que os sintomas são graves e persistentes. Pode ser fatal em indivíduos com sistema imunológico gravemente comprometido . Os sintomas geralmente aparecem 5–10 dias após a infecção (variação: 2–28 dias) e normalmente duram até 2 semanas em indivíduos imunocompetentes ; os sintomas são geralmente mais graves e persistem por mais tempo em indivíduos imunocomprometidos . Após a resolução da diarreia, os sintomas podem reaparecer após vários dias ou semanas devido à reinfecção. A probabilidade de reinfecção é alta em adultos imunocomprometidos e baixa naqueles com sistema imunológico normal.
Em indivíduos imunocompetentes, a criptosporidiose está localizada principalmente no intestino delgado distal e, às vezes, também no trato respiratório . Em pessoas imunocomprometidas, a criptosporidiose pode se disseminar para outros órgãos, incluindo o sistema hepatobiliar , pâncreas , trato gastrointestinal superior e bexiga urinária ; A infecção pancreática e biliar pode envolver colecistite acalculosa , colangite esclerosante , estenose papilar ou pancreatite .
Criptosporidiose intestinal
Os sinais e sintomas comuns de criptosporidiose intestinal incluem:
- Diarreia aquosa moderada a grave , às vezes contém muco e raramente contém sangue ou leucócitos
- Em casos muito graves, a diarreia pode ser profusa e semelhante à cólera, com má absorção e hipovolemia
- Febre baixa
- Dor abdominal em cólica
- Desidratação
- Perda de peso
- Fadiga
- Náuseas e vômitos - sugerem envolvimento do trato gastrointestinal superior e podem causar criptosporidiose respiratória
- Epigástrica ou no quadrante superior direito ternura
Os sinais e sintomas menos comuns ou raros incluem:
- Artrite reativa (pode afetar as mãos, joelhos, tornozelos e pés)
- Icterícia - sugere envolvimento hepatobiliar
- Ascite - sugere envolvimento pancreático
Criptosporidiose respiratória
Os sintomas de criptosporidiose respiratória superior incluem:
- Inflamação da mucosa nasal, seios da face, laringe ou traqueia
- Secreção nasal
- Mudança de voz (por exemplo, rouquidão )
Os sintomas de criptosporidiose respiratória inferior incluem:
- Tosse
- Falta de ar
- Febre
- Hipoxemia
Causa
Cryptosporidium é um gênero de patógenos protozoários categorizados no filo Apicomplexa . Outros patógenos apicomplexanos incluem oparasitada malária Plasmodium e o Toxoplasma , o agente causador da toxoplasmose . Váriosmamíferos infectados por Cryptosporidium . Em humanos, as principais causas da doença são C. parvum e C. hominis (anteriormente C. parvum genótipo 1). C. canis , C. felis , C. meleagridis e C. muris também podem causar doenças em humanos. Cryptosporidium é capaz de completar seu ciclo de vida dentro de um único hospedeiro, resultando em estágios de cistos microbianos que são excretados nas fezes e são capazes de transmissão a um novo hospedeiro pela via fecal-oral . Outros vetores de transmissão de doenças também existem.
O padrão do ciclo de vida do Cryptosporidium se ajusta bem ao de outros gêneros coccídeos homogêneos intestinais da subordem Eimeriina : macro e microgamontes se desenvolvem independentemente; um microgamonte dá origem a numerosos gametas masculinos; e oocistos que servem para a propagação de parasitas no meio ambiente. Estudos de microscopia eletrônica feitos a partir da década de 1970 mostraram a localização intracelular, embora extracitoplasmática, de espécies de Cryptosporidium .
Essas espécies possuem uma série de características incomuns:
- uma fase endógena de desenvolvimento em microvilosidades de superfícies epiteliais
- dois tipos morfofuncionais de oocistos
- o menor número de esporozoítos por oocisto
- uma organela "alimentadora" multimembrânea
Os estudos de DNA sugerem uma relação com os gregarines em vez dos coccídios. A posição taxonômica deste grupo ainda não foi finalmente acordada.
O genoma de Cryptosporidium parvum foi sequenciado em 2004 e foi considerado incomum entre os eucariotos , pois as mitocôndrias parecem não conter DNA . Uma espécie intimamente relacionada, C. hominis , também tem sua sequência de genoma disponível. CryptoDB.org é um banco de dados financiado pelo NIH que fornece acesso aos conjuntos de dados genômicos do Cryptosporidium .
Transmissão
A infecção ocorre por meio de material contaminado, como terra, água , alimentos crus ou contaminados que entraram em contato com as fezes de um indivíduo ou animal infectado . O contato deve então ser transferido para a boca e engolido. É especialmente prevalente entre aqueles em contato regular com corpos de água doce, incluindo águas recreativas, como piscinas. Outras fontes potenciais incluem suprimentos de água insuficientemente tratada, alimentos contaminados ou exposição a fezes. A elevada resistência de Cryptosporidium oocistos a desinfectantes , tais como cloro lixívia lhes permite sobreviver por longos períodos de tempo e ainda permanecem infecciosos. Alguns surtos já ocorreram em creches relacionados à troca de fraldas.
Os grupos a seguir têm um risco elevado de exposição a Cryptosporidium :
- Trabalhadores de cuidados infantis
- Pais de crianças infectadas
- Pessoas que cuidam de outras pessoas com criptosporidiose
- Viajantes internacionais
- Mochileiros, caminhantes e campistas que bebem água não filtrada e não tratada
- Pessoas, incluindo nadadores, que engolem água de fontes contaminadas
- Pessoas que lidam com gado infectado
- Pessoas expostas a fezes humanas por meio de contato sexual
Casos de criptosporidiose podem ocorrer mesmo em cidades com abastecimento de água adequadamente descontaminado. Em uma cidade com água limpa, pode ser que os casos de criptosporidiose tenham outras origens. Testes de água, assim como estudos epidemiológicos , são necessários para determinar as fontes de infecções específicas. Cryptosporidium causa doenças graves com mais freqüência em indivíduos imunocomprometidos do que em indivíduos aparentemente saudáveis. Pode adoecer cronicamente algumas crianças, bem como adultos expostos e imunocomprometidos . Um subconjunto da população imunocomprometida são as pessoas com AIDS. Alguns comportamentos sexuais podem transmitir o parasita diretamente.
Ciclo da vida
Cryptosporidium spp. existem como vários tipos de células que correspondem a diferentes estágios de uma infecção (por exemplo, um estágio sexual e assexuado). Como um oocisto - um tipo de esporo resistente e de parede espessa- pode sobreviver no meio ambiente por meses e é resistente a muitos desinfetantes comuns, principalmente desinfetantes à base de cloro. Após serem ingeridos, os esporozoítos dentro dos oocistos são excisados (ou seja, são liberados) no intestino delgado. Os esporozoítos liberados posteriormente se ligam às microvilosidades das células epiteliais do intestino delgado. A partir daí, eles se tornam trofozoítos que se reproduzem assexuadamente por fissão múltipla, um processo conhecido como esquizogonia. Os trofozoítos desenvolvem-se em merontes do Tipo 1[1] que contêm 8 células-filhas.
Essas células-filhas são merozoítos do Tipo 1, que são liberados pelos merontes. Alguns desses merozoítos podem causar autoinfecção ao se anexar a células epiteliais. Outros desses merozoítos tornam-se merontes do Tipo II, que contêm 4 merozoítos do Tipo II. Esses merozoítos são liberados e se fixam às células epiteliais. A partir daí, eles se tornam macrogamonts ou microgamonts. Estas são as formas sexuais feminina e masculina, respectivamente. Este estágio, quando surgem as formas sexuais, é denominado gametogonia.
Os zigotos são formados por microgametas do microgamonte que penetram nos macrogamontes. Os zigotos se desenvolvem em oocistos de dois tipos. 20% dos oocistos têm paredes finas e, portanto, podem reinfectar o hospedeiro, rompendo e liberando esporozoítos que reiniciam o processo. Os oocistos de paredes espessas são excretados no meio ambiente. Os oocistos são maduros e infectantes ao serem excretados.
Patogênese
Os oocistos são ovóides ou esféricos e medem 5 a 6 micrômetros de diâmetro. Quando em preparações de flotação, eles parecem altamente refráteis. Os oocistos contêm até 4 esporozoítos em forma de arco.
Apenas 2 a 10 oocistos podem iniciar uma infecção. O parasita está localizado na borda em escova das células epiteliais do intestino delgado. Eles estão localizados principalmente no jejuno. Quando os esporozoítos se fixam, a membrana das células epiteliais os envolve. Assim, eles são “intracelulares, mas extracitoplasmáticos”. O parasita pode causar danos às microvilosidades onde se fixa. O ser humano infectado excreta a maioria dos oocistos durante a primeira semana. Os oocistos podem ser excretados por semanas após o desaparecimento da diarreia por infecções por C. parvum ou C. hominis ; entretanto, indivíduos imunocompetentes com infecções por C. muris foram observados excretando oocistos por sete meses.
O sistema imunológico reduz a formação de merozoítos Tipo 1, bem como o número de oocistos de paredes finas. Isso ajuda a prevenir a autoinfecção. As células B não ajudam na resposta inicial ou na luta para eliminar o parasita. A infecção prévia em indivíduos imunocompetentes produz pouca resistência a infecções futuras, porém pode diminuir a gravidade da doença e o número de oocistos excretados.
Diagnóstico
Existem muitos testes de diagnóstico para Cryptosporidium . Eles incluem microscopia, coloração e detecção de anticorpos . A microscopia pode ajudar a identificar oocistos na matéria fecal. Para aumentar a chance de encontrar os oocistos, o diagnosticador deve inspecionar pelo menos 3 amostras de fezes. Existem várias técnicas para concentrar a amostra de fezes ou os oocistos. O método de concentração de formalina-acetato de etila modificado (FEA) concentra as fezes. Tanto a técnica modificada de flotação centrífuga de sulfato de zinco quanto o procedimento de flotação de açúcar de Sheather podem concentrar os oocistos, fazendo-os flutuar. Outra forma de microscopia é a microscopia fluorescente feita por coloração com auramina .
Outras técnicas de coloração incluem a coloração ácido- resistente, que tingirá os oocistos de vermelho. Um tipo de coloração ácido-resistente é a coloração Kinyoun . A coloração de Giemsa também pode ser realizada. Parte do intestino delgado pode ser corada com hematoxilina e eosina (H & E), o que mostra oocistos aderidos às células epiteliais .
A detecção de antígenos é outra forma de diagnosticar a doença. Isso pode ser feito com técnicas de anticorpo fluorescente direto (DFA). Também pode ser obtido por meio de ensaio de imunofluorescência indireta . O ensaio de imunoabsorção enzimática (ELISA) também detecta antígenos.
A reação em cadeia da polimerase (PCR) é outra forma de diagnosticar a criptosporidiose. Ele pode até identificar as espécies específicas de Cryptosporidium . Se houver suspeita de que o paciente tenha criptosporidiose biliar, uma técnica diagnóstica apropriada é a ultrassonografia . Se isso retornar resultados normais, o próximo passo seria realizar a colangiopancreatografia endoscópica retrógrada .
Prevenção
Muitas estações de tratamento que obtêm água bruta de rios , lagos e reservatórios para a produção pública de água potável usam tecnologias de filtragem convencionais. Isso envolve uma série de processos, incluindo coagulação, floculação, sedimentação e filtração. A filtração direta, que normalmente é usada para tratar água com baixos níveis de partículas, inclui coagulação e filtração, mas não sedimentação. Outros processos de filtração comuns, incluindo filtros lentos de areia , filtros de terra diatomácea e membranas removerão 99% de Cryptosporidium . Membranas e filtros de bolsa e cartucho removem o Cryptosporidium especificamente.
Enquanto o Cryptosporidium é altamente resistente à desinfecção com cloro, com concentrações e tempo de contato suficientemente altos, o Cryptosporidium será inativado pelo dióxido de cloro e tratamento com ozônio. Os níveis necessários de cloro geralmente impedem o uso de desinfecção com cloro como um método confiável para controlar Cryptosporidium na água potável. O tratamento com luz ultravioleta em doses relativamente baixas inativará o Cryptosporidium . A pesquisa financiada pela Water Research Foundation descobriu originalmente a eficácia do UV na inativação de Cryptosporidium .
Um dos maiores desafios na identificação de surtos é a capacidade de identificar Cryptosporidium em laboratório . A tecnologia de monitoramento em tempo real agora é capaz de detectar Cryptosporidium com sistemas online, ao contrário dos métodos de teste pontual e em lote usados no passado.
A maneira mais confiável de descontaminar a água potável que pode estar contaminada por Cryptosporidium é fervê-la.
Nos Estados Unidos, a lei exige que médicos e laboratórios relatem casos de criptosporidiose aos departamentos de saúde locais ou estaduais. Esses departamentos reportam-se ao Centro de Controle e Prevenção de Doenças . A melhor maneira de prevenir o contágio e a disseminação da criptosporidiose é ter uma boa higiene e saneamento. Um exemplo seria lavar as mãos. A prevenção consiste em lavar as mãos cuidadosamente após ir ao banheiro ou entrar em contato com as fezes , e antes de comer. As pessoas devem evitar o contato com fezes de animais. Eles também devem evitar alimentos e água possivelmente contaminados. Além disso, as pessoas devem evitar o envolvimento em atividades sexuais que possam expô-las às fezes.
A filtragem de água padrão pode não ser suficiente para eliminar Cryptosporidium ; ferver por pelo menos 1 minuto (3 minutos acima de 6.500 pés (2.000 m) de altitude) irá descontaminá-lo. Aquecer o leite a 71,7 ° C (161 ° F) por 15 segundos pasteuriza-o e pode destruir a capacidade dos oocistos de infectar. A água também pode se tornar segura filtrando com um filtro com tamanho de poro não superior a 1 micrômetro, ou por filtros que foram aprovados para “remoção de cisto” pela NSF International National Sanitation Foundation . A água potável engarrafada tem menos probabilidade de conter Cryptosporidium , especialmente se a água for de uma fonte subterrânea.
Pessoas com criptosporidiose não devem nadar em áreas comuns porque o patógeno pode residir nas áreas anal e genital e ser eliminado. Eles devem esperar pelo menos duas semanas após o término da diarreia antes de entrar em fontes de água públicas, uma vez que os oocistos ainda podem ser eliminados por um tempo. Além disso, eles devem ficar longe de pessoas imunossuprimidas. Pessoas imunocomprometidas devem tomar cuidado para se proteger da água de lagos e riachos. Eles também devem ficar longe de fezes de animais e lavar as mãos após tocar nos animais. Para ser seguro, eles devem ferver ou filtrar a água. Eles também devem lavar e cozinhar seus vegetais.
O CDC dos EUA observa a recomendação de muitos departamentos de saúde pública para embeber superfícies contaminadas por 20 minutos com peróxido de hidrogênio a 3% (taxa de morte de 99%) e, em seguida, enxágue-as completamente, com a ressalva de que nenhum desinfetante tem garantia de ser completamente eficaz contra Cryptosporidium . No entanto, o peróxido de hidrogênio é mais eficaz do que as soluções de alvejante padrão.
Tratamento
O tratamento sintomático envolve principalmente a reidratação de fluidos , reposição de eletrólitos (sódio, potássio, bicarbonato e glicose) e agentes antimotilidade (por exemplo, loperamida ). O zinco suplementar pode melhorar os sintomas, particularmente em infecções recorrentes ou persistentes ou em outras pessoas com risco de deficiência de zinco .
Imunocompetente
Indivíduos imunocompetentes com criptosporidiose tipicamente sofrem um curso autolimitado de diarreia curto (isto é, duração de menos de 2 semanas) que pode requerer tratamento sintomático e termina com recuperação espontânea; em algumas circunstâncias, pode ser necessária medicação antiparasitária (por exemplo, sintomas recorrentes, graves ou persistentes); entretanto, a reinfecção ocorre freqüentemente.
Em 2015, a nitazoxanida é o único tratamento com medicamento antiparasitário com eficácia comprovada para criptosporidiose em indivíduos imunocompetentes; no entanto, ele carece de eficácia em pacientes gravemente imunocomprometidos . Certos agentes, como paromomicina e azitromicina, às vezes também são usados, mas têm eficácia apenas parcial.
Imunocomprometido
Em indivíduos imunocomprometidos , como pacientes com AIDS, a criptosporidiose se resolve lentamente ou não se resolve, e freqüentemente causa uma forma particularmente grave e persistente de diarreia aquosa, juntamente com uma capacidade muito reduzida de absorver nutrientes essenciais através do trato intestinal. Como resultado, os indivíduos infectados podem sofrer desidratação grave, desequilíbrios eletrolíticos, desnutrição, definhamento e, potencialmente, morte. Em geral, a taxa de mortalidade para pacientes infectados com AIDS é baseada na contagem de marcadores CD4 + . Pacientes com contagens de CD4 + acima de 180 células / mm³ se recuperam com cuidados hospitalares de suporte e medicação; mas, em pacientes com contagens de CD4 + abaixo de 50 células / mm³, os efeitos são geralmente fatais em 3 a 6 meses. Durante a epidemia de criptosporidiose de Milwaukee (a maior do tipo), 73% dos pacientes com AIDS com contagens de CD4 + inferiores a 50 células / mm³ e 36% daqueles com contagens entre 50 e 200 células / mm³ morreram no primeiro ano de contração da infecção .
A melhor abordagem de tratamento é melhorar o estado imunológico em indivíduos imunodeficientes usando terapia antirretroviral altamente ativa que inclui um inibidor da protease do HIV junto com o uso contínuo de medicação antiparasitária . O tratamento com medicamentos antiparasitários para indivíduos imunocomprometidos geralmente envolve a combinação de nitazoxanida , paromomicina e azitromicina ; esses medicamentos são apenas parcialmente ativos em pacientes com HIV / AIDS, em comparação com seu efeito em pessoas imunocompetentes. Uma revisão da Cochrane Collaboration recomendou que a nitazoxanida seja considerada para uso no tratamento, apesar de sua eficácia reduzida em indivíduos imunocomprometidos.
Atualmente, pesquisas estão sendo feitas em imunoterapia de base molecular. Por exemplo, derivados sintéticos de isoflavonas demonstraram combater o Cryptosporidium parvum tanto in vitro quanto em estudos com animais. Os derivados da nitazoxanida, conhecidos como tiazolidos , também mostraram resultados promissores in vitro .
Epidemiologia
A criptosporidiose é encontrada em todo o mundo. Causa 50,8% das doenças de veiculação hídrica atribuídas a parasitas. Nos países em desenvolvimento, 8–19% das doenças diarreicas podem ser atribuídas ao Cryptosporidium . Dez por cento da população dos países em desenvolvimento excreta oocistos. Nos países desenvolvidos, o número é menor, de 1 a 3%. A faixa etária mais afetada é a de crianças de 1 a 9 anos.
Na Europa de Leste, a criptosporidiose em humanos e animais é comum, mas existem lacunas consideráveis na vigilância e uma falta de métodos comparáveis, o que limita a compreensão da doença e a detecção de surtos. Pesquisas mostram uma rica diversidade de subtipos zoonóticos do parasita em animais, indicando um rico potencial de transmissão animal para humano.
Aproximadamente 30% dos adultos nos Estados Unidos são soropositivos para criptosporidiose, o que significa que contraíram a infecção em algum momento de suas vidas.
História
O organismo foi descrito pela primeira vez em 1907 por Tyzzer, que reconheceu que era um coccídeo .
Pesquisa
Uma vacina de proteína de superfície de oocisto de Cryptosporidium parvum recombinante ( rCP15 / 60 ) produziu uma resposta de anticorpos em um grande grupo de vacas e também uma resposta de anticorpos em bezerros alimentados com colostro imune rCP15 / 60 produzido por essas vacas vacinadas. Isso é muito promissor. As infecções humanas por Cryptosporidium parvum são particularmente prevalentes e frequentemente fatais em neonatos em países em desenvolvimento e em pessoas imunocomprometidas , como pacientes com AIDS. Não há vacina eficaz disponível comercialmente contra Cryptosporidium parvum , embora a imunização passiva utilizando diferentes proteínas de superfície (glico) de zoito tenha se mostrado promissora. Os estágios de desenvolvimento do ciclo de vida do parasita podem atuar como possíveis alvos para o desenvolvimento de vacinas. O organismo é detectado em 65–97% do abastecimento de água de superfície nos Estados Unidos e é resistente à maioria dos desinfetantes usados para o tratamento de água potável. Os anticorpos no soro de humanos e animais infectados com Cryptosporidium parvum reagem com vários antígenos, um dos quais é uma proteína de 15 kDa ( CP15 ) localizada na superfície do organismo. Esta proteína é uma boa candidata para uso como vacina molecular porque estudos anteriores mostraram que um anticorpo monoclonal para CP15 confere imunidade passiva a camundongos. Atualmente, não existe vacina ou terapia medicamentosa totalmente eficaz contra o Cryptosporidium parvum em indivíduos com HIV / AIDS.
Um resumo das descobertas apresentadas no simpósio internacional mais recente (junho de 2019) sobre Cryptosporidium foi publicado em 2020.
Outros animais
Os reservatórios zoonóticos mais importantes são bovinos , ovinos e caprinos . Além disso, nos últimos anos, a criptosporidiose tem atormentado muitos criadores comerciais de lagartixas leopardo . Várias espécies da família Cryptosporidium (C. serpentes e outras) estão envolvidas e, fora das lagartixas, foi encontrado em lagartos-monitores, iguanas e tartarugas, bem como em várias espécies de cobras.
Casos notáveis
Antes de 2000
- Em 1987, 13.000 pessoas em Carrollton, Geórgia, Estados Unidos, adoeceram com criptosporidiose . Este foi o primeiro relato de sua propagação por meio de um sistema municipal de água que atendia a todos os padrões estaduais e federais de água potável.
- Em 1993, um surto de criptosporidiose de veiculação hídrica ocorreu em Milwaukee , Wisconsin, EUA. Estima-se que 403.000 pessoas ficaram doentes, incluindo 4.400 hospitalizadas. Acredita-se que a fonte do Cryptosporidium seja o transbordamento do sistema combinado de saneamento e esgoto pluvial da área de Milwaukee para o Lago Michigan , que foi levado para a estação de purificação de água da Howard Avenue e distribuído para cerca de 880.000 residentes (dos 1,61 milhão de residentes no Milwaukee, que recebem água potável do Lago Michigan). Esses residentes, que recebem água potável do Lago Michigan, foram instruídos a ferver a água antes de bebê-la. Mais pessoas foram afetadas neste único surto do que o número combinado de pessoas afetadas em cada surto de criptosporidiose nos 24 anos desde então. Estima-se que 69 pessoas morreram durante o surto, de acordo com o CDC.
- O maior surto do Reino Unido ocorreu em Torbay , Devon, em 1995.
- No verão de 1996, o Cryptosporidium afetou aproximadamente 2.000 pessoas em Cranbrook, British Columbia , Canadá . Semanas depois, um outro incidente ocorreu em Kelowna, British Columbia , onde 10.000 a 15.000 pessoas adoeceram.
2001–2009
- Em abril de 2001, ocorreu um surto na cidade de North Battleford, Saskatchewan , Canadá. Entre 5800 e 7100 pessoas sofriam de doenças diarreicas e foram confirmados 1907 casos de criptosporidiose. Descobriu-se que falhas de equipamento na antiquada estação de filtragem de água da cidade após a manutenção causaram o surto.
- No verão de 2005, após inúmeros relatos de patronos de distúrbios gastrointestinais, um parque aquático no Parque Estadual de Seneca Lake , na região de Finger Lakes , no interior do estado de Nova York, descobriu que tinha dois tanques de armazenamento de água infectados com Cryptosporidium . No início de setembro de 2005, mais de 3.800 pessoas relataram sintomas de infecção por Cryptosporidium . O "Sprayground" foi fechado para a temporada em 15 de agosto.
- Em outubro de 2005, as áreas de Gwynedd e Anglesey de North Wales , no Reino Unido, sofreram um surto de criptosporidiose. O surto pode ter sido relacionado ao abastecimento de água potável de Llyn Cwellyn , mas isso ainda não foi confirmado. Como resultado, 231 pessoas adoeceram e a empresa Welsh Water (Dwr Cymru) aconselhou 61.000 pessoas a ferver a água antes de usá-la.
- Em março de 2007, uma suspeita de surto ocorreu em Galway , Irlanda , depois que a fonte de água de grande parte do condado, Lough Corrib , foi suspeita de estar contaminada com o parasita. Uma grande população (90.000 pessoas), incluindo áreas da cidade e do condado de Galway, foi aconselhada a ferver água para beber, preparar comida e escovar os dentes. Em 21 de março de 2007, foi confirmado que o abastecimento de água da cidade e do município estava contaminado com o parasita. O abastecimento de água da área foi finalmente aprovado em 20 de agosto de 2007, cinco meses depois que o Cryptosporidium foi detectado pela primeira vez. Sabe-se que cerca de 240 pessoas contraíram a doença; especialistas dizem que o número real pode chegar a 5.000.
- Centenas de piscinas públicas em 20 condados de Utah foram fechadas para crianças em 2007, já que crianças menores de 5 anos têm maior probabilidade de espalhar a doença, especialmente crianças que usam fraldas . Em 10 de setembro de 2007, o Departamento de Saúde de Utah relatou 1.302 casos de criptosporidiose no ano; um número mais comum seria 30. Em 25 de setembro, as piscinas foram reabertas para aqueles que não precisam de fraldas, mas os requisitos de hipercloração não foram suspensos.
- Em 21 de setembro de 2007, um surto de Cryptosporidium atacou o oeste dos Estados Unidos : 230 residentes de Idaho , com centenas em toda a área das Montanhas Rochosas ; nas áreas de Boise e Meridian ; Utah , 1.600 doenças ; Colorado e outros estados ocidentais - Montana , diminuem.
- Em 25 de junho de 2008, Cryptosporidium foi encontrado na Inglaterra em fontes de água em Northampton , Daventry , e em algumas áreas adjacentes fornecidas pelo reservatório de Pitsford , conforme relatado na BBC . As pessoas nas áreas afetadas foram advertidas a não beber água da torneira, a menos que fosse fervida. Anglian Water confirmou que 108.000 famílias foram afetadas, cerca de 250.000 pessoas. Eles informaram que a água pode não ser adequada para consumo humano por muitas semanas. O aviso de fervura foi levantado para todos os clientes afetados em 4 de julho de 2008.
- Ao longo do verão de 2008; muitas áreas de natação públicas, parques aquáticos e piscinas públicas no Metroplex Dallas / Fort Worth do Texas sofreram um surto de criptosporidiose. Burger's Lake em Fort Worth foi o primeiro a relatar tal surto. Isso fez com que alguns, senão todos, as piscinas de propriedade da cidade e privadas fechassem e hiperclorassem. Até o 13 de agosto de 2008 havia 400 casos notificados de Cryptosporidium .
- Em setembro de 2008, uma academia em Cambridge , no Reino Unido, foi forçada a fechar sua piscina até novo aviso, depois que os inspetores de saúde descobriram um surto de criptosporidiose. Autoridades de Saúde Ambiental solicitaram que a água fosse testada depois que foi confirmado que um jovem havia sido infectado.
2010 e mais tarde
- Em maio de 2010, o abastecimento de água do riacho Behana, ao sul de Cairns , Austrália, estava contaminado por cryptosporidium.
- Em julho de 2010, um centro esportivo local em Cumbernauld (Glasgow, Reino Unido) detectou traços de cryptosporidium em suas piscinas, causando o fechamento temporário das mesmas.
- Em novembro de 2010, mais de 4.000 casos de criptosporidiose foram relatados em Östersund , Suécia. A fonte de contaminação foi a água da torneira. Em meados de dezembro de 2010, o número de casos registrados era de 12.400, de acordo com a mídia local.
- Em abril de 2011, havia um surto em andamento em Skellefteå , Suécia. Embora muitas pessoas tenham sido diagnosticadas com criptosporidiose, a origem do parasita ainda não foi encontrada. Vários testes foram feitos ao redor da unidade de tratamento de água "Abborren", mas até agora nenhum resultado deu positivo. Os moradores estão sendo aconselhados a ferver a água da torneira enquanto procuram a fonte de contaminação.
- Desde maio de 2011, tem havido um surto em andamento em South Roscommon, na Irlanda. Embora muitas pessoas tenham sido diagnosticadas com criptosporidiose, a origem do parasita ainda não foi encontrada. Os testes continuam e o Conselho do Condado de Roscommon está considerando a introdução da Filtração Ultra Violeta em seu processo de tratamento de água nos próximos 12 meses. Os moradores estão sendo aconselhados a ferver a água da torneira e não há sinais de que esse aviso de fervura seja retirado em um futuro próximo.
- Em maio de 2013, em Roscommon, Irlanda, outro surto de criptosporidiose foi relatado e um aviso de água fervente foi emitido. Esta foi a segunda vez que o parasita foi detectado em um mês no abastecimento de água de Roscommon. A origem de um dos surtos estava ligada à comunidade agrícola. Pelo menos 13 pessoas foram tratadas para criptosporidiose.
Veja também
- Cryptosporidium foi a base do filme para televisão de 1998, Thirst , no qual ele sofre mutação e passa pelos filtros de água de uma cidade.
- Cryptosporidium foi mostrado em três episódios em três temporadas do programa de televisão, Monsters Inside Me
Referências
- White, A. Clinton Jr. (2005). "Criptosporidiose". Em Mandell, G; et al. (eds.). Princípios e prática de doenças infecciosas (6ª ed.). Elsevier . pp. 3215–28.
- Upton, Steve J. (12 de setembro de 2003). "Basic Biology of Cryptosporidium " (Website) . Kansas State University: Laboratório de Parasitologia.
- SJ Brands (Compiler) (2000). "The Taxonomicon & Systema Naturae" (banco de dados do site) . Táxon: Gênero Cryptosporidium . Serviços Taxonômicos Universais, Amsterdã, Holanda.
- Heymann, David (2015). Manual de controle de doenças transmissíveis: um relatório oficial da American Public Health Association . APHA Press, American Public Health Association. ISBN 9780875530185.
links externos
| Classificação | |
|---|---|
| Fontes externas |
|

