Reorganização de Curtius - Curtius rearrangement
| Reorganização de Curtius | |
|---|---|
| Nomeado após | Theodor Curtius |
| Tipo de reação | Reação de rearranjo |
| Identificadores | |
| Portal de Química Orgânica | curtius-rearranjo |
| ID da ontologia RSC | RXNO: 0000054 |
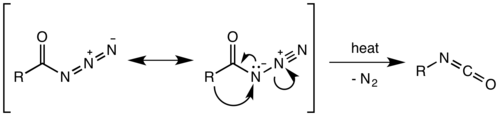
O rearranjo de Curtius (ou reação de Curtius ou degradação de Curtius ), definido pela primeira vez por Theodor Curtius em 1885, é a decomposição térmica de uma acil azida em um isocianato com perda de gás nitrogênio . O isocianato então sofre ataque por uma variedade de nucleófilos , como água, álcoois e aminas , para produzir uma amina primária, carbamato ou derivado de ureia, respectivamente. Vários comentários foram publicados.
Preparação de acil azida
A acil azida é normalmente feita a partir da reação de cloretos de ácido ou anidridos com azida de sódio ou trimetilsilil azida . As acil azidas também são obtidas a partir do tratamento de acilhidrazinas com ácido nitroso . Alternativamente, a acilazida pode ser formada pela reação direta de um ácido carboxílico com difenilfosforilazida (DPPA).
Mecanismo de reação
Acreditava-se que o rearranjo de Curtius era um processo de duas etapas, com a perda de gás nitrogênio formando um acil nitreno , seguido pela migração do grupo R para dar o isocianato . No entanto, pesquisas recentes indicaram que a decomposição térmica é um processo concertado , com as duas etapas acontecendo juntas, devido à ausência de qualquer inserção de nitreno ou subprodutos de adição observados ou isolados na reação. Os cálculos termodinâmicos também suportam um mecanismo combinado.
A migração ocorre com retenção total da configuração no R-group. A aptidão migratória do grupo R é aproximadamente terciária> secundária ~ aril> primária. O isocianato formado pode então ser hidrolisado para dar uma amina primária , ou sofrer ataque nucleofílico com álcoois e aminas para formar carbamatos e derivados de ureia, respectivamente.
Modificações
A pesquisa mostrou que o rearranjo de Curtius é catalisado por ambos os ácidos de Brønsted e Lewis , através da protonação ou coordenação do átomo de oxigênio acila, respectivamente. Por exemplo, Fahr e Neumann mostraram que o uso de trifluoreto de boro ou catalisador de tricloreto de boro reduz a temperatura de decomposição necessária para o rearranjo em cerca de 100 ° C e aumenta o rendimento do isocianato significativamente.
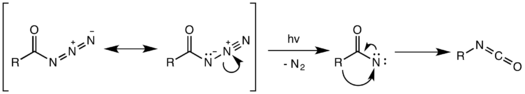
Reorganização fotoquímica
A decomposição fotoquímica da acil azida também é possível. No entanto, o rearranjo fotoquímico não é coordenado e, em vez disso, ocorre por um intermediário de nitreno , formado pela clivagem da ligação N – N fraca e pela perda de gás nitrogênio. O nitreno altamente reativo pode sofrer uma variedade de reações de nitreno, como inserção e adição de nitreno, resultando em produtos colaterais indesejados. No exemplo abaixo, o intermediário de nitreno se insere em uma das ligações C – H do solvente de ciclohexano para formar N-ciclohexilbenzamida como um produto secundário.
Variações
Degradação de Darapsky
Em uma variação chamada degradação de Darapsky , ou síntese de Darapsky , um rearranjo de Curtius ocorre como uma das etapas na conversão de um α-cianoéster em um aminoácido . A hidrazina é usada para converter o éster em uma acilhidrazina , que é reagida com ácido nitroso para dar a acil azida. O aquecimento da azida em etanol produz o carbamato de etila por meio do rearranjo Curtius. A hidrólise ácida produz a amina do carbamato e o ácido carboxílico do nitrila simultaneamente, dando o produto aminoácido.
Reação de Harger
A migração fotoquímica do tipo Curtius e o rearranjo de uma azida fosfínica formam um metafosfonimidato no que também é conhecido como reação de Harger (em homenagem ao Dr. Martin Harger da Universidade de Leicester ). Isto é seguido por hidrólise, no exemplo abaixo com metanol , para dar um fosfonamidato.
Ao contrário do rearranjo de Curtius, há uma escolha de grupos R na azida fosfínica que podem migrar. Harger descobriu que os grupos alquil migram preferencialmente para grupos aril, e essa preferência aumenta na ordem metil <primário <secundário <terciário. Isso provavelmente se deve a fatores estéricos e conformacionais, pois quanto mais volumoso o grupo R, menos favorável é a conformação para a migração de fenil.
Aplicações sintéticas
O rearranjo de Curtius é tolerante a uma grande variedade de grupos funcionais e tem uma utilidade sintética significativa, já que muitos grupos diferentes podem ser incorporados dependendo da escolha do nucleófilo usado para atacar o isocianato.
Por exemplo, quando levada a cabo na presença de terc -butanol , a reacção gera Boc - protegidas aminas, intermediários úteis em síntese orgânica . Da mesma forma, quando a reação de Curtius é realizada na presença de álcool benzílico , aminas protegidas com Cbz são formadas.
O rearranjo de Curtius é utilizado na síntese dos fármacos tranilcipromina , candesartana , bromadol , tergurida , benzidamina , gabapentina , igmesina e tecadenosona .
Triquinaceno
RB Woodward et al. usou o rearranjo de Curtius como uma das etapas na síntese total do poliquinano triquinaceno em 1964. Após a hidrólise do éster no intermediário ( 1 ), um rearranjo de Curtius foi efetuado para converter os grupos de ácido carboxílico em ( 2 ) para o metil grupos carbamato ( 3 ) com rendimento de 84%. As etapas adicionais deram triquinaceno ( 4 ).
Oseltamivir
Na sua síntese do antiviral droga oseltamivir , também conhecido como Tamiflu, Ishikawa et al. usou o rearranjo de Curtius em uma das etapas principais na conversão da acil azida no grupo amida na molécula alvo. Nesse caso, o isocianato formado pelo rearranjo é atacado por um ácido carboxílico para formar a amida. As reações subsequentes podem todas ser realizadas no mesmo vaso de reação para dar o produto final com 57% de rendimento global. Um benefício importante da reação de Curtius destacado pelos autores é que ela pode ser realizada em temperatura ambiente, minimizando o risco de aquecimento. O esquema geral foi altamente eficiente, exigindo apenas três operações de “um recipiente” para produzir este medicamento importante e valioso usado para o tratamento da gripe aviária .
Dievodiamina
A dievodiamina é um produto natural da planta Evodia rutaecarpa, amplamente utilizada na medicina tradicional chinesa . A síntese total de dievodiamina sem grupo protetor de Unsworth et al. Utiliza o rearranjo de Curtius na primeira etapa da síntese, catalisada por trifluoreto de boro . O isocianato ativado então reage rapidamente com o anel indol em uma reação de substituição aromática eletrofílica para dar a amida com 94% de rendimento, e as etapas subsequentes dão dievodamina.
Veja também
- Rearranjo de Beckmann
- Degradação de Bergmann
- Reorganização de Hofmann
- Reorganização Lossen
- Reação de Schmidt
- Reorganização de Tiemann
- Reorganização de Neber
- Reorganização de Wolff