Ciclopentadieno - Cyclopentadiene
|
|
|||

|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Ciclopenta-1,3-dieno |
|||
| Outros nomes
1,3-ciclopentadieno
piropentileno |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| Abreviações | CPD, HCp | ||
| 471171 | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard |
100,008,033 |
||
| Número EC | |||
| 1311 | |||
| Malha | 1,3-ciclopentadieno | ||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 5 H 6 | |||
| Massa molar | 66,103 g · mol −1 | ||
| Aparência | Líquido incolor | ||
| Odor | irritante, semelhante ao terpeno | ||
| Densidade | 0,786 g cm −3 | ||
| Ponto de fusão | −90 ° C; -130 ° F; 183 K | ||
| Ponto de ebulição | 39 a 43 ° C; 102 a 109 ° F; 312 a 316 K | ||
| insolúvel | |||
| Pressão de vapor | 400 mmHg (53 kPa) | ||
| Acidez (p K a ) | 16 | ||
| Base conjugada | Ânion ciclopentadienil | ||
| −44,5 × 10 −6 cm 3 mol −1 | |||
| Estrutura | |||
| Planar | |||
| Termoquímica | |||
|
Capacidade de calor ( C )
|
115,3 JK −1 mol −1 | ||
|
Entropia molar padrão ( S |
182,7 JK −1 mol −1 | ||
| Perigos | |||
| Ponto de inflamação | 25 ° C (77 ° F; 298 K) | ||
| Dose ou concentração letal (LD, LC): | |||
|
LC 50 ( concentração média )
|
14.182 ppm (rato, 2 horas) 5091 ppm (camundongo, 2 horas) |
||
| NIOSH (limites de exposição à saúde dos EUA): | |||
|
PEL (permitido)
|
TWA 75 ppm (200 mg / m 3 ) | ||
|
REL (recomendado)
|
TWA 75 ppm (200 mg / m 3 ) | ||
|
IDLH (perigo imediato)
|
750 ppm | ||
| Compostos relacionados | |||
|
Hidrocarbonetos Relacionados
|
Benzeno Ciclobutadieno Ciclopenteno |
||
|
Compostos relacionados
|
Diciclopentadieno | ||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
Ciclopentadieno é um composto orgânico com a fórmula C 5 H 6 . É muitas vezes abreviado CpH porque o ânion ciclopentadienil é abreviado Cp - .
Este líquido incolor tem um odor forte e desagradável . Em temperatura ambiente, este dieno cíclico se dimeriza ao longo de horas para dar diciclopentadieno por meio de uma reação de Diels-Alder . Este dímero pode ser restaurado por aquecimento para dar o monômero.
O composto é usado principalmente para a produção de ciclopenteno e seus derivados. É popularmente usado como um precursor do ânion ciclopentadienil (Cp - ), um importante ligante em complexos ciclopentadienil em química organometálica .
Produção e reações
A produção de ciclopentadieno geralmente não se distingue do diciclopentadieno, uma vez que eles se interconvertem. São obtidos do alcatrão de carvão (cerca de 10–20 g / tonelada) e do craqueamento a vapor da nafta (cerca de 14 kg / tonelada). Para obter o monômero de ciclopentadieno, o diciclopentadieno comercial é quebrado por aquecimento a cerca de 180 ° C. O monômero é coletado por destilação e usado logo em seguida. É aconselhável usar alguma forma de coluna de fracionamento ao fazer isso, para remover o dímero não rachado em refluxo.
Reorganização sigmatrópica
Os átomos de hidrogênio no ciclopentadieno sofrem mudanças rápidas [1,5] -sigmatrópicas, conforme indicado pelos espectros de 1 H NMR registrados em várias temperaturas. Ainda mais fluxionais são os derivados C 5 H 5 E (CH 3 ) 3 (E = Si , Ge , Sn ), em que o elemento mais pesado migra de carbono para carbono com uma barreira de baixa ativação.
Reações de Diels-Alder
O ciclopentadieno é um dieno altamente reativo na reação de Diels-Alder porque a distorção mínima do dieno é necessária para atingir a geometria do envelope do estado de transição em comparação com outros dienos. Notoriamente, o ciclopentadieno se dimeriza. A conversão ocorre em horas à temperatura ambiente, mas o monômero pode ser armazenado por dias a -20 ° C.
Deprotonação
O composto é excepcionalmente ácido (p K a = 16) para um hidrocarboneto , fato explicado pela alta estabilidade do ânion ciclopentadienil aromático , C
5H-
5. A desprotonação pode ser realizada com uma variedade de bases, tipicamente hidreto de sódio, sódio metálico e butil-lítio . Os sais deste ânion estão comercialmente disponíveis, incluindo o ciclopentadienido de sódio e o ciclopentadieneto de lítio . Eles são usados para preparar complexos de ciclopentadienil .
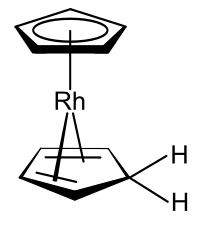
Derivados de metaloceno
Metalocenos e derivados de ciclopentadienil relacionados têm sido amplamente investigados e representam uma pedra angular da química organometálica devido à sua alta estabilidade. O primeiro metaloceno caracterizado, o ferroceno , foi preparado da mesma forma que muitos outros metalocenos: combinando derivados de metais alcalinos da forma MC 5 H 5 com dihaletos dos metais de transição : Como exemplo típico, o níqueloceno se forma ao tratar cloreto de níquel (II) com ciclopentadienida de sódio em THF .
- NiCl 2 + 2 NaC 5 H 5 → Ni (C 5 H 5 ) 2 + 2 NaCl
Complexos organometálicos que incluem o ânion ciclopentadienil e o próprio ciclopentadieno são conhecidos, um exemplo dos quais é o derivado de rodoceno produzido a partir do monômero de rodoceno em solventes próticos .
Síntese orgânica
Foi o material inicial na síntese de dodecaedro de Leo Paquette em 1982 . A primeira etapa envolveu a dimerização redutiva da molécula para dar dihidrofulvaleno , não uma simples adição para dar diciclopentadieno.
Usos
Além de servir como um precursor para catalisadores à base de ciclopentadienil, a principal aplicação comercial do ciclopentadieno é como um precursor de comonômeros . A semi-hidrogenação dá ciclopenteno . A reação de Diels-Alder com butadieno dá etilideno norborneno , um comonômero na produção de borrachas de EPDM .
Derivados

O ciclopentadieno pode substituir um ou mais hidrogênios, formando derivados com ligações covalentes:
- Ciclopentadienos volumosos
- Calicene
- Ciclopentadienona
- Di- terc -butylcyclopentadiene
- Metilciclopentadieno
- Pentametilciclopentadieno
- Pentacianociclopentadieno
A maioria desses ciclopentadienos substituídos também pode formar ânions e se juntar a complexos de ciclopentadienil .