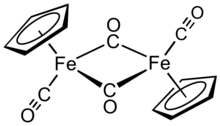
Dímero de dicarbonil ciclopentadienil ferro - Cyclopentadienyliron dicarbonyl dimer
|
|
|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Di-μ-carbonildicarbonilbis (η 5 -ciclopenta-2,4-dien-1-il) diiron
|
|
| Outros nomes
Bis (ciclopentadienil) tetracarbonil-diiron,
Di (ciclopentadienil) tetracarbonil-diiron, Bis (dicarbonilciclopentadieniliron) |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.032.057 |
| Número EC | |
|
PubChem CID
|
|
|
|
|
|
| Propriedades | |
| C 14 H 10 Fe 2 O 4 | |
| Massa molar | 353,925 g / mol |
| Aparência | Cristais roxos escuros |
| Densidade | 1,77 g / cm 3 , sólido |
| Ponto de fusão | 194 ° C (381 ° F; 467 K) |
| Ponto de ebulição | decomposição |
| insolúvel | |
| Solubilidade em outros solventes | benzeno, THF, clorocarbonos |
| Estrutura | |
| octaédrico distorcido | |
| 3,1 D (solução de benzeno) | |
| Perigos | |
| Riscos principais | Fonte de CO |
| Pictogramas GHS |
  
|
| Palavra-sinal GHS | Perigo |
| H228 , H302 , H331 , H330 | |
| Compostos relacionados | |
|
Compostos relacionados
|
Fe (C 5 H 5 ) 2 Fe (CO) 5 |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O dímero de ciclopentadieniliron dicarbonil é um composto organometálico com a fórmula [( η 5 -C 5 H 5 ) Fe (CO) 2 ] 2 , frequentemente abreviado para Cp 2 Fe 2 (CO) 4 , [CpFe (CO) 2 ] 2 ou mesmo Fp 2 , com o nome coloquial "dímero fip". É um sólido cristalino roxo-avermelhado escuro, que é prontamente solúvel em solventes orgânicos moderadamente polares, como clorofórmio e piridina , mas menos solúvel em tetracloreto de carbono e dissulfeto de carbono . O Cp 2 Fe 2 (CO) 4 é insolúvel, mas estável em relação à água. Cp 2 Fe 2 (CO) 4 é razoavelmente estável para armazenamento sob ar e serve como um material de partida conveniente para acessar outros derivados de Fp (CpFe (CO) 2 ) (descritos abaixo).
Estrutura
Em solução, o Cp 2 Fe 2 (CO) 4 pode ser considerado um complexo semi-sanduíche dimérico . Ele existe em três formas isoméricas: cis , trans e uma forma aberta sem ponte. Essas formas isoméricas são diferenciadas pela posição dos ligantes. Os isômeros cis e trans diferem na posição relativa dos ligantes C 5 H 5 (Cp). Os isômeros cis e trans possuem a formulação [( η 5 -C 5 H 5 ) Fe (CO) ( μ -CO)] 2 , ou seja, dois ligantes CO são terminais enquanto os outros dois ligantes CO fazem a ponte entre os átomos de ferro. Os isômeros cis e trans se interconvertem através do isômero aberto, que não possui ligantes de ponte entre os átomos de ferro. Em vez disso, é formulado como ( η 5 -C 5 H 5 ) (OC) 2 Fe − Fe (CO) 2 ( η 5 -C 5 H 5 ) - os metais são mantidos juntos por uma ligação ferro-ferro. Em equilíbrio, os isômeros cis e trans são predominantes.
Além disso, os carbonilas terminais e de ponte são conhecidos por sofrerem troca: o isômero trans pode sofrer troca de ligante CO terminal de ponte através do isômero aberto, ou por meio de um movimento de torção sem passar pela forma aberta. Em contraste, os ligantes de CO terminal e de ponte do isômero cis podem apenas trocar por meio do isômero aberto.
Em solução, os isômeros cis , trans e aberto se interconvertem rapidamente à temperatura ambiente, tornando a estrutura molecular fluxional . O processo fluxional para dímero de ciclopentadieniliron dicarbonil é mais rápido do que a escala de tempo de NMR, de modo que apenas uma média de um único sinal Cp é observado no espectro de 1 H NMR a 25 ° C. Da mesma forma, o espectro de 13 C NMR exibe um sinal agudo de CO acima de -10 ° C, enquanto o sinal Cp se agudiza a um pico acima de 60 ° C. Estudos de NMR indicam que o isômero cis é ligeiramente mais abundante do que o isômero trans à temperatura ambiente, enquanto a quantidade da forma aberta é pequena. O processo fluxional não é rápido o suficiente para produzir a média no espectro de IV . Assim, três absorções são vistas para cada isômero. Os ligantes CO em ponte aparecem por volta de 1780 cm -1, enquanto os ligantes CO terminais são observados por volta de 1980 cm -1 . A estrutura média desses isômeros do Cp 2 Fe 2 (CO) 4 resulta em um momento de dipolo de 3,1 D no benzeno .
A estrutura molecular de estado sólido de ambos os isômeros cis e trans foi analisada por raios-X e difração de nêutrons . A separação Fe-Fe e os comprimentos de ligação Fe-C são os mesmos nos rombóides Fe 2 C 2 , um Fe 2 C 2 anel de quatro membros exatamente planar no isômero trans versus um romboide dobrado em cis com um ângulo de 164 ° , e distorções significativas no anel Cp do isômero trans refletindo diferentes populações orbitais Cp. Embora livros didáticos mais antigos mostrem os dois átomos de ferro ligados entre si, análises teóricas indicam a ausência de uma ligação Fe-Fe direta. Esta visão é consistente com cálculos e dados cristalográficos de raios-X que indicam uma falta de densidade significativa de elétrons entre os átomos de ferro. No entanto, Labinger oferece uma visão divergente, baseada principalmente na reatividade química e dados espectroscópicos, argumentando que a densidade do elétron não é necessariamente a melhor indicação da presença de uma ligação química. Além disso, sem uma ligação Fe-Fe, as carbonilas em ponte devem ser formalmente tratadas como um ligante μ-X 2 e um ligante μ-L para que os centros de ferro satisfaçam a regra dos 18 elétrons . Argumenta-se que este formalismo fornece implicações enganosas com respeito ao comportamento químico e espectroscópico dos grupos carbonila.
Síntese
O Cp 2 Fe 2 (CO) 4 foi preparado pela primeira vez em 1955 em Harvard por Geoffrey Wilkinson usando o mesmo método empregado hoje: a reação do ferro pentacarbonil e diciclopentadieno .
- 2 Fe (CO) 5 + C 10 H 12 → ( η 5 -C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
Nessa preparação, o diciclopentadieno se quebra para dar o ciclopentadieno, que reage com o Fe (CO) 5 com perda de CO . Depois disso, as vias para as rotas fotoquímicas e térmicas diferem sutilmente, mas ambas envolvem a formação de um intermediário de hidreto . O método é utilizado no laboratório de ensino.
Reações
Embora sem grande valor comercial, Fp 2 é um burro de carga na química organometálica porque é barato e os derivados FpX são robustos (X = haleto, organil).
"Fp - " (FpNa e FpK)
A clivagem redutiva de [CpFe (CO) 2 ] 2 (formalmente um complexo de ferro (I)) produz derivados de metais alcalinos formalmente derivados do ânion dicarbonil ciclopentadienil ferro, [CpFe (CO) 2 ] - ou chamado Fp - (formalmente ferro (0) ), que presume-se que existam como um par de íons apertados . Um redutor típico é o metal de sódio ou amálgama de sódio ; Liga de NaK , grafite de potássio (KC 8 ) e trialquilboro-hidretos de metal alcalino têm sido usados. [CpFe (CO) 2 ] Na é um reagente amplamente estudado, uma vez que é prontamente alquilado, acilado ou metalado por tratamento com um eletrófilo apropriado . É um excelente nucleófilo S N 2, sendo uma a duas ordens de magnitude mais nucleofílico do que o tiofenolato, PhS - quando reagido com brometos de alquila primários e secundários.
- [CpFe (CO) 2 ] 2 + 2 Na → 2 CpFe (CO) 2 Na
- [CpFe (CO) 2 ] 2 + 2 KBH (C 2 H 5 ) 3 → 2 CpFe (CO) 2 K + H 2 + 2 B (C 2 H 5 ) 3
O tratamento de NaFp com um haleto de alquila (RX, X = Br, I) produz FeR ( η 5 -C 5 H 5 ) (CO) 2
- CpFe (CO) 2 K + CH 3 I → CpFe (CO) 2 CH 3 + KI
O Fp 2 também pode ser clivado com metais alcalinos e por redução eletroquímica .
FpX (X = Cl, Br, I)
Halogênios clivam oxidativamente [CpFe (CO) 2 ] 2 para dar a espécie Fe (II) FpX (X = Cl, Br, I):
- [CpFe (CO) 2 ] 2 + X 2 → 2 CpFe (CO) 2 X
Um exemplo é o iodeto de ciclopentadienil-ferro-dicarbonil .
Fp ( η 2 -alqueno) + , Fp ( η 2 -alquino) + e outro "Fp + "
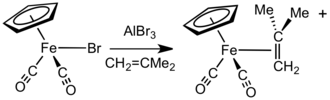
Na presença de aceitadores de ânions haleto, como AlBr 3 ou Ag BF 4 , os compostos FpX (X = haleto) reagem com alcenos , alcinos ou ligantes lábeis neutros (como éteres e nitrilos ) para produzir complexos Fp + . Em outra abordagem, os sais de [Fp (isobuteno)] + são prontamente obtidos pela reação de NaFp com cloreto de metalila seguida por protonólise. Este complexo é um precursor conveniente e geral para outros complexos catiônicos Fp-alqueno e Fp-alquino. O processo de troca é facilitado pela perda de isobuteno gasoso e volumoso . Geralmente, os alcenos menos substituídos se ligam mais fortemente e podem deslocar mais ligantes de alceno impedidos. Os complexos de alceno e alcino também podem ser preparados aquecendo um éter catiônico ou complexo aquático, por exemplo [Fp ( thf )]+
BF-
4, com o alceno ou alcino. [FpL]+
BF-
4complexos também podem ser preparados por tratamento de FpMe com HBF 4 · Et 2 O em CH 2 Cl 2 a -78 ° C, seguido pela adição de L.
Alceno complexos -FP também pode ser preparado a partir de Fp anião indirectamente. Assim, a abstração de hidreto de compostos Fp-alquil usando hexafluorofosfato de trifenilmetil resulta em complexos [Fp (α-alqueno)] + .
- FpNa + RCH 2 CH 2 I → FpCH 2 CH 2 R + NaI
- FpCH 2 CH 2 R + Ph 3 CPF 6 → [Fp (CH
2= CHR)+
] PF-
6 + Ph 3 CH
A reação de NaFp com um epóxido seguida por desidratação promovida por ácido também fornece complexos de alceno. Fp (alceno) + são estáveis em relação à bromação , hidrogenação e acetoximercuração , mas o alceno é facilmente liberado com iodeto de sódio em acetona ou por aquecimento com acetonitrila .
O ligante alceno nesses cátions é ativado para o ataque de nucleófilos , abrindo caminho para uma série de reações de formação de ligações carbono-carbono . As adições nucleofílicas geralmente ocorrem no carbono mais substituído. Esta regioquímica é atribuída à maior densidade de carga positiva nesta posição. O regiocontrole costuma ser modesto. A adição do nucleófilo é completamente estereosseletiva , ocorrendo anti ao grupo Fp. Os complexos Fp (alcino) + análogos também são relatados como sujeitos a reações de adição nucleofílica por vários nucleófilos de carbono, nitrogênio e oxigênio.
Os complexos Fp (alceno) + e Fp (alcino) + π também são bastante ácidos nas posições alílico e propargílico, respectivamente, e podem ser desprotonados quantitativamente com bases de amina como Et 3 N para dar Fp-alil neutro e Fp-alenil σ -complexos (eqn 1).
- (1) Fp (H
2C = CHCH
2CH
3)+
BF-
4+ Et 3 N → FpCH 2 CH = CHCH 3 + Et
3NH+
BF-
4 - (2) FpCH 2 CH = CHCH 3 + E+
BF-
4→ Fp (H
2C = CHCH ( E ) CH
3)+
BF-
4
Fp-alil e Fp-alenil reagem com eletrófilos catiônicos E (como Me 3 O + , carbocations , íons oxocarbênio ) para gerar produtos de funcionalização alílico e propargílico, respectivamente (eq. 2). Foi demonstrado que o complexo relacionado [Cp * Fe (CO) 2 (thf)] + [BF 4 ] - catalisa a funcionalização C − H propargílico e alílico combinando os processos de desprotonação e funcionalização eletrofílica descritos acima.
Os complexos η 2- alenil de Fp + e cátions dicarbonil ciclopentadieniliron substituídos também foram caracterizados, com análise cristalográfica de raios-X mostrando curvatura substancial no carbono alênico central (ângulo de ligação <150 °).
Reagentes de ciclopropanação à base de Fp
Reagentes baseados em Fp foram desenvolvidos para ciclopropanações . O reagente chave é preparado a partir de FpNa com um tioéter e iodeto de metila , e tem uma boa vida útil, em contraste com intermediários e diazoalcanos Simmons-Smith típicos .
- FpNa + ClCH 2 SCH 3 → FpCH 2 SCH 3 + NaCl
- FpCH 2 SCH 3 + CH 3 I + NaBF 4 → FpCH 2 S (CH 3 ) 2 ] BF 4 + NaI
O uso de [FpCH 2 S (CH 3 ) 2 ] BF 4 não requer condições especializadas.
-
Fp (CH
2S+
(CH
3)
2) BF-
4 + (Ph) 2 C = CH 2 → 1,1-difenilciclopropano +…
O cloreto de ferro (III) é adicionado para destruir qualquer subproduto.
Precursores para Fp = CH+
2, como FpCH 2 OMe que é convertido no carbeno de ferro após a protonação, também foram usados como reagentes de ciclopropanação.
Reação fotoquímica
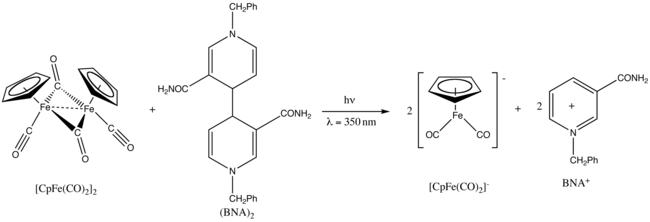
Fp 2 exibe fotoquímica . Após a irradiação de UV a 350 nm, é reduzido por dímero de 1-benzil-1,4-di-hidronicotinamida , (BNA) 2 .



![Adição de carbanião a [Fp (alceno)] +.](https://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/FpMalonateRxn.png/330px-FpMalonateRxn.png)