Ciclopropano - Cyclopropane

|
|||
|
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Ciclopropano |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100.000.771 |
||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 3 H 6 | |||
| Massa molar | 42,08 g / mol | ||
| Aparência | Gás incolor | ||
| Odor | Cheiroso doce | ||
| Densidade | 1,879 g / L (1 atm, 0 ° C) | ||
| Ponto de fusão | −128 ° C (−198 ° F; 145 K) | ||
| Ponto de ebulição | −33 ° C (−27 ° F; 240 K) | ||
| Acidez (p K a ) | ~ 46 | ||
| -39,9 · 10 −6 cm 3 / mol | |||
| Perigos | |||
| Riscos principais | Asfixiante altamente inflamável |
||
| Ficha de dados de segurança | MSDS externo | ||
| NFPA 704 (diamante de fogo) | |||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
Ciclopropano é o cicloalcano com a fórmula molecular (CH 2 ) 3 , consistindo em três grupos metileno (CH 2 ) ligados entre si para formar um anel. O pequeno tamanho do anel cria uma tensão substancial do anel na estrutura. O ciclopropano em si é principalmente de interesse teórico, mas muitos de seus derivados são de importância comercial ou biológica.
História
O ciclopropano foi descoberto em 1881 por August Freund , que também propôs a estrutura correta para a substância em seu primeiro artigo. Freund tratou 1,3-dibromopropano com sódio , causando uma reação de Wurtz intramolecular levando diretamente ao ciclopropano. O rendimento da reação foi melhorado por Gustavson em 1887 com o uso de zinco em vez de sódio. O ciclopropano não tinha aplicação comercial até Henderson e Lucas descobrirem suas propriedades anestésicas em 1929; a produção industrial havia começado em 1936. Na prática anestésica moderna, foi substituída por outros agentes.
Anestesia
O ciclopropano foi introduzido no uso clínico pelo anestesista americano Ralph Waters, que usava um sistema fechado com absorção de dióxido de carbono para conservar esse agente, então caro. O ciclopropano é um agente relativamente potente, não irritante e de cheiro doce com uma concentração alveolar mínima de 17,5% e um coeficiente de partição sangue / gás de 0,55. Isso significava que a indução da anestesia por inalação de ciclopropano e oxigênio era rápida e não desagradável. No entanto, na conclusão da anestesia prolongada, os pacientes podem sofrer uma queda repentina da pressão arterial, podendo levar à disritmia cardíaca : uma reação conhecida como "choque ciclopropano". Por esse motivo, além de seu alto custo e natureza explosiva, foi posteriormente utilizado apenas para indução anestésica, não estando disponível para uso clínico desde meados da década de 1980. Os cilindros e medidores de vazão eram coloridos de laranja.
Farmacologia
O ciclopropano é inativo nos receptores GABA A e glicina e, em vez disso, atua como um antagonista do receptor NMDA . Também inibe o receptor AMPA e os receptores nicotínicos de acetilcolina e ativa certos canais K 2P .
Estrutura e ligação
A estrutura triangular do ciclopropano requer que os ângulos de ligação entre as ligações covalentes carbono-carbono sejam de 60 °. A molécula tem simetria molecular D 3h . Além da deformação do anel, a molécula também tem deformação de torção devido à conformação eclipsada de seus átomos de hidrogênio. Como tal, as ligações entre os átomos de carbono são consideravelmente mais fracas do que em um alcano típico , resultando em uma reatividade muito maior.
A ligação entre os centros de carbono é geralmente descrita em termos de ligações dobradas . Neste modelo, as ligações carbono-carbono são dobradas para fora de modo que o ângulo interorbital seja de 104 °. Uma consequência incomum da ligação dobrada é que, embora as ligações CC no ciclopropano sejam mais fracas do que o normal, os átomos de carbono também estão mais próximos do que em uma ligação alcano regular: 151 pm versus 153 pm ( ligação alceno média : 146 pm).
A deslocalização dos seis elétrons das três ligações CC σ do ciclopropano foi dada como uma explicação da única cepa ligeiramente maior do ciclopropano ("apenas" 27,6 kcal / mol) em comparação com o ciclobutano (26,2 kcal / mol) com o ciclohexano como referência com E str = 0 kcal / mol. Essa estabilização é chamada de aromaticidade σ, em contraste com a aromaticidade π usual, que, por exemplo, é um efeito altamente estabilizador no benzeno . Outros estudos não suportam o papel da σ-aromaticidade no ciclopropano e a existência de uma corrente de anel induzida; tais estudos fornecem uma explicação alternativa para a estabilização energética e comportamento magnético anormal do ciclopropano.
Síntese
O ciclopropano foi primeiro produzido por meio de um acoplamento de Wurtz , no qual 1,3-dibromopropano foi ciclizado usando sódio . O rendimento desta reação pode ser melhorado pelo uso de zinco como agente desalogenante e iodeto de sódio como catalisador.
- BrCH 2 CH 2 CH 2 Br + 2 Na → (CH 2 ) 3 + 2 NaBr
A preparação de anéis de ciclopropano é referida como ciclopropanação .
Ciclopropanos
 O ácido 1-aminociclopropano-1-carboxílico desempenha um papel importante na biossíntese do hormônio vegetal etileno .
O ácido 1-aminociclopropano-1-carboxílico desempenha um papel importante na biossíntese do hormônio vegetal etileno .
Os derivados de ciclopropano são numerosos. Muitas biomoléculas e drogas farmacêuticas apresentam o anel de ciclopropano. Um exemplo famoso é o ácido aminociclopropanocarboxílico , que é o precursor do etileno , um hormônio vegetal. Os piretróides são a base de muitos inseticidas. Vários ácidos graxos de ciclopropano são conhecidos.
Reações
Devido ao caráter π aumentado de suas ligações CC, o ciclopropano pode reagir como um alceno em certos casos. Por exemplo, ele sofre hidrohalogenação com ácidos minerais para dar haletos de alquila lineares. Os ciclopropanos substituídos também reagem, seguindo a regra de Markovnikov . Ciclopropanos substituídos podem oxidativamente adicionar aos metais de transição , num processo referido como a activação C-C .
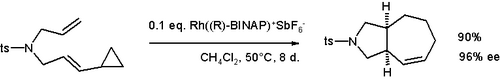
Os grupos ciclopropil adjacentes aos grupos vinil podem sofrer reações de expansão do anel . Os exemplos incluem o rearranjo de vinilciclopropano e o rearranjo de divinilciclopropano-cicloheptadieno . Esta reatividade pode ser explorada para gerar compostos cíclicos incomuns, como ciclobutenos , ou espécies bicíclicas , como o ciclo - hepteno mostrado abaixo.
Segurança
O ciclopropano é altamente inflamável. No entanto, apesar de sua energia de deformação, não é substancialmente mais explosivo do que outros alcanos .
Veja também
- O tetraedro contém quatro anéis de ciclopropano fundidos que formam as faces de um tetraedro
- O propelano contém três anéis de ciclopropano que compartilham uma única ligação carbono-carbono central.
- Ciclopropeno
- Metileneciclopropano