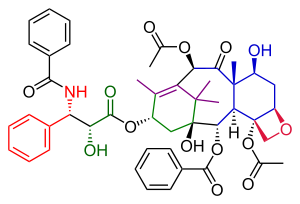
Síntese total de Danishefsky Taxol - Danishefsky Taxol total synthesis
A síntese total de Danishefsky Taxol em química orgânica é uma importante terceira síntese de Taxol publicada pelo grupo de Samuel Danishefsky em 1996, dois anos após os dois primeiros esforços descritos na síntese total de Holton Taxol e na síntese total de Nicolaou Taxol . Combinados, eles fornecem uma boa visão na aplicação da química orgânica na síntese total .
A rota de Danishefsky para Taxol tem muitas semelhanças com a de Nicolaou. Ambos são exemplos de síntese convergente com um acoplamento dos anéis A e C de dois precursores. A principal característica da variante Danishefsky é a conclusão do anel D do oxetano no anel C do ciclohexanol antes da construção do anel B de 8 membros. O material de partida mais proeminente é o (+) enantiômero da cetona de Wieland-Miescher . Este composto está disponível comercialmente como um único enantiômero e o único grupo quiral presente nesta molécula é capaz de conduzir toda a sequência de reações orgânicas a um único produto final de Taxol opticamente ativo . A etapa final, a adição da cauda é idêntica à de Nicolaou e é baseada na química Ojima .
Em termos de compra de matéria-prima, esta molécula de taxol consiste na cetona de Wieland-Miescher acima mencionada , 2-metil-3-pentanona , hidreto de alumínio e lítio , tetróxido de ósmio , fenilítio , clorocromato de piridínio , o reagente Corey-Chaykovsky e cloreto de acriloílo . As principais transformações químicas são a reação de Johnson-Corey-Chaykovsky e a reação de Heck .
Retrosíntese
O taxol resultou da adição da cauda da Ojima lactam ao álcool 51 , que é a bacatina III (a molécula alvo original da síntese de Danishefsky). O álcool 51 foi derivado da oxidação alílica da α-acilcetona 49 . O Composto 49 foi finalmente derivado da reação de Heck do triflato de enol 38 , que foi usado para fechar o anel B. O triflato de enol 38 resultou de um rearranjo do composto 31 após proteção de seu grupo hidroxila. Composto 31 foi derivada a partir da ligação dos anéis A e C com o aldeído 21 que combina com o vinil-lítio reagente derivado de cianidrina 29 . A cianoidrina 29 originou-se da etil isopropil cetona ( 22 ). O aldeído 21 foi obtido a partir do composto 17 , que era o produto da abertura do cetal 12 . O cetal 12 foi derivado da cetona Wieland-Miescher ( 1 ).
| Retrosíntese |
|---|
Síntese do anel D
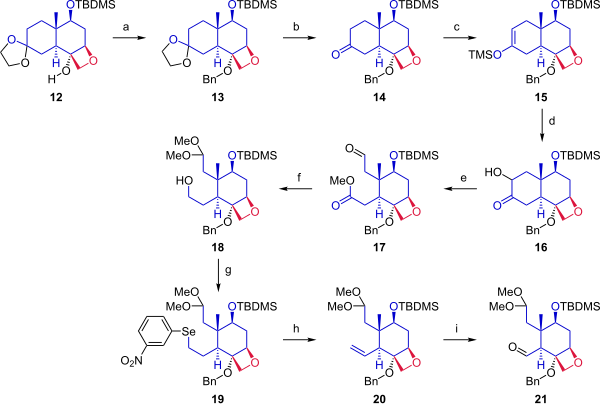
O Esquema 1 mostra a síntese do anel D oxetano a partir do anel C partindo do enantiômero (+) da cetona Wieland-Miescher ( 1 ). A redução desta dicetona com boro-hidreto de sódio forneceu cetoálcool 2 insaturado , que foi protegido como um acetato. A formação do cetal foi acompanhada por um rearranjo do alceno. O grupo acetil foi substituído por um grupo protetor terc-butildimetilsilil. A hidroboração seguida de oxidação com peróxido de hidrogênio deu álcool 5 . O grupo hidroxila foi então oxidado a um grupo carbonila dando cetona 6 por ação de dicromato de piridínio . Com todos os grupos funcionais sensíveis protegidos, o grupo metileno necessário para o anel oxetano D foi então fornecido pelo reagente Corey-Chaykovsky , que converteu o grupo carbonila em um epóxido ( 7 ). O tratamento desse epóxido com isopropóxido de alumínio gerou álcool alílico 8 . Mais dois grupos hidroxila foram adicionados por oxidação da ligação dupla recém-formada com uma quantidade catalítica de tetróxido de ósmio na presença de N-óxido de N-metilmorfolina . Esta reação carecia de estereoespecificidade e o rendimento de triol 9 com a estereoquímica correta foi, portanto, reduzido. O álcool primário foi protegido como um éter silílico e o álcool secundário foi ativado como um triflato ( 11 ). Aquecer este triflato protegido com trimetilsililo em etilenoglicol a refluxo fechou o anel para dar oxetano 12 .
| Esquema 1 |
|---|
Preparação para síntese de anel AB
Na fase seguinte ( Esquema 2 ), a partir do cetal 12 , o anel de ciclohexano foi clivado para fornecer dois pontos de ancoragem para fusão com o anel A. O álcool 12 foi protegido por um grupo benzila. O grupo de proteção acetonida foi removido da cetona. A cetona 14 foi convertida em silil enol éter 15 por reação com triflato de trimetilsilila, e uma oxidação Rubottom modificada usando 3,3-dimetildioxirano seguida por um tratamento com ácido canforsulfônico introduziu um grupo hidroxila alfa na cetona. A abertura do anel por clivagem oxidativa com tetraacetato de chumbo em metanol deu o composto 17 . Na próxima etapa, o aldeído foi protegido como um dimetil acetal e o éster foi reduzido para dar o álcool primário 18 . O grupo hidroxila foi convertido em uma eliminação de Grieco para o seleneto ( 19 ), que na oxidação com peróxido de hidrogênio deu o alceno 20 . A ozonólise com ozônio e trifenilfosfina forneceu o aldeído 21 .
| Esquema 2 |
|---|
Síntese de anel AB
Para esta síntese ( Esquema 3 ) a morfolina enamina de etil isopropil cetona foi reagida com cloreto de acriloil em uma adição de conjugado nucleofílico combinada e substituição de acil nucleofílica para dar após hidrólise a dicetona 25 . A reação com hidrazina em trietilamina e etanol proporcionou hidrazona 26 . Após uma iodação de hidrazona incomum que também envolveu a iodação alfa para um grupo carbonila e eliminação de HI, iodeto de vinila totalmente conjugado 28 foi produzido em uma desidrogenação inesperada . A cetona foi convertida em ciano - hidrina 29 com cianeto de trimetilsililo , cianeto de potássio e um éter de coroa .
| Esquema 3 |
|---|
Como se mostra na Esquema 4 , a parte inferior do anel de síntese de taxol B envolveu a reacção do anel C aldeído grupo de 21 . O grupo cetona foi desprotegido por ação do fluoreto de tetra-n-butilamônio , e a dupla ligação foi epoxidada com ácido meta-cloroperoxibenzóico para epóxido 32 . Este epóxido foi então hidrogenado com hidrogênio sobre paládio sobre carbono para dar diol 33 , que foi protegido na próxima etapa como o éster carbonato cíclico ( 34 ).
A redução do L-Selectride da enona 34 deu a cetona 35 . A cetona foi convertida em triflato de vinila 36 usando fenil triflimida e hexametildissilazida de potássio em tetra - hidrofurano a -78 ° C. Este triflato de vinil foi um dos grupos funcionais necessários para a reação de Heck . Para a geração do outro grupo reativo, o grupo acetal foi removido para dar o aldeído 37 que foi subsequentemente convertido no alceno terminal 38 em uma reação de Wittig envolvendo metilenotrifenilfosforano . A reação de Heck intramolecular envolveu tetraquis (trifenilfosfina) paládio (0) e carbonato de potássio em acetonitrila em refluxo para dar dieno 39 e para completar a formação do anel B.
| Esquema 4 |
|---|
Elaboração do anel B
A segunda parte da síntese do anel B ( Esquema 5 ) estava preocupada com a química correta para a ponte de etileno recém-formada conectando os anéis A e C. Após o Esquema 4 , esta ponte continha um grupo metileno exocíclico , mas na molécula de taxol final esta ponte é uma α-acilcetona. A conversão necessária foi realizada nas próximas 10 etapas.
O grupo protetor terc-butilsilil no dieno 39 não era compatível em reações posteriores e foi substituído por um trietilsilil . A epoxidação do dieno 40 com ácido meta-cloroperoxibenzóico deu o anel oxirano. Este serviu apenas como um grupo protetor na preparação para modificações do alceno exocíclico. Nas duas etapas seguintes, o grupo protetor de benzil no composto 41 foi substituído por um grupo acetil. O éster carbonato 43 foi aberto por reação com fenilítio para dar o álcool 44 . A clivagem da dupla ligação exocíclica foi difícil e realizada apenas com condições de forçamento (19 equivalentes de tetróxido de ósmio , 105 ° C, 24 horas) pelo éster de osmato putativo ( 45 ). A clivagem oxidativa subsequente com tetraacetato de chumbo deu a cetona 46 . O grupo protetor de epóxido foi removido com iodeto de samário (II) para dar cetona α-ß-insaturada 47 . O enolato foi formado pela reação da cetona 47 com terc-butóxido de potássio , e a reação subsequente com anidrido fenilselenínico seguida por acilação deu α-acilcetona 49 .
| Esquema 5 |
|---|
Adição de cauda
A etapa de adição da cauda nesta síntese ( Esquema 6 ) foi idêntica à da adição da cauda de Nicolaou e foi baseada na química Oijma . O anel A foi funcionalizado com um grupo hidroxila através da oxidação do clorocromato de piridínio da α-acilcetona 49 para formar a cetona 50 . A redução subsequente usando boro-hidreto de sódio produziu álcool 51 . A reação deste álcool com o Ojima lactam 52 e uma etapa final de desprotecção de silil em duas posições de trietilsilil no composto 53 deu Taxol.
| Esquema 6 |
|---|
Grupos de proteção
Ac (acetato)
Proteção: anidrido acético , 4- (dimetilamino) piridina e piridina .
Desproteção: etóxido de sódio , etanol
O grupo hidroxila no álcool 3 (Esquema 1) foi protegido como um acetato durante o rearranjo alqueno subsequente. O acetato foi removido por um grupo protector terc-butildimetilsililo (cetona 6 ).
Acetonida
Proteção: etilenoglicol , ácido naftalenossulfônico
Desproteção: ácido P-toluenossulfônico , acetona e água.
A cetona 3 (Esquema 1) foi protegida usando um grupo acetonido, que foi removido após o fechamento do anel D (cetona 14 , Esquema 2 ).
Bn (benzil)
Proteção: cloreto de benzila , piridina
Desproteção: anidrido acético , 4- (dimetilamino) piridina e piridina
O grupo hidroxila no cetal 12 ( Esquema 2 ) foi protegido como um éter benzílico, que foi substituído muito mais tarde na síntese (álcool 42 , Esquema 5 )
Éster carbonato (cíclico)
Proteção: carbonil diimidazol , hidreto de sódio , dimetilformamida
Desproteção: fenilítio
Diol 33 foi protegido como um éster de carbonato cíclico ( Esquema 4 ). O tratamento do éster carbonato com fenilítio desprotegeu um grupo hidroxila e deixou um grupo benzoila necessário para Taxol no outro oxigênio (álcool 44 , Esquema 5 ).
Dimetil Acetal
Proteção: metanol, colidina p-toluenossulfonato
Desproteção: tosilato de piridínio
O grupo carbonilo no aldeído 17 do Esquema 2 foi protegido como dimetilacetal para permitir a adição do anel A ao anel C ( Esquema 4 ). O aldeído é mais tarde desprotegido usando tosilato de piridínio mais tarde no Esquema 4 .
Epóxido
Proteção: ácido meta-cloroperoxibenzoico
Desproteção: iodeto de samário (II) , anidrido acético , tetrahidrofurano
Uma das ligações duplas do dieno 39 ( Esquema 5 ) foi protegida como um epóxido em preparação para modificações do outro alceno. O epóxido esteve presente por 4 etapas antes de ser removido com óxido de samário (II).
TBS (terc-butildimetilsilil)
Proteção: cloreto de tertbutildimetilsilil, lutidina
Desproteção: fluoreto de tetra -n-butilamônio , tetrahidrofurano
O grupo de proteção de acetato necessário para a acetilação da enona 3 ( Esquema 1 ) foi substituído pelo grupo de proteção de terc-butildimetilsilila mais robusto. Este grupo sililo foi removido muito mais tarde, a fim de ter um grupo protetor mais facilmente removido presente para as etapas finais da síntese de Taxol (composto 40 , Esquema 5 ).
TES (trietilsilil) [1]
Proteção: triflato de trietilsilila , trietilamina e diclorometano .
Desproteção: fluoreto de hidrogênio, piridina e acetonitrila
Um grupo trietilsilil substituiu um grupo protetor terc-butilsilil no final da síntese (composto 40 , Esquema 5 ). O grupo TES é posteriormente removido na etapa final de desproteção de silila que dá o composto de Taxol final.
TES (trietilsilil) [2]
Proteção: Veja: Ojima lactam
Desproteção: fluoreto de hidrogênio, piridina e acetonitrila
O grupo protector TES que estava presente na Ojima lactam é removido no passo final de desprotecção de sililo da síntese total de Taxol.
TMS (trimetilsilil)
Proteção: cianeto de trimetilsilil , cianeto de potássio e um éter de coroa
Desproteção: deslocamento de fluoreto de tetra-n-butilamônio
A cetona de dieno 28 ( Esquema 3 ) foi protegida pelo grupo trimetilsilila, e foi removida quando o grupo vinil-lítio 30 do anel A foi adicionado ao grupo aldeído do anel C em 21 ( Esquema 4 ).
Veja também
- Síntese total de paclitaxel
- Síntese total de Holton Taxol
- Síntese total de Kuwajima Taxol
- Síntese total de Mukaiyama Taxol
- Síntese total de Nicolaou Taxol
- Síntese total de Wender Taxol
links externos
Referências
- ^ Samuel J. Danishefsky; John J. Masters; Wendy B. Young; JT Link; Lawrence B. Snyder; Thomas V. Magee; David K. Jung; Richard CA Isaacs; William G. Bornmann; Cheryl A. Alaimo; Craig A. Coburn; Martin J. Di Grandi (1996). "Total Synthesis of Baccatin III and Taxol". Geléia. Chem. Soc . 118 (12): 2843–2859. doi : 10.1021 / ja952692a .
- ^ Molander, G. "Aplicação de reagentes de lantanídeos em síntese orgânica" Chem. Rev. 1992 , 92 (1), 29-68 doi : 10.1021 / cr00009a002