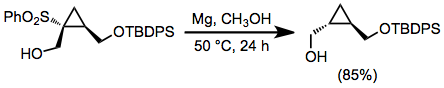Reações de dessulfonilação - Desulfonylation reactions
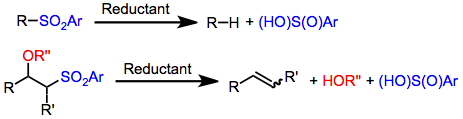
As reações de dessulfonilação são reações químicas que levam à remoção de um grupo sulfonil de compostos orgânicos . Como o grupo funcional sulfonil retira elétrons , os métodos para clivar as ligações enxofre- carbono das sulfonas são tipicamente redutivos por natureza. Olefinação ou substituição com hidrogênio pode ser realizada usando métodos de dessulfonilação redutiva.
Introdução
O grupo funcional sulfonil (RS (O) 2 R ') tornou-se um importante grupo de retirada de elétrons para a química orgânica moderna. α-sulfonil carbaniões pode ser usado como nucleófilos em reacções de alquilação, do tipo Michael adições, e outros processos. Depois de terem servido ao seu propósito sintético, os grupos sulfonil são freqüentemente removidos. Na presença de certos agentes redutores, uma das ligações enxofre-carbono do grupo sulfonil é clivada, resultando em produtos orgânicos sem enxofre. Dependendo da natureza do substrato e das condições de reação, as alquilsulfonas fornecem os alcanos ou olefinas correspondentes (a olefinação Julia ). A dessulfonilação redutiva é tipicamente realizada com metais ativos ou sais ( amálgama de sódio , amálgama de alumínio , magnésio , iodeto de samário (II) ), hidretos de estanho ( hidreto de tributilestanho ) ou complexos de metal de transição com agentes redutores ou nucleófilos (PdCl 2 (dppp) / LiHBEt 3 , Pd (PPh 3 ) 4 / LiHBEt 3 , Pd (PPh 3 ) 4 / NAHC (CO 2 Et) 2 ). As sulfonas de alquil, alquenil e alílico podem ser reduzidas usando um ou mais destes métodos.
(1)
Mecanismo e estereoquímica
Dessulfonilação redutiva
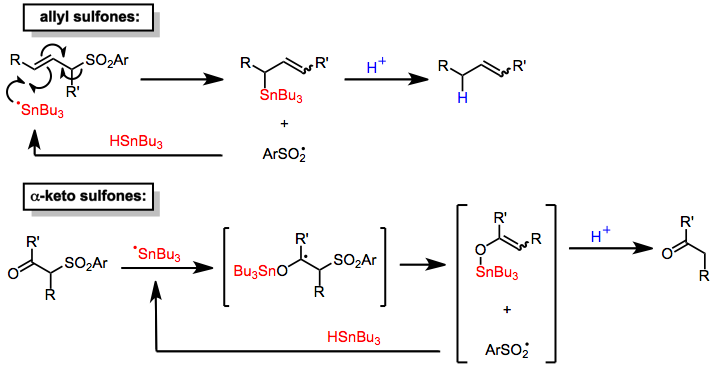
As reações de dessulfonilação redutiva levam à substituição de uma ligação carbono-enxofre no grupo sulfonil por uma ligação carbono- hidrogênio. Como o grupo sulfonil está, por definição, ligado a dois carbonos, entretanto, a redução para dois conjuntos de produtos é possível. Estudos mecanísticos de reduções empregando amálgamas de metal como agente redutor sugerem que após a transferência de elétrons para a sulfona, ocorre a fragmentação para um ânion sulfinato e o radical orgânico mais estável ocorre. A redução imediata do radical e a protonação ocorrem para se obter o produto sem enxofre derivado do radical mais estável. Assim, as ligações S-alquil são clivadas de preferência em ligações S-aril ou S-alquenil.
-
( 2 )
O iodeto de samário (II) pode ser usado para clivar redutivamente a-ceto sulfonas; na presença de hexametilfosforamida (HMPA), SmI 2 é capaz de efetuar a eliminação redutiva de sulfonas α-funcionalizadas (ver equação ( 11 ) abaixo).
-
( 3 )
Os hidretos de estanho reduzem as sulfonas α-ceto e alílicas. Os mecanismos desses processos envolvem a adição de um radical centrado em estanho ao substrato seguido pela eliminação de um radical sulfinila, que abstrai um hidrogênio de uma molécula de hidreto de estanho para propagar a cadeia radical. A protonação dos intermediários organoestânicos assim formados (pelo ácido sulfínico gerado in situ ) leva a produtos reduzidos. A adição de uma quantidade estequiométrica de fonte de prótons permite o uso de hidreto de estanho em quantidades catalíticas. Embora as dessulfonilações de sulfonas alílicas sejam seletivas para o local (fornecendo apenas produtos da transposição alílica), elas não são estereosseletivas e fornecem misturas de isômeros de ligação dupla . O mecanismo de dessulfonilação das α-ceto sulfonas é semelhante.
-
( 4 )
As dessulfonilações redutivas mediadas por metal de transição dependem da geração de um complexo π-alil intermediário, que sofre ataque nucleofílico por hidreto ou outro nucleófilo para produzir produtos reduzidos. O ataque nucleofílico geralmente ocorre na posição menos substituída da porção π-alil, embora a seletividade do local dependa fortemente do substrato e das condições de reação. Os complexos de paládio (0) são os pré-catalisadores mais comumente usados.
-
( 5 )
Eliminação redutiva
As sulfonas com um bom grupo de saída na posição β podem sofrer eliminação redutiva sob condições de dessulfonilação para produzir alcenos . Este processo é uma etapa chave da olefinação Julia , que produz alcenos por meio da adição de um α-sulfonil carbanião a um aldeído seguido por eliminação redutiva. O amálgama de sódio ou iodeto de samário (II) / HMPA pode ser usado para converter β-sulfoniloxi ou β- aciloxi sulfonas nos alcenos correspondentes. A etapa mecanística chave desse processo é a eliminação de um intermediário aniônico ou organometálico para gerar o alceno.
(6)

O uso de amálgama de sódio, que promove a formação de ânions de alquil essencialmente livres, leva a ( E ) alquenos com uma seletividade extremamente alta. O iodeto de samário (II) também produz o ( E ) alqueno predominantemente, mas com menor seletividade.
Escopo e limitações
Usando o reagente e as condições apropriadas , alquil, alquenil, alílico e α-ceto sulfonas podem ser reduzidos com bom rendimento e alta estereosseletividade (quando aplicável). As condições apropriadas para a redução dessas classes de sulfonas são discutidas abaixo.
As alquilsulfonas podem ser reduzidas com sódio ou lítio na amônia líquida ; no entanto, as condições fortemente básicas dessas reduções de metal em dissolução representam uma desvantagem significativa. Em solventes alcoólicos, podem ser usados magnésio metálico e uma quantidade catalítica de cloreto de mercúrio (II). Uma grande variedade de grupos funcionais não são afetados por essas condições, incluindo muitos que são transformados pela dissolução das reduções de metal. A dessulfonilação redutiva com esses reagentes não ocorre em reações de β-hidroxissulfonas, devido à fraca capacidade do grupo de saída do grupo hidroxila.
-
( 7 )
Um problema significativo associado à redução das sulfonas alílicas é a transposição da ligação dupla alílica, que ocorre em quantidades variáveis durante as reduções por amálgamas de metal. e hidretos de estanho As dessulfonilações redutivas catalisadas por paládio de sulfonas alílicas não têm esse problema e proporcionam sulfonas alílicas com alta localização e estereosseletividade.
-
( 8 )
O amálgama de alumínio (Al / Hg) pode ser usado para a redução quimiosseletiva de grupos carbonil α-sulfonilados. Derivados de ácido carboxílico , acetais, tioacetais , aminas, álcoois e ligações duplas isoladas são todos inertes para Al / Hg. A dessulfonilação seletiva pode ser realizada em β-hidroxissulfonas sem eliminação redutiva.
-
( 9 )
A catálise de metal de transição também é útil para a redução estereoespecífica de alquenilsulfonas. Na presença de um excesso de um reagente de Grignard, um catalisador de paládio (II) ou níquel (II) e um ligante de fósforo ou nitrogênio, as alquenilsulfonas são convertidas nos alquenos correspondentes estereoespecificamente com bom rendimento. Por outro lado, as reduções de dissolução de metal e amálgama de metal não são estereosseletivas em geral. A catálise de paládio é geralmente superior à catálise de níquel, dando maiores rendimentos e estereosseletividades.
-
( 10 )
Alquil e alquenil sulfonas com bons grupos de saída na posição β sofrem eliminação sob condições redutivas para fornecer alquenos ou alquinos. A olefinação Julia explora este processo para a síntese de alquenos a partir de alquil sulfonas e compostos de carbonila. A adição de um ânion α-sulfonil a um composto de carbonil, seguida por extinção com um cloreto de acil ou sulfonil , leva a uma β-aciloxi ou -sulfoniloxisulfona, que sofre eliminação em condições redutivas. O amálgama de sódio pode ser usado para realizar a etapa de eliminação; entretanto, a combinação de iodeto de samário (II) e HMPA é mais suave do que o amálgama de sódio fortemente básico e leva a maiores rendimentos nos processos de eliminação redutiva.
-
( 11 )
Aplicações sintéticas
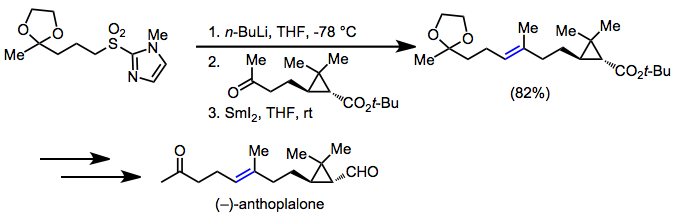
A modesta acidez dos carbonos adjacentes ao grupo sulfonil tornou as sulfonas úteis para a síntese orgânica . Após a remoção do grupo sulfonil com dessulfonilação ou eliminação redutiva, o resultado líquido é a formação de uma ligação carbono-carbono simples ou dupla ligação entre dois carbonos não funcionalizados, um motivo ubíquo em alvos sintéticos. Em uma síntese de (-) - antoplalona, a olefinação de Julia foi usada para estabelecer o ( E ) -alceno no alvo.
(12)
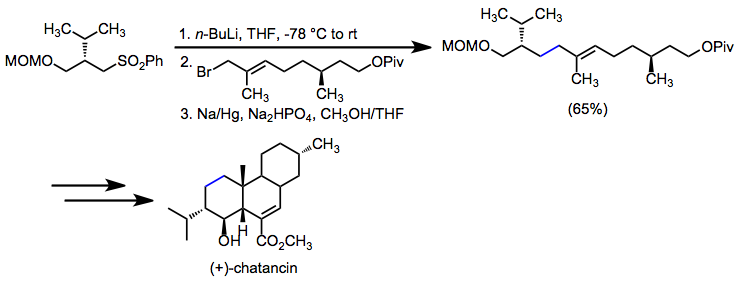
A dessulfonilação redutiva é empregada quando o objetivo é o estabelecimento de uma ligação simples carbono-carbono. Em uma síntese de (+) - chatancina, a alquilação de um α-sulfonil carbanião seguida por dessulfonilação estabeleceu uma ligação carbono-carbono alílico chave.
(13)
Comparação com outros métodos
Como os α-ciano carbanions podem ser usados em muitos dos mesmos contextos que os ânions α-sulfonil, os métodos de decianação redutiva oferecem uma alternativa viável para a dessulfonilação redutiva. As reduções de metal em dissolução são mais úteis para a decianação de nitrilas terciárias ( nitrilas primárias e secundárias fornecem as aminas correspondentes além dos produtos decianados), mas o potássio é um agente redutor mais geral que reduz as nitrilas primárias, secundárias e terciárias.
(14)

Uma ampla variedade de métodos de olefinação de carbonila que são alternativas diretas à olefinação Julia são conhecidos: a reação de Wittig , a reação de Horner-Wadsworth-Emmons , olefinação de Peterson e outros. A principal vantagem da olefinação Julia é que os precursores de sulfona às vezes estão mais prontamente disponíveis e mais fáceis de purificar do que os compostos contendo fósforo ou silício correspondentes. Além disso, existe uma variedade de métodos para sintetizar sulfonas. No entanto, a estereosseletividade às vezes limitada (e em particular, a dificuldade de acessar ( Z ) -alcenos) da reação de Julia pode ser problemática. Muitos métodos alternativos para olefinação, incluindo a reação de Peterson, não apresentam esse problema.
(15)


![{\ displaystyle {\ begin {align} {\ ce {ArSO2R -> [+ {\ ce {e ^ {-}}}] {[ArSO2R] ^ {.-}} -> {ArSO2 ^ {-}} + }} \ & {\ ce {R ^ {.}}} \\ & {\ ce {R ^ {.} -> [+ {\ ce {e ^ {-}}}] [{\ ce {H- solv}}] RH}} \\\ end {alinhado}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af990b4b965c4b6ecf4e38875554dc167745a312)