Dicobalt octacarbonil - Dicobalt octacarbonyl

|
|
|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Octacarbonyldicobalt ( Co — Co )
|
|
| Outros nomes
Carbonil de cobalto, di-mu-Carbonilhexacarbonildicobalto, octacarbonil de cobalto, dímero de tetracarbonila de cobalto, carbonil dicobalto, octacarbonildicobalto
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.030.454 |
| Número EC | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
| Número ONU | 3281 |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Co 2 (CO) 8 | |
| Massa molar | 341,95 g / mol |
| Aparência | cristais vermelho-laranja sólido cristalino branco quando puro |
| Densidade | 1,87 g / cm 3 |
| Ponto de fusão | 51 a 52 ° C (124 a 126 ° F; 324 a 325 K) |
| Ponto de ebulição | 52 ° C (126 ° F; 325 K) ca decompõe-se |
| insolúvel | |
| Pressão de vapor | 0,7 mmHg (20 ° C) |
| Estrutura | |
| 1,33 D ( isômero C2v ) 0 D ( isômero D 3d ) |
|
| Perigos | |
| Riscos principais | Muito tóxico, libera gás CO na decomposição, pirofórico, cancerígeno |
| Ficha de dados de segurança | MSDS externo |
| Pictogramas GHS |
   
|
| Palavra-sinal GHS | Perigo |
| H228 , H251 , H302 , H312 , H315 , H317 , H319 , H330 , H334 , H350 , H351 , H361 , H412 | |
| NFPA 704 (diamante de fogo) | |
| Ponto de inflamação | Pirofórico |
| NIOSH (limites de exposição à saúde dos EUA): | |
|
PEL (permitido)
|
Nenhum |
|
REL (recomendado)
|
TWA 0,1 mg / m 3 |
|
IDLH (perigo imediato)
|
WL |
| Compostos relacionados | |
|
Carbonilos de metal relacionados
|
Ferro pentacarbonil Diiron nonacarbonil Níquel tetracarbonil |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
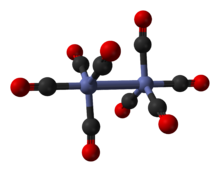
Dicobalt octacarbonil é o composto organometálico com composição Co 2 (CO) 8 . Este carbonil metálico é usado como reagente e catalisador na química organometálica e na síntese orgânica , e é fundamental para a química organocobáltica muito conhecida . É o precursor de um catalisador de hidroformilação , hidreto de tetracarbonila de cobalto . Cada molécula consiste em dois átomos de cobalto ligados a oito ligantes de monóxido de carbono , embora sejam conhecidos vários arranjos estruturais distintos. Alguns dos ligantes carbonil são altamente lábeis . O composto é altamente reativo para alcinos , e às vezes é usado como um grupo protetor de alcino . Como complexo cobalto-alcino, desempenha um papel na promoção da reação de Nicholas e da reação de Pauson-Khand .
Síntese, estrutura, propriedades
O dicobalto octacarbonil é um sólido branco quando de alta pureza, mas mais tipicamente é um sólido pirofórico de cor laranja que é termicamente instável. É sintetizado pela carbonilação de alta pressão de sais de cobalto (II) . No método patenteado por James Eli Knap, o acetato de cobalto (II) é aquecido entre 150 e 200 ° C e exposto a gases de hidrogênio e monóxido de carbono a pressões de 2.000 a 6.000 psi :
- 2 Co (CH 3 CO 2 ) 2 + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
A preparação é freqüentemente realizada na presença de cianeto , convertendo o sal de cobalto (II) em um complexo de hexacianocobaltato (II) que é então tratado com monóxido de carbono para produzir K [Co (CO) 4 ]. A acidificação produz hidreto de cobalto tetracarbonil , HCo (CO) 4 , que pode então ser aquecido para formar dicobalto octacarbonil. Também pode ser preparado aquecendo cobalto metálico acima de 250 ° C em uma corrente de monóxido de carbono gasoso a cerca de 200 a 300 atm :
- 2 Co + 8 CO → Co 2 (CO) 8
Sabe-se que existe em várias formas isoméricas , todas com a mesma composição - [Co 2 (CO) 8 ] - com dois centros de cobalto metálico em estado de oxidação zero circundados por oito ligantes carbonil (CO) . Esses ligantes podem ser a ponte entre os dois centros de cobalto ou ligados a um único centro de metal (um ligante terminal ). Em solução, existem dois isômeros conhecidos que se interconvertem rapidamente:
O isômero principal (à esquerda no processo de equilíbrio acima ) contém dois ligantes de carbonila em ponte que ligam os centros de cobalto e seis ligantes de carbonila terminais, três em cada metal. Pode ser resumido pela fórmula (CO) 3 Co (μ-CO) 2 Co (CO) 3 e tem simetria C 2v . Esta estrutura se assemelha ao diiron nonacarbonil (Fe 2 (CO) 9 ), mas com um carbonil de ponte a menos. A distância Co – Co é 2,52 Å, e as distâncias do terminal Co – CO e da ponte Co – CO são 1,80 e 1,90 Å, respectivamente. A análise da ligação sugere a ausência de uma ligação direta cobalto-cobalto.
O isômero menor não tem ligantes de carbonila em ponte, mas em vez disso tem uma ligação direta entre os centros de cobalto e oito ligantes de carbonila terminais, quatro em cada átomo de metal. Pode ser resumido pela fórmula (CO) 4 Co-Co (CO) 4 e tem simetria D 4d . Ele apresenta uma ligação cobalto-cobalto sem ponte que tem 2,70 Å de comprimento na estrutura sólida quando cristalizada junto com C 60 .
Reações
Redução
O dicobalto octacarbonil é clivado redutivamente por metais alcalinos e reagentes relacionados. O protonato de sais de metal alcalino resultante para dar hidreto de tetracarbonil cobalto :
- Co 2 (CO) 8 + 2 Na → 2 NaCo (CO) 4
- NaCo (CO) 4 + H + → HCo (CO) 4 + Na +
Reações com eletrófilos
Halogênios e reagentes relacionados clivam a ligação Co-Co para dar halotetracarbonilas pentacoordenadas:
- Co 2 (CO) 8 + Br 2 → 2 BrCo (CO) 4
O tricarbonil nitrosil de cobalto é produzido por tratamento de dicobalto octacarbonil com óxido nítrico:
- Co 2 (CO) 8 + 2 NO → 2 Co (CO) 3 NO + 2 CO
Reação de Nicholas
A reação de Nicholas é uma reação de substituição em que um grupo alcoxi localizado no carbono α de um alcino é substituído por outro nucleófilo . O alcino reage primeiro com o dicobalto octacarbonil, a partir do qual é gerado um cátion propargílico estabilizado que reage com o nucleófilo de entrada e o produto então se forma por desmetalação oxidativa .
Reação de Pauson-Khand
A reação de Pauson-Khand , na qual um alcino , um alceno e monóxido de carbono ciclizam para dar uma ciclopentenona , pode ser catalisada por Co 2 (CO) 8 , embora métodos mais novos que são mais eficientes tenham sido desenvolvidos:
O Co 2 (CO) 8 reage com os alcinos para formar um complexo covalente estável, que é útil como um grupo protetor para o alcino. Este complexo em si também pode ser usado na reação Pauson-Khand.
Reações intramoleculares de Pauson-Khand, onde o material de partida contém as metades alceno e alcino, são possíveis. Na síntese assimétrica do alcalóide Lycopodium huperzine-Q , Takayama e colaboradores usaram uma reação intramolecular de Pauson-Khand para ciclizar um enino contendo um álcool primário protegido com terc- butildifenilsilila (TBDPS) . A preparação da porção de siloxano cíclico imediatamente antes da introdução do dicobalto octacarbonil garante que o produto seja formado com a conformação desejada .

Etapa 1 : Dissociação do monóxido de carbono do hidreto de tetracarbonil de cobalto para formar HCo (CO) 3 , a espécie catalítica ativa
Etapa 2 : O centro de cobalto forma uma ligação π com o alceno
Etapa 3 : O ligante alceno se insere na ligação cobalto-hidreto
Etapa 4 : Coordenação de um ligante carbonil adicional
Etapa 5 : Inserção migratória de um ligante carbonil na ligação cobalto-alquil, convertendo o alquil tetracarbonil intermediário em uma espécie de aciltricarbonil
Etapa 6 : A adição oxidativa de di-hidrogênio leva a um complexo de di -hidrido
Etapa 7 : Produto aldeído liberado por eliminação redutiva , regenerando a espécie catalítica ativa
Etapa 8 : Uma reação lateral improdutiva e reversível
Hidroformilação
A hidrogenação de Co 2 (CO) 8 produz hidreto de cobalto tetracarbonil, [HCo (CO) 4 ]:
- Co 2 (CO) 8 + H 2 → 2 HCo (CO) 4
Este hidreto é usado como um catalisador para hidroformilação - a conversão de um alceno terminal , RCH = CH 2 , em um aldeído , RCH 2 CH 2 CHO. O ciclo catalítico para esta hidroformilação é mostrado no diagrama.
A redução de Co 2 (CO) 8 com amálgama de sódio dá a base conjugada de HCo (CO) 4 . Esse sal produz o hidreto na acidificação, fornecendo uma via sintética alternativa para essa espécie. Os sais desta forma também são intermediários na via de síntese do cianeto para o dicobalto octacarbonil.
- Co 2 (CO) 8 + 2 Na → 2 NaCo (CO) 4
- NaCo (CO) 4 + H + → HCo (CO) 4 + Na +
Os ligantes CO podem ser substituídos por ligantes fosfina terciários para dar Co 2 (CO) 8− x (PR 3 ) x . Esses derivados volumosos são catalisadores mais seletivos para reações de hidroformilação. Bases de Lewis " duras ", por exemplo , piridina , causam desproporção :
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co (C 5 H 5 N) 6 ] [Co (CO) 4 ] 2 + 8 CO

Tricobalt nonacarbonyls
O aquecimento causa descarbonilação e formação de tetracobalto dodecacarbonil :
- 2 Co 2 (CO) 8 → Co 4 (CO) 12 + 4 CO
Como muitos carbonilos de metal, o dicobalto octacarbonil abstrai halogenetos de halogenetos de alquil. Após a reação com o bromofórmio , ele se converte em metilidinetricobaltnonacarbonil , HCCo 3 (CO) 9 , por uma reação que pode ser idealizada como:
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
A análise cristalográfica de raios-X mostra que o produto contém um triângulo de átomos de cobalto a distâncias próximas de 2,48 Å, cada um ligado a três grupos carbonil terminais e com um grupo metilidino (CH) formando o ápice de uma pirâmide triangular. Este produto está estruturalmente relacionado ao tetracobalto dodecacarbonil, teoricamente pela substituição do grupo metilidino por uma quarta porção Co (CO) 3 . No entanto, tem havido desacordo entre a teoria e o experimento com a estrutura real do tetracobalto dodecacarbonil, sendo mostrado ter três grupos carbonil em ponte.
Segurança
Co 2 (CO) 8 uma fonte volátil de cobalto (0), é pirofórico e libera monóxido de carbono durante a decomposição. O Instituto Nacional de Segurança e Saúde Ocupacional tem recomendado que os trabalhadores não devem ser expostos a concentrações superiores a 0,1 mg / m 3 durante um período de oito horas de tempo médio ponderado, sem o equipamento respiratório adequado.
Referências
- ^ a b c d e f g h Guia de bolso NIOSH para perigos químicos. "# 0147" . Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH).
- ^ a b Pauson, Peter L .; Stambuli, James P .; Chou, Teh-Chang; Hong, Bor-Cherng (2014). "Octacarbonyldicobalt". Encyclopedia of Reagents for Organic Synthesis . John Wiley & Sons . doi : 10.1002 / 047084289X.ro001.pub3 .
- ^ a b c d e f g h i j Donaldson, John Dallas; Beyersmann, Detmar (2005). "Compostos de cobalto e cobalto". Enciclopédia de Química Industrial de Ullmann . Wiley-VCH. doi : 10.1002 / 14356007.a07_281.pub2 .
- ^ a b c d Elschenbroich, C .; Salzer, A. (1992). Organometallics: A Concise Introduction (2ª ed.). Weinheim: Wiley-VCH . ISBN 3-527-28165-7.
- ^ a b c d Sweany, raio L .; Brown, Theodore L. (1977). "Espectros de infravermelho do dicobalto octacarbonil isolado na matriz. Evidência para o terceiro isômero". Química Inorgânica . 16 (2): 415–421. doi : 10.1021 / ic50168a037 .
- ^ a b c Nicholas, Kenneth M. (1987). "Química e utilidade sintética de cátions propargil complexados com cobalto". Acc. Chem. Res. (Análise). 20 (6): 207–214. doi : 10.1021 / ar00138a001 .
- ^ a b c Teobald, Barry J. (2002). "A reação de Nicholas: O uso de cátions propargílicos estabilizados com hexacarbonil dicobalto na síntese". Tetraedro (revisão). 58 (21): 4133–4170. doi : 10.1016 / S0040-4020 (02) 00315-0 .
- ^ a b c Pauson, PL ; Khand, IU (1977). "Usos of Cobalt-Carbonyl Acetylene Complexes in Organic Synthesis". Ann. NY Acad. Sci. 295 (1): 2–14. doi : 10.1111 / j.1749-6632.1977.tb41819.x .
- ^ a b Blanco-Urgoiti, Jaime; Añorbe, Loreto; Pérez-Serrano, Leticia; Domínguez, Gema; Pérez-Castells, Javier (2004). "A reação Pauson-Khand, uma poderosa ferramenta sintética para a síntese de moléculas complexas". Chem. Soc. Rev. 33 (1): 32–42. doi : 10.1039 / b300976a .
- ^ Patente US 3236597 , Knap, James Eli, "High-Purity Dicobalt Octacarbonyl", emitida em 22 de fevereiro de 1966, atribuída à Union Carbide Corporation
- ^ a b Orchin, Milton (1953). "Hydrogenation of Organic Compounds with Synthesis Gas". Avanços na Catálise . 5 . Academic Press . pp. 385–415. ISBN 9780080565095.
- ^ Sumner, G. Gardner; Klug, Harold P .; Alexander, Leroy E. (1964). "A estrutura cristalina do dicobalto octacarbonil". Acta Crystallographica . 17 (6): 732–742. doi : 10.1107 / S0365110X64001803 .
- ^ Green, Jennifer C .; Green, Malcolm LH ; Parkin, Gerard (2012). "A ocorrência e representação de ligações de dois elétrons de três centros em compostos inorgânicos covalentes". Comunicações químicas . 2012 (94): 11481–11503. doi : 10.1039 / c2cc35304k .
- ^ Garcia, Thelma Y .; Fettinger, James C .; Olmstead, Marilyn M .; Balch, Alan L. (2009). "Esplêndida simetria: Cristalização de um isômero sem ponte de Co 2 (CO) 8 em Co 2 (CO) 8 · C 60 ". Comunicações químicas . 2009 (46): 7143–7145. doi : 10.1039 / b915083h .
- ^ Lockwood, Rosa F .; Nicholas, Kenneth M. (1977). "Íons de carbênio estabilizados com metais de transição como intermediários sintéticos. I. íons de α - [(alquinil) dicobalto hexacarbonil] carbênio como agentes de propargilação". Tetrahedron Lett. 18 (48): 4163–4165. doi : 10.1016 / S0040-4039 (01) 83455-9 .
- ^ Nicholas, KM; Pettit, R. (1972). "Sobre a estabilidade de íons α- (alquinil) dicobalto hexacarbonil carbonio". J. Organomet. Chem. 44 (1): C21-C24. doi : 10.1016 / 0022-328X (72) 80037-8 .
- ^ Schore, Neil E. (1991). "The Pauson-Khand Cycloaddition Reaction for Synthesis of Cyclopentenones". Org. Reagir. 40 : 1. doi : 10.1002 / 0471264180.or040.01 .
- ^ Gibson, Susan E .; Stevenazzi, Andrea (2003). "The Pauson-Khand Reaction: The Catalytic Age Is Here!". Angew. Chem. Int. Ed. 42 (16): 1800–1810. doi : 10.1002 / anie.200200547 .
- ^ Nakayama, Atsushi; Kogure, Noriyuki; Kitajima, Mariko; Takayama, Hiromitsu (2011). "Asymmetric Total Synthesis of a Pentacyclic Lycopodium Alkaloid: Huperzine-Q". Angew. Chem. Int. Ed. 50 (35): 8025–8028. doi : 10.1002 / anie.201103550 .
- ^ Ho, Tse-Lok (2016). “Dicobalt Octacarbonyl” . Reagentes de Fiesers para Síntese Orgânica . 28 . John Wiley & Sons . pp. 251–252. ISBN 9781118942819.
- ^ a b Pedaços, Richard F .; Breslow, David S. (1961). "A reação de hidrotetracarbonila de cobalto com olefinas". Journal of the American Chemical Society . 83 (19): 4023–4027. doi : 10.1021 / ja01480a017 .
- ^ a b Halpern, Jack (2001). "Química organometálica no limiar de um novo milênio. Retrospectiva e perspectiva" . Química pura e aplicada . 73 (2): 209–220. doi : 10.1351 / pac200173020209 .
- ^ a b Pfeffer, M .; Grellier, M. (2007). "Organometálicos de cobalto". Comprehensive Organometallic Chemistry III . 7 . Elsevier . pp. 1–119. doi : 10.1016 / B0-08-045047-4 / 00096-0 .
- ^ Chini, P. (1968). "Os clusters de carbonila de metal fechado". Comentários sobre Inorganica Chimica Acta . 2 : 31–51. doi : 10.1016 / 0073-8085 (68) 80013-0 .
- ^ Nestle, Mara O .; Hallgren, John E .; Seyferth, Dietmar; Dawson, Peter; Robinson, Brian H. (1980). "μ 3 -Metilidino e μ 3 -Benzilidino-Tris (Tricarbonilcobalto)". Inorg. Synth. 20 : 226–229. doi : 10.1002 / 9780470132517.ch53 .
- ^ Leung, P .; Coppens, P .; McMullan, RK; Koetzle, TF (1981). "The Structure of Nonacarbonyl-μ 3 -methylidyne- triangulo raio X--tricobalt. E Estudos de difracção de neutrões". Acta Crystallogr. B . 37 (7): 1347–1352. doi : 10.1107 / S0567740881005906 .
- ^ Corradini, Paolo (1959). "Estrutura do tetracobaltdodecarbonil". Journal of Chemical Physics . 31 (6): 1676–1677. doi : 10.1063 / 1.1730674 .
- ^ Wei, Chin Hsuan (1969). "Análises estruturais de tetracobalto dodecacarbonil e tetraródio dodecacarbonil. Tratamentos cristalográficos de uma estrutura desordenada e um composto gêmeo". Química Inorgânica . 8 (11): 2384–2397. doi : 10.1021 / ic50081a030 .
- ^ Farrugia, Louis J .; Braga, Dario; Grepioni, Fabrizia (1999). "Uma redeterminação de estrutura de Co 4 (CO) 12 : Evidência para desordem dinâmica e a via de migração de átomos de metal na fase cristalina". Journal of Organometallic Chemistry . 573 (1–2): 60–66. doi : 10.1016 / S0022-328X (98) 00879-1 .
- ^ Cole Parmer MSDS
- ^ CDC - Guia de bolso NIOSH para perigos químicos





