Doxorrubicina - Doxorubicin
 | |
 | |
| Dados clínicos | |
|---|---|
| Pronúncia | / ˌ d ɒ k s ə r u b ɪ s ɪ n / |
| Nomes comerciais | Adriamycin, Caelyx, Myocet, outros |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a682221 |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
intravenosa , intravesical |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Biodisponibilidade | 5% (por via oral) |
| Ligação proteica | 75% |
| Metabolismo | Fígado |
| Meia-vida de eliminação | Trifásico; 12 minutos, 3,3 horas, 30 horas. Média: 1-3 horas |
| Excreção | Urina (5–12%), fezes (40–50%) |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.041.344 |
| Dados químicos e físicos | |
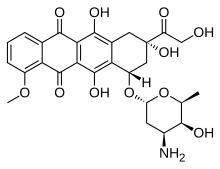
| Fórmula | C 27 H 29 N O 11 |
| Massa molar | 543,525 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
|
| |
A doxorrubicina , vendida sob a marca Adriamycin, entre outros, é um medicamento quimioterápico usado para tratar o câncer . Isso inclui câncer de mama , câncer de bexiga , sarcoma de Kaposi , linfoma e leucemia linfocítica aguda . Muitas vezes é usado junto com outros agentes quimioterápicos . A doxorrubicina é administrada por injeção numa veia .
Os efeitos colaterais comuns incluem perda de cabelo , supressão da medula óssea , vômitos , erupção na pele e inflamação da boca . Outros efeitos colaterais graves podem incluir reações alérgicas , como anafilaxia , dano ao coração , dano ao tecido no local da injeção, ressurgimento da radiação e leucemia relacionada ao tratamento . As pessoas costumam apresentar descoloração vermelha da urina por alguns dias. A doxorrubicina faz parte da família de medicamentos antraciclinas e antibióticos antitumorais . Ele age em parte interferindo na função do DNA .
A doxorrubicina foi aprovada para uso médico nos Estados Unidos em 1974. Está na Lista de Medicamentos Essenciais da Organização Mundial de Saúde . Versões que são peguiladas e em lipossomas também estão disponíveis; no entanto, eles são mais caros. A doxorrubicina foi originalmente produzida a partir da bactéria Streptomyces peucetius .
Usos médicos
A doxorrubicina é comumente usada para tratar algumas leucemias e linfoma de Hodgkin , bem como cânceres de bexiga , mama , estômago , pulmão , ovários , tireóide , sarcoma de tecidos moles , mieloma múltiplo e outros. Vulgarmente utilizado doxorubicina contendo regimes são AC (adriamicina, ciclofosfamida ), TAC ( o taxotere , CA), ABVD (adriamicina, bleomicina , vinblastina , dacarbazina ), BEACOPP , CHOP (ciclofosfamida, hidroxidaunorubicina, vincristina , prednisona ) e FAC ( 5-fluorouracilo , adriamicina, ciclofosfamida).
O DOXIL (veja abaixo) é usado principalmente para o tratamento de câncer de ovário em que a doença progrediu ou recorreu após quimioterapia à base de platina ou para o tratamento do sarcoma de Kaposi relacionado à AIDS .
Efeitos colaterais
Cardiotoxicidade
O efeito colateral mais perigoso da doxorrubicina é a cardiomiopatia dilatada , levando à insuficiência cardíaca congestiva . A taxa de cardiomiopatia é dependente de sua dose cumulativa, com uma incidência de cerca de 4% quando a dose de doxorrubicina é 500–550 mg / m 2 , 18% quando a dose é 551–600 mg / m 2 e 36% quando a dose excede 600 mg / m 2 . Existem várias maneiras pelas quais se acredita que a doxorrubicina causa cardiomiopatia, incluindo estresse oxidativo , regulação negativa de genes para proteínas contráteis e apoptose mediada por p53 .
A cardiomiopatia induzida por doxorrubicina geralmente resulta em cardiomiopatia dilatada, com todas as quatro câmaras cardíacas sendo aumentadas. Isso resulta em disfunção sistólica e diastólica. Eventualmente, pode ocorrer insuficiência cardíaca, o que acarreta uma taxa de mortalidade de 50%. Não há tratamento eficaz contra a cardiomiopatia estabelecida causada pelo medicamento a partir de 2010. O medicamento dexrazoxano pode ser usado para diminuir o risco de cardiotoxicidade da doxorrubicina em certos casos.
Outro
Outra complicação comum e potencialmente fatal da doxorrubicina é a tiflite , uma inflamação intestinal aguda com risco de vida. Além disso, algumas pessoas podem desenvolver EPP , caracterizado por erupções cutâneas nas palmas das mãos ou na planta dos pés, inchaço, dor e eritema . Devido a esses efeitos colaterais e sua cor vermelha, a doxorrubicina ganhou o apelido de "diabo vermelho" ou "morte vermelha".
A quimioterapia pode causar reativação da hepatite B , e os regimes contendo doxorrubicina não são exceção.
A doxorrubicina e vários medicamentos quimioterápicos (incluindo ciclofosfamida) podem causar perda de pigmentação da pele .
Formulações lipossomais
Existe uma forma encapsulada em lipossoma peguilada (revestida com polietilenoglicol) da doxorrubicina, desenvolvida para tratar o sarcoma de Kaposi. O revestimento de polietilenoglicol resulta na concentração preferencial de doxorrubicina na pele. No entanto, isso também resulta em um efeito colateral denominado eritrodisestesia palmo-plantar (EPP), mais comumente conhecido como síndrome mão-pé.
Após a administração desta forma de doxorrubicina, pequenas quantidades do medicamento podem vazar dos capilares nas palmas das mãos e nas solas dos pés. O resultado desse vazamento é vermelhidão, sensibilidade e descamação da pele que pode ser desconfortável e até dolorosa. Em testes clínicos com uma dosagem de 50 mg / m 2 a cada 4 semanas, metade das pessoas desenvolveu a síndrome mão-pé. A taxa deste efeito colateral limita a dose desta formulação que pode ser dada em comparação com a doxorrubicina simples no mesmo regime de tratamento, limitando assim a substituição potencial. A substituição seria desejável porque a doxorrubicina encapsulada em lipossoma é menos cardiotóxica do que a doxorrubicina não encapsulada. Esta forma encapsulada em lipossoma também é aprovada pelo FDA para o tratamento de câncer de ovário e mieloma múltiplo.
Uma doxorrubicina lipossomal não peguilada, chamada Myocet, é aprovada na União Europeia e no Canadá para o tratamento de câncer de mama metastático em combinação com ciclofosfamida , mas não foi aprovada pelo FDA para uso nos Estados Unidos. Ao contrário do Doxil, o lipossoma Myocet não tem um revestimento de polietilenoglicol e, portanto, não resulta na mesma taxa de PPE. A minimização deste efeito colateral pode permitir a substituição um por um (1: 1) com doxorrubicina no mesmo regime de tratamento, melhorando assim a segurança sem perda de eficácia. Como o Doxil, a encapsulação lipossomal da doxorrubicina limita a cardiotoxicidade. Em teoria, ao limitar a cardiotoxicidade da doxorrubicina por meio do encapsulamento lipossomal, ela pode ser usada com segurança em combinação concomitante com outros medicamentos de quimioterapia cardiotóxica, como o trastuzumabe . Há uma caixa preta de advertência do FDA de que o trastuzumabe não pode ser usado em combinação simultânea com a doxorrubicina, apenas em combinação sequencial. Embora a combinação simultânea de trastuzumabe e doxorrubicina em estudos clínicos tenha encontrado uma resposta tumoral superior, a combinação resultou em cardiotoxicidade inaceitável, incluindo risco de insuficiência cardíaca manifestando-se como insuficiência cardíaca congestiva (ICC). Os resultados do estudo de fase II publicados mostraram que Myocet, trastuzumab e paclitaxel podem ser usados concomitantemente com segurança sem o risco cardíaco, conforme medido pela redução na função da FEVE , enquanto ainda alcançam uma resposta tumoral superior. Essa descoberta é a base para o estudo de fase III em andamento para aprovação do FDA.
Biossíntese
A doxorrubicina (DXR) é uma versão 14- hidroxilada da daunorrubicina , o precursor imediato da DXR em sua via biossintética .
A daunorrubicina é encontrada mais abundantemente como um produto natural porque é produzida por várias cepas de tipo selvagem diferentes de Streptomyces . Em contraste, apenas uma espécie conhecida de tipo não selvagem , Streptomyces peucetius subespécie cesius ATCC 27952, foi inicialmente encontrada para ser capaz de produzir a doxorrubicina mais amplamente usada. Esta cepa foi criada por Arcamone et al. em 1969, por mutação de uma cepa produtora de daunorrubicina, mas não de DXR, pelo menos em quantidades detectáveis. Posteriormente, o grupo de Hutchinson mostrou que sob condições ambientais especiais, ou pela introdução de modificações genéticas , outras cepas de Streptomyces podem produzir doxorrubicina. Seu grupo também clonou muitos dos genes necessários para a produção de DXR, embora nem todos tenham sido totalmente caracterizados. Em 1996, o grupo de Strohl descobriu, isolou e caracterizou o dox A, o gene que codifica a enzima que converte daunorrubicina em DXR.
Em 1999, eles produziram dox A recombinante, uma oxidase do citocromo P450 , e descobriram que ela catalisa várias etapas na biossíntese de DXR , incluindo etapas que levam à daunorrubicina. Isso foi significativo porque ficou claro que todas as cepas produtoras de daunorrubicina têm os genes necessários para produzir DXR, o muito mais terapeuticamente importante dos dois. O grupo de Hutchinson passou a desenvolver métodos para melhorar o rendimento de DXR, a partir do processo de fermentação usado em sua produção comercial, não apenas pela introdução de plasmídeos que codificam dox A , mas também pela introdução de mutações para desativar enzimas que desviam precursores DXR para produtos menos úteis, por exemplo baumycin-como glicósidos . Alguns mutantes triplos, que também sobre-expressas dox A, foram capazes de duplicar o rendimento de DXR. Isso é mais do que interesse acadêmico, porque naquela época o DXR custava cerca de US $ 1,37 milhão por kg e a produção atual em 1999 era de 225 kg por ano.
Técnicas de produção mais eficientes reduziram o preço para US $ 1,1 milhão por kg para a formulação não lipossomal . Embora DXR possa ser produzido semissinteticamente a partir da daunorrubicina, o processo envolve bromação eletrofílica e várias etapas, e o rendimento é baixo. Uma vez que a daunorrubicina é produzida por fermentação , seria ideal se a bactéria pudesse completar a síntese DXR de forma mais eficaz.
Mecanismo de ação
A doxorrubicina interage com o DNA por intercalação e inibição da biossíntese macromolecular . Isso inibe a progressão da topoisomerase II , uma enzima que relaxa supercoils no DNA para a transcrição . A doxorrubicina estabiliza o complexo topoisomerase II após quebrar a cadeia de DNA para replicação, evitando que a dupla hélice do DNA seja liberada e, assim, interrompendo o processo de replicação . Também pode aumentar a produção de radicais livres do tipo quinona, contribuindo assim para sua citotoxicidade.
A porção do cromóforo aromático planar da molécula intercala entre dois pares de bases do DNA, enquanto o açúcar daunosamina de seis membros fica no sulco menor e interage com os pares de bases flanqueadores imediatamente adjacentes ao local de intercalação, como evidenciado por várias estruturas cristalinas.
Por intercalação , a doxorrubicina também pode induzir a expulsão de histonas da cromatina transcricionalmente ativa . Como resultado, a resposta ao dano ao DNA , o epigenoma e o transcriptoma são desregulados nas células expostas à doxorrubicina.
História
Na década de 1950, uma empresa italiana de pesquisa, Farmitalia Research Laboratories, iniciou um esforço organizado para encontrar compostos anticâncer de micróbios do solo. Uma amostra de solo foi isolada da área ao redor do Castel del Monte , um castelo do século 13. Uma nova cepa de Streptomyces peucetius , que produzia um pigmento vermelho, foi isolada e um antibiótico dessa bactéria foi eficaz contra tumores em camundongos. Como um grupo de pesquisadores franceses descobriu o mesmo composto mais ou menos na mesma época, as duas equipes batizaram o composto de daunorrubicina , combinando o nome Dauni , uma tribo pré-romana que ocupava a região da Itália onde o complexo estava isolado, com a palavra francesa para rubi , rubis , descrevendo a cor. Os testes clínicos começaram na década de 1960, e a droga foi bem-sucedida no tratamento de leucemia aguda e linfoma. No entanto, em 1967, foi reconhecido que a daunorrubicina poderia levar à toxicidade cardíaca fatal.
Os pesquisadores da Farmitalia logo descobriram que mudanças na atividade biológica poderiam ser feitas por pequenas mudanças na estrutura do composto. Uma cepa de Streptomyces foi mutada usando N- nitroso- N- metil uretano, e essa nova cepa produziu um antibiótico diferente de cor vermelha. Eles chamaram esse novo composto de Adriamicina, em homenagem ao Mar Adriático , e o nome foi mais tarde mudado para doxorrubicina para estar de acordo com a convenção de nomenclatura estabelecida. A doxorrubicina mostrou melhor atividade do que a daunorrubicina contra tumores de camundongo, especialmente tumores sólidos. Também apresentou índice terapêutico mais elevado , porém a cardiotoxicidade permaneceu.
A doxorrubicina e a daunorrubicina juntas podem ser consideradas compostos protótipos para as antraciclinas . Pesquisas subsequentes levaram a muitos outros antibióticos antraciclínicos, ou análogos, e agora existem mais de 2.000 análogos conhecidos da doxorrubicina. Em 1991, 553 deles foram avaliados no programa de rastreamento do National Cancer Institute (NCI). Em 2016, o GPX-150 recebeu a designação de medicamento órfão pelo FDA dos EUA.
Sociedade e cultura
Nomes
É também conhecido como hidroxidaunorrubicina e hidroxidaunomicina.
É vendido sob várias marcas diferentes, incluindo Adriamycin PFS, Adriamycin RDF ou Rubex.
Formulações
A doxorrubicina é fotossensível e os recipientes geralmente são cobertos por um saco de alumínio e / ou papel de cera marrom para evitar que a luz os atinja. A doxorrubicina também está disponível em formas encapsuladas em lipossomas como Doxil ( forma peguilada ), Myocet (forma não peguilada) e Caelyx, que também são administrados por injeção intravenosa.
Falta
Entre 2011 e março de 2014, o Doxil estava em oferta limitada. Em 2011, o DOXIL tornou-se disponível apenas em fornecimento muito limitado devido a problemas de produção com o fabricante terceirizado. A Johnson & Johnson (JNJ), por meio de sua subsidiária Janssen Products, LP, estava recebendo seu suprimento de DOXIL do fabricante Ben Venue Laboratories (localizado em Bedford, Ohio), uma unidade da Boehringer Ingelheim GmbH da Alemanha. Os problemas começaram quando Ben Venue fechou temporariamente sua fábrica devido a problemas de controle de qualidade.
Em fevereiro de 2012, para resolver a falta de Doxil, a Food and Drug Administration (FDA) dos EUA permitiu a importação temporária de Lipodox, que contém o mesmo ingrediente ativo do Doxil e é feito pela Sun Pharma Global FZE (Sun), uma subsidiária da Sun Pharmaceutical Industries Ltd. da Índia. A agência disse que pretende continuar permitindo a importação de Lipodox até que a Sun tenha feito o Doxil genérico suficiente para atender à demanda.
O FDA aprovou a primeira versão genérica do Doxil, feita pela Sun, em fevereiro de 2013. Ele estará disponível em frascos de 20 e 50 miligramas.
Pesquisar
Experimentos de terapia combinada com sirolimus (rapamicina) e doxorrubicina têm se mostrado promissores no tratamento de linfomas Akt- positivos em camundongos.
Em 2006, a pesquisa animal acoplando um anticorpo monoclonal murino com a doxorrubicina criou um imunoconjugado que foi capaz de eliminar a infecção pelo HIV-1 em camundongos. O tratamento com terapia anti-retroviral (ART) deixa bolsas de HIV dentro do hospedeiro. O imunoconjugado pode potencialmente fornecer um tratamento adjuvante ao ART para erradicar as células T que expressam o antígeno .
Atividade antimalárica
Existem algumas evidências de atividade antimalárica para a doxorrubicina e compostos semelhantes. Em 2009, descobriu-se que um composto de estrutura semelhante à doxorrubicina inibia a plasmepsina II, uma enzima exclusiva do parasita da malária Plasmodium falciparum . A empresa farmacêutica GlaxoSmithKline (GSK) posteriormente identificou a doxorrubicina em um conjunto de compostos que inibem o crescimento do parasita
Fluorescência
A doxorrubicina também é conhecida por ser fluorescente. Isso tem sido freqüentemente usado para caracterizar as concentrações de doxorrubicina e abriu a possibilidade de usar a molécula como um agente teranóstico . No entanto, existem limitações significativas, uma vez que o espectro de fluorescência da doxorrubicina é conhecido por depender de uma variedade de fatores, incluindo o pH do ambiente, constante dielétrica do solvente e outros. A fluorescência da doxorrubicina é extinta pela ligação ao DNA e protegida pelo encapsulamento micelar. Também é conhecido por se auto-extinguir em altas concentrações. Em contraste, a ligação da histona amplifica a fluorescência.
Veja também
Referências
links externos
-
 Mídia relacionada à doxorrubicina no Wikimedia Commons
Mídia relacionada à doxorrubicina no Wikimedia Commons - "Doxorrubicina" . Portal de informações sobre medicamentos . Biblioteca Nacional de Medicina dos EUA.

