Eletrocatalisador - Electrocatalyst
Um eletrocatalisador é um catalisador que participa de reações eletroquímicas . Eletrocatalisadores são uma forma específica de catalisadores que funcionam nas superfícies do eletrodo ou, mais comumente, podem ser a própria superfície do eletrodo. Um eletrocatalisador pode ser heterogêneo , como um eletrodo platinizado. Eletrocatalisadores homogêneos, que são solúveis, auxiliam na transferência de elétrons entre o eletrodo e os reagentes e / ou facilitam uma transformação química intermediária descrita por uma meia reação geral . Os principais desafios dos eletrocatalisadores se concentram nas células de combustível.
Eletrocatalisadores Práticos
Processo de cloroalcalino
O processo de cloralcal é uma aplicação em larga escala que usa eletrocatalisadores. Essa tecnologia fornece a maior parte do cloro e hidróxido de sódio necessários para muitas indústrias. O cátodo é um ânodo de titânio revestido de óxido de metal misto (também chamado de ânodo dimensionalmente estável).

Eletrofluoração
Muitos compostos organofluorados são produzidos por eletrofluoração . Uma manifestação dessa tecnologia é o processo Simons , que pode ser descrito como:
- R 3 C – H + HF → R 3 C – F + H 2
No decorrer de uma síntese típica, essa reação ocorre uma vez para cada ligação C – H no precursor. O potencial da célula é mantida perto de 5-6 V . O ânodo , o eletrocatalisador, é banhado a níquel .
Hidrodimerização de acrilonitrila
O acrilonitrila é convertido em adiponitrila em escala industrial por meio de eletrocatálise.
Antecedentes e Teoria
Em geral, um catalisador é um agente que aumenta a velocidade de uma reação química sem ser consumido por uma reação. Termodinamicamente, um catalisador reduz a energia de ativação necessária para que uma reação química ocorra. Um eletrocatalisador é um catalisador que afeta a energia de ativação de uma reação eletroquímica. Abaixo é mostrada a energia de ativação das reações químicas no que se refere às energias dos produtos e reagentes. A energia de ativação em processos eletroquímicos está relacionada ao potencial , ou seja, à tensão, na qual ocorre uma reação. Assim, os eletrocatalisadores freqüentemente alteram o potencial em que os processos de oxidação e redução são observados. Alternativamente, um eletrocatalisador pode ser considerado como um agente que facilita uma interação química específica na superfície de um eletrodo. Dado que as reações eletroquímicas ocorrem quando os elétrons são passados de uma espécie química para outra, as interações favoráveis na superfície do eletrodo aumentam a probabilidade de ocorrerem transformações eletroquímicas, reduzindo assim o potencial necessário para atingir essas transformações.

Os eletrocatalisadores podem ser avaliados de acordo com três figuras de mérito: atividade, estabilidade e seletividade. A atividade dos eletrocatalisadores pode ser avaliada quantitativamente pela compreensão de quanta densidade de corrente é gerada e, portanto, com que rapidez uma reação está ocorrendo, para um determinado potencial aplicado. Essa relação é descrita com a equação de Tafel . Ao avaliar a estabilidade dos eletrocatalisadores, a capacidade dos catalisadores de resistir aos potenciais nos quais as transformações estão ocorrendo é crucial. A seletividade dos eletrocatalisadores se refere à sua interação preferencial com determinados substratos e à geração de um único produto. A seletividade pode ser avaliada quantitativamente por meio de um coeficiente de seletividade, que compara a resposta do material ao analito ou substrato desejado com a resposta a outros interferentes.
Em muitos sistemas eletroquímicos, incluindo células galvânicas , células de combustível e várias formas de células eletrolíticas , uma desvantagem é que elas podem sofrer barreiras de alta ativação. A energia desviada para superar essas barreiras de ativação é transformada em calor. Na maioria das reações de combustão exotérmica, esse calor simplesmente propagaria a reação cataliticamente. Em uma reação redox, esse calor é um subproduto inútil perdido para o sistema. A energia extra necessária para superar as barreiras cinéticas é geralmente descrita em termos de baixa eficiência faradaica e altos overpotenciais . Nestes sistemas, cada um dos dois eletrodos e sua meia-célula associada exigiria seu próprio eletrocatalisador especializado.
Semirreações envolvendo várias etapas , múltiplas transferências de elétrons e a evolução ou consumo de gases em suas transformações químicas gerais, muitas vezes têm barreiras cinéticas consideráveis. Além disso, muitas vezes há mais de uma reação possível na superfície de um eletrodo. Por exemplo, durante a eletrólise da água , o ânodo pode oxidar a água por meio de um processo de dois elétrons em peróxido de hidrogênio ou de um processo de quatro elétrons em oxigênio. A presença de um eletrocatalisador pode facilitar qualquer uma das vias de reação.
Eletrocatalisadores homogêneos
Um eletrocatalisador homogêneo é aquele que está presente na mesma fase da matéria que os reagentes, por exemplo, um complexo de coordenação solúvel em água que catalisa uma conversão eletroquímica em solução. Esta tecnologia não é praticada comercialmente, mas é de interesse de pesquisa.
Complexos de coordenação sintética
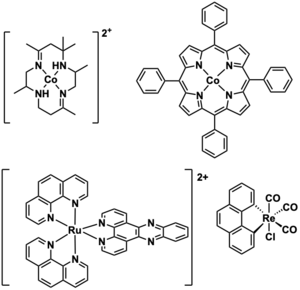
Muitos complexos catalisam reações eletroquímicas. Por exemplo, porfirinas de cobalto e polipiridinas de cobalto mostram rendimentos Faradaicos altos (> 80%) para a reação de evolução de hidrogênio.
Enzimas
Algumas enzimas podem funcionar como eletrocatalisadores. A nitrogenase , uma enzima que contém um cluster MoFe, pode ser aproveitada para fixar o nitrogênio atmosférico , ou seja, converter o gás nitrogênio em moléculas como a amônia. Imobilizar a proteína na superfície de um eletrodo e empregar um mediador de elétrons melhora muito a eficiência desse processo. A eficácia dos bioeletrocatalisadores geralmente depende da facilidade de transporte de elétrons entre o sítio ativo da enzima e a superfície do eletrodo. Outras enzimas fornecem informações para o desenvolvimento de catalisadores sintéticos. Por exemplo, a formato desidrogenase , uma enzima que contém níquel, inspirou o desenvolvimento de complexos sintéticos com estruturas moleculares semelhantes para uso na redução de CO 2 . As células a combustível microbianas são outra maneira de os sistemas biológicos serem aproveitados para aplicações eletrocatalíticas. Os sistemas baseados em micróbios aproveitam as vias metabólicas de um organismo inteiro, em vez da atividade de uma enzima específica, o que significa que eles podem catalisar uma ampla gama de reações químicas. As células a combustível microbianas podem derivar corrente da oxidação de substratos como a glicose e ser alavancadas para processos como a redução de CO 2 .
Eletrocatalisadores heterogêneos
Um eletrocatalisador heterogêneo é aquele que está presente em uma fase diferente da matéria dos reagentes, por exemplo, uma superfície sólida que catalisa uma reação em solução. Diferentes tipos de materiais eletrocatalisadores heterogêneos são mostrados acima em verde. Uma vez que as reações eletrocatalíticas heterogêneas precisam de uma transferência de elétrons entre o catalisador sólido (normalmente um metal) e o eletrólito, que pode ser uma solução líquida, mas também um polímero ou uma cerâmica capaz de condução iônica, a cinética da reação depende tanto do catalisador quanto do eletrólito bem como na interface entre eles. A natureza da superfície do eletrocatalisador determina algumas propriedades da reação, incluindo taxa e seletividade.
Materiais de massa
A eletrocatálise pode ocorrer na superfície de alguns materiais a granel, como o metal de platina. Superfícies de metal a granel de ouro têm sido empregadas para a decomposição do metanol para a produção de hidrogênio. A eletrólise da água é convencionalmente conduzida em eletrodos de metal inertes, como platina ou irídio. A atividade de um eletrocatalisador pode ser ajustada com uma modificação química, comumente obtida ligando dois ou mais metais. Isso se deve a uma mudança na estrutura eletrônica, principalmente na banda d, considerada responsável pelas propriedades catalíticas dos metais nobres.
Nanomateriais
Nanopartículas
Foi demonstrado que uma variedade de materiais de nanopartículas promovem várias reações eletroquímicas, embora nenhuma tenha sido comercializada. Esses catalisadores podem ser ajustados em relação ao seu tamanho e forma, bem como à deformação da superfície.

Além disso, taxas de reação mais altas podem ser alcançadas pelo controle preciso do arranjo dos átomos de superfície: de fato, em sistemas nanométricos, o número de locais de reação disponíveis é um parâmetro melhor do que a área de superfície exposta para estimar a atividade eletrocatalítica. Os sites são as posições onde a reação pode ocorrer; a probabilidade de ocorrer uma reação em um determinado local depende da estrutura eletrônica do catalisador, que determina a energia de adsorção dos reagentes juntamente com muitas outras variáveis ainda não totalmente esclarecidas.
De acordo com o modelo TSK , os átomos da superfície do catalisador podem ser classificados como átomos de terraço, degrau ou torção de acordo com sua posição, cada um caracterizado por um número de coordenação diferente . Em princípio, os átomos com menor número de coordenação (torções e defeitos) tendem a ser mais reativos e, portanto, adsorver os reagentes mais facilmente: isso pode promover a cinética, mas também pode deprimi-la se a espécie adsorvente não for o reagente, inativando assim o catalisador. Os avanços na nanotecnologia tornam possível a engenharia de superfície do catalisador de modo que apenas alguns planos de cristal desejados sejam expostos aos reagentes, maximizando o número de locais de reação eficazes para a reação desejada.
Até o momento, um mecanismo de dependência de superfície generalizado não pode ser formulado, uma vez que cada efeito de superfície é fortemente específico para a reação. Algumas classificações de reações com base em sua dependência superficial foram propostas, mas ainda há muitas exceções que não se enquadram nelas.
Efeito de tamanho de partícula

O interesse em reduzir ao máximo os custos do catalisador para processos eletroquímicos levou ao uso de catalisadores em pó finos, uma vez que a área superficial específica aumenta à medida que o tamanho médio das partículas diminui. Por exemplo, o design mais comum de células de combustível PEM e eletrolisadores é baseado em uma membrana polimérica carregada em nanopartículas de platina como um eletrocatalisador (o chamado preto de platina ).
Embora a razão entre a área de superfície e o volume seja comumente considerada o principal parâmetro relacionado ao tamanho do eletrocatalisador com sua atividade, para entender o efeito do tamanho da partícula, vários outros fenômenos precisam ser levados em consideração:
- Forma de equilíbrio : para qualquer tamanho de uma nanopartícula, há uma forma de equilíbrio que determina exatamente seus planos de cristal
- Número relativo de locais de reação : um determinado tamanho para uma nanopartícula corresponde a um certo número de átomos de superfície e apenas alguns deles hospedam um local de reação
- Estrutura eletrônica : abaixo de um determinado tamanho, a função de trabalho de uma nanopartícula muda e sua estrutura de banda desaparece
- Defeitos : a estrutura cristalina de uma pequena nanopartícula é perfeita; assim, as reações aumentadas por defeitos à medida que os locais de reação ficam mais lentos à medida que o tamanho da partícula diminui
- Estabilidade : pequenas nanopartículas têm tendência a perder massa devido à difusão de seus átomos em partículas maiores, de acordo com o fenômeno de amadurecimento de Ostwald.
- Agente de cobertura: para estabilizar as nanopartículas é necessária uma camada de cobertura, pois parte de sua superfície fica indisponível para os reagentes
- Suporte : as nanopartículas são frequentemente fixadas em um suporte para permanecer no lugar, portanto, parte de sua superfície não está disponível para reagentes
Materiais à Base de Carbono
Nanotubos de carbono e materiais à base de grafeno podem ser usados como eletrocatalisadores. As superfícies de carbono do grafeno e dos nanotubos de carbono são bem adequadas para a adsorção de muitas espécies químicas, que podem promover certas reações eletrocatalíticas. Além disso, sua condutividade significa que são bons materiais para eletrodos. Os nanotubos de carbono têm uma área de superfície muito alta, maximizando os locais de superfície onde as transformações eletroquímicas podem ocorrer. O grafeno também pode servir como uma plataforma para a construção de compostos com outros tipos de nanomateriais, como catalisadores de átomo único. Devido à sua condutividade, os materiais à base de carbono podem potencialmente substituir os eletrodos de metal para realizar a eletrocatálise sem metal.
Materiais de Estrutura
Metal — estruturas orgânicas (MOFs) , especialmente estruturas condutoras, podem ser usadas como eletrocatalisadores para processos como redução de CO 2 e divisão de água . MOFs fornecem locais ativos potenciais em centros de metal e locais de ligantes orgânicos. Eles também podem ser funcionalizados ou encapsular outros materiais, como nanopartículas. MOFs também podem ser combinados com materiais à base de carbono para formar eletrocatalisadores. Estruturas orgânicas covalentes (COFs) , particularmente aquelas que contêm metais, também podem servir como eletrocatalisadores. COFs construídos a partir de porfirinas de cobalto demonstraram a capacidade de reduzir o dióxido de carbono a monóxido de carbono.
No entanto, muitos MOFs são conhecidos como instáveis em condições químicas e eletroquímicas, tornando difícil dizer se os MOFs são realmente catalisadores ou pré-catalisadores. Os locais ativos reais de MOFs durante a eletrocatálise precisam ser analisados de forma abrangente.
Pesquisa em eletrocatálise
Divisão de Água / Evolução de Hidrogênio
O hidrogênio e o oxigênio podem ser combinados pelo uso de uma célula de combustível. Neste processo, a reação é quebrada em duas meias reações que ocorrem em eletrodos separados. Nesta situação, a energia do reagente é convertida diretamente em eletricidade. A energia útil pode ser obtida a partir do calor térmico desta reação através de um motor de combustão interna com uma eficiência superior de 60% (para taxa de compressão de 10 e taxa de calor específico de 1,4) com base no ciclo termodinâmico de Otto . Também é possível combinar o hidrogênio e o oxigênio através do mecanismo redox, como no caso de uma célula a combustível . Neste processo, a reação é quebrada em duas semi-reações que ocorrem em eletrodos separados. Nesta situação, a energia do reagente é convertida diretamente em eletricidade.
O potencial de redução padrão do hidrogênio é definido como 0 V e frequentemente referido como o eletrodo padrão de hidrogênio (SHE).
| Meia Reação | Potencial de redução
E o vermelho (V) |
|---|---|
| 2H + + 2e - → H2 (g) | ≡ 0 |
| O 2 (g) + 4H + + 4e - → 2H 2 O (l) | +1,23 |
HER pode ser promovido por muitos catalisadores.
Redução de dióxido de carbono
A eletrocatálise para redução de CO 2 não é praticada comercialmente, mas continua sendo um tópico de pesquisa. A redução de CO 2 em produtos utilizáveis é uma forma potencial de combater as mudanças climáticas . Os eletrocatalisadores podem promover a redução do dióxido de carbono em metanol e outros combustíveis úteis e produtos químicos. Os produtos de redução de CO 2 mais valiosos são aqueles com maior teor de energia, o que significa que podem ser reutilizados como combustíveis. Assim, o desenvolvimento do catalisador se concentra na produção de produtos como metano e metanol. Catalisadores homogêneos, como enzimas e complexos de coordenação sintéticos, têm sido empregados para esse fim. Uma variedade de nanomateriais também foi estudada para redução de CO 2 , incluindo materiais à base de carbono e materiais de estrutura.
Células de combustível movidas a etanol
As soluções aquosas de metanol pode decompor-se em CO 2 de gás hidrogénio, e água. Embora esse processo seja termodinamicamente favorecido, a barreira de ativação é extremamente alta, portanto, na prática, essa reação não é tipicamente observada. No entanto, os eletrocatalisadores podem acelerar muito essa reação, tornando o metanol uma rota possível para o armazenamento de hidrogênio para células de combustível. Eletrocatalisadores, como ouro, platina e vários materiais à base de carbono, mostraram catalisar eficazmente esse processo. Um eletrocatalisador de platina e ródio em nanopartículas de dióxido de estanho com suporte de carbono pode quebrar ligações de carbono à temperatura ambiente com apenas dióxido de carbono como subproduto, de modo que o etanol pode ser oxidado nos íons de hidrogênio e elétrons necessários para criar eletricidade.
Síntese química
Eletrocatalisadores são usados para promover certas reações químicas para obter produtos sintéticos. O grafeno e os óxidos de grafeno têm se mostrado promissores como materiais eletrocatalíticos para síntese. Os métodos eletrocatalíticos também têm potencial para a síntese de polímeros. As reações de síntese eletrocatalítica podem ser realizadas em condições de corrente constante, potencial constante ou voltagem de célula constante, dependendo da escala e do propósito da reação.
Leitura adicional
- Valenti, G .; Boni, A .; Melchionna, M .; Cargnello, M .; Nasi, L .; Bertoli, G .; Gorte, RJ; Marcaccio, M .; Rapino, S .; Bonchio, M .; Fornasiero, P .; Prato, M .; Paolucci, F. (2016). "Heteroestruturas coaxiais integrando paládio / dióxido de titânio com nanotubos de carbono para evolução eficiente do hidrogênio eletrocatalítico" . Nature Communications . 7 : 13549. bibcode : 2016NatCo ... 713549V . doi : 10.1038 / ncomms13549 . PMC 5159813 . PMID 27941752 .
Veja também
- eletroquímica
- catálise
- eletrólise de água
- Modificação eletroquímica não faradaica da atividade catalítica
- Equação de Tafel