Enone - Enone
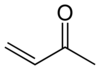
Uma enona , também chamado um α, β carbonil-insaturado, é um tipo de composto orgânico consistindo de um alceno conjugado com um cetona . A enona é mais simples metil vinil cetona (butenona) ou CH 2 = CHCOCH 3 . Um enal é o α, β-insaturado correspondente aldeído , sendo um exemplo a acroleína (CH 2 = CHCHO).
Conteúdo
Síntese
Enonas são tipicamente produzidas utilizando uma condensação aldólica ou de Knoevenagel condensação . Alguns enonas comercialmente significativas são produzidos por condensações de acetona , por exemplo, óxido de mesitilo e isoforona .
No rearranjo Meyer-Schuster o composto de partida é um propargil álcool . Enonas cíclicas podem ser preparados através da reacção de Pauson-Khand .
reações
Enonas sofrer muitos tipos de reações.
Eles são electrofílico , tanto o carbonil carbono, bem como o β-carbono. Dependendo das condições, um ou outro local é atacado por nucleófilos . Além do alceno é chamado de adições conjugadas . Adições de Michael são exemplos.
Enonas são muitas vezes boas dien�ilos em reações de Diels-Alder . Eles são activados por ácidos de Lewis, que se ligam ao oxigénio do carbonilo.
Enonas são prontamente reduzido. Eles podem ser submetidos tanto a redução do carbonilo e do alceno ( redução conjugado ), bem como ambos.
Enonas sofrer a reacção de ciclização Nazarov e na reacção Rauhut-Currier (dimerização).
Enonas de desimpedimento estérico tal como metil vinil cetona são propensos a polimerização.
Enonas são bons ligandos para complexos de metais de baixo-valente, exemplos sendo Fe (BDA) (CO) 3 e tris (dibenzilidenoacetona) dipaládio (0) .
Os compostos relacionados
Enona não deve ser confundido com ceteno (R 2 = C = O). Uma enamina é um primo de uma enona, com o carbonilo substituído por uma amina grupo.
Síntese utilizando formação enolato regioespecica e funcionalidade mascarado
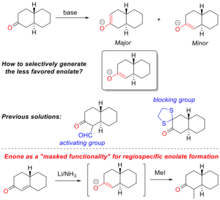
Formação regioespecica é controlado o enolato de formação pela desprotonação específica em uma das a- carbonos da molécula de cetona de partida. Isto proporciona uma melhor compreendida da estratégias de síntese para introduzir complexidade química no produto natural e sínteses totais . Um exemplo importante da sua utilização é na síntese total de progesterona ilustrado na Figura "formação regioespecica enolato na síntese total de progesterona".
Quando cetonas são tratados com base de , enolatos pode ser formado por desprotonao em qualquer α-carbono. A selectividade é determinada por ambas as estereoquímicas e efeitos electrónicos sobre as a-átomos de carbono, bem como da base específica utilizada (ver figura "" funcionalidade mascarado "para a formao de enolato regioespecica" para um exemplo disto). Formação enolato vai ser termodinamicamente favorecida no protão mais ácido que depende da estabilização electrónica do resultante anião . No entanto, a selectividade pode ser invertida, impedindo estereoquimicamente o produto termodinâmico e portanto cineticamente favorecendo desprotonação no outro centro de α-carbono. Os métodos tradicionais para a formação do enolato regiosselectiva usar ambos os grupos de activação electrónicos (por exemplo aldeídos ) ou grupos de bloqueio esticos (por exemplo, 1,2-etanoditiol cetona protegida).
Enona (também conhecido como α, cetona β-insaturado) também pode servir como um precursor para a formação de regioespecica de enolato, aqui a enona é uma “funcionalidade mascarado” para o enolato. Este processo é descrito pela primeira vez por Gilbert Stork , que é mais conhecido pela sua contribuição para o estudo de métodos de formação de enolato selectivos em síntese orgânica .
O método utiliza também Stork enona como um “funcionalidade mascarado” de enolato. Reagindo enona com lítio metálico gera o enolato no α-carbono da enona. O produto enolato pode ser preso ou alquilado. Ao usar “funcionalidade mascarada”, é possível produzir enolatos que não são acessíveis por métodos tradicionais.
A abordagem de “funcionalidade mascarado” para regioespecica formação enolato tem sido amplamente utilizado na síntese total de produtos naturais. Por exemplo, na síntese total da hormona esterde progesterona , Stork e colaboradores utilizaram o “funcionalidade mascarado” para construir um estereoespecificamente dos quaternários átomos de carbono na molécula.