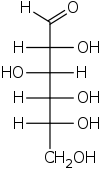
Projeção Fischer - Fischer projection
A projeção Fischer , idealizada por Emil Fischer em 1891, é uma representação bidimensional de uma molécula orgânica tridimensional por projeção . As projeções de Fischer foram originalmente propostas para a representação de carboidratos e usadas por químicos , particularmente em química orgânica e bioquímica . O uso de projeções de Fischer em não carboidratos é desencorajado, pois tais desenhos são ambíguos quando confundidos com outros tipos de desenhos.
Convenções
Todas as ligações não terminais são descritas como linhas horizontais ou verticais. A cadeia de carbono é representada verticalmente, com átomos de carbono às vezes não mostrados e representados pelo centro das linhas cruzadas (veja a figura abaixo). A orientação da cadeia de carbono é para que o primeiro carbono (C1) fique no topo. Em uma aldose , C1 é o carbono do grupo aldeído ; em uma cetose , C1 é o carbono mais próximo do grupo cetona , que é tipicamente encontrado em C2.
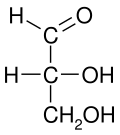
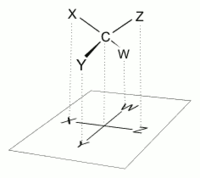
Em uma projeção de Fischer, todas as ligações horizontais devem ser inclinadas em direção ao visualizador. Moléculas com uma geometria tetraédrica simples podem ser facilmente giradas no espaço, para que esta condição seja satisfeita (ver figuras). Por exemplo, um monossacarídeo com três átomos de carbono ( triose ), como o D- Gliceraldeído representado acima, tem uma geometria tetraédrica, com C2 em seu centro, e pode ser girado no espaço de modo que a cadeia de carbono seja vertical com C1 no topo , e as ligações horizontais que conectam C2 com -H e -OH são inclinadas em direção ao observador.
No entanto, ao criar uma projeção de Fischer para um monossacarídeo com mais de três carbonos, não há como orientar a molécula no espaço de forma que todas as ligações horizontais sejam inclinadas em direção ao observador. Depois de girar a molécula de modo que ambas as ligações horizontais com C2 sejam inclinadas em direção ao observador, as ligações horizontais com C3 serão tipicamente inclinadas para longe. Assim, após traçar as ligações com C2, antes de traçar as ligações com C3, a molécula deve ser girada no espaço 180 ° em torno de seu eixo vertical. Outras rotações semelhantes podem ser necessárias para completar o desenho.
Isso implica que, na maioria dos casos, uma projeção de Fischer não é uma representação precisa da configuração 3D real de uma molécula. Pode ser considerado como uma projeção de uma versão modificada da molécula, idealmente torcida em vários níveis ao longo de sua espinha dorsal. Por exemplo, uma molécula de cadeia aberta de D- glicose girada de modo que as ligações horizontais com C2 sejam inclinadas em direção ao observador, teria as ligações com C3 e C5 inclinadas para longe do visualizador e, portanto, sua projeção precisa não coincidiria com um Projeção de Fischer. Para uma representação mais precisa de uma molécula de cadeia aberta , uma projeção Natta pode ser usada.
De acordo com as regras da IUPAC, todos os átomos de hidrogênio devem ser preferencialmente desenhados explicitamente; em particular, os átomos de hidrogênio do grupo final de carboidratos devem estar presentes. Nesse aspecto, a projeção de Fischer é diferente das fórmulas esqueléticas .
Uso
As projeções de Fischer são mais comumente usadas em bioquímica e química orgânica para representar monossacarídeos . Eles também podem ser usados para aminoácidos ou para outras moléculas orgânicas, embora isso seja desencorajado pelas recomendações de 2006 da IUPAC.
Uma projecção de Fischer pode ser utilizado para diferenciar entre moléculas de L- e D- . Por exemplo, por definição, em uma projeção de Fischer, o penúltimo carbono dos açúcares D são representados com hidrogênio à esquerda e hidroxila à direita. L-açúcares serão mostrados com o hidrogênio à direita e a hidroxila à esquerda.
Outros sistemas
As projeções de Haworth são uma notação química relacionada, usada para representar açúcares em forma de anel. Os grupos do lado direito de uma projeção de Fischer são equivalentes àqueles abaixo do plano do anel nas projeções de Haworth. As projeções de Fischer não devem ser confundidas com as estruturas de Lewis , que não contêm nenhuma informação sobre a geometria tridimensional . A notação de cunha e travessão é usada para representar a estereoquímica da maioria das classes de compostos orgânicos, com as projeções de Newman sendo usadas para representar conformações específicas de ligações rotativas de moléculas orgânicas (incluindo, mas não se limitando a, carboidratos).