Bateria de fluxo - Flow battery
Uma bateria de fluxo , ou bateria de fluxo redox (após redução-oxidação ), é um tipo de célula eletroquímica em que a energia química é fornecida por dois componentes químicos dissolvidos em líquidos que são bombeados através do sistema em lados separados de uma membrana. A troca iônica (acompanhada por fluxo de corrente elétrica) ocorre através da membrana enquanto ambos os líquidos circulam em seus respectivos espaços. A voltagem da célula é determinada quimicamente pela equação de Nernst e varia, em aplicações práticas, de 1,0 a 2,43 volts .
Uma bateria de fluxo pode ser usada como uma célula de combustível (onde o combustível gasto é extraído e novo combustível é adicionado ao sistema) ou como uma bateria recarregável (onde uma fonte de energia elétrica impulsiona a regeneração do combustível). Embora tenha vantagens técnicas sobre os recarregáveis convencionais, como tanques de líquidos potencialmente separáveis e longevidade quase ilimitada, as implementações atuais são comparativamente menos potentes e exigem eletrônicos mais sofisticados.
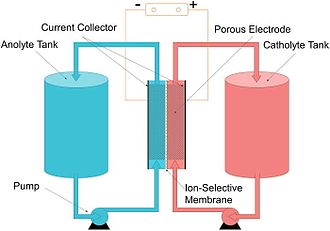
A capacidade de energia é uma função do volume do eletrólito e a potência é uma função da área de superfície dos eletrodos .
Princípio de construção
Uma bateria de fluxo é uma célula de combustível recarregável na qual um eletrólito contendo um ou mais elementos eletroativos dissolvidos flui através de uma célula eletroquímica que converte reversivelmente energia química diretamente em eletricidade . Os elementos eletroativos são "elementos em solução que podem fazer parte de uma reação do eletrodo ou que podem ser adsorvidos no eletrodo". Eletrólito adicional é armazenado externamente, geralmente em tanques, e normalmente é bombeado através da célula (ou células) do reator, embora sistemas de alimentação por gravidade também sejam conhecidos. As baterias de fluxo podem ser "recarregadas" rapidamente substituindo o eletrólito líquido (de maneira semelhante ao reabastecimento de tanques de combustível para motores de combustão interna ) enquanto, simultaneamente, recuperam o material gasto para recarga. Muitas baterias de fluxo usam eletrodos de feltro de carbono devido ao seu baixo custo e condutividade elétrica adequada, embora esses eletrodos limitem um pouco a densidade de potência devido à sua baixa atividade inerente para muitos pares redox.
Em outras palavras, uma bateria de fluxo é uma célula eletroquímica , com a propriedade de que a solução iônica ( eletrólito ) é armazenada fora da célula (em vez de na célula ao redor dos eletrodos) e pode ser alimentada na célula para gerar eletricidade . A quantidade total de eletricidade que pode ser gerada depende do volume de eletrólito nos tanques.
As baterias de fluxo são regidas pelos princípios de design estabelecidos pela engenharia eletroquímica .
Tipos
Vários tipos de células de fluxo (baterias) foram desenvolvidos, incluindo redox , híbrida e sem membrana. A diferença fundamental entre baterias convencionais e células de fluxo é que a energia é armazenada no material do eletrodo em baterias convencionais, enquanto nas células de fluxo é armazenada no eletrólito .
Redox
A célula redox (redução-oxidação) é uma célula reversível na qual os componentes eletroquímicos são dissolvidos no eletrólito. As baterias de fluxo Redox são recarregáveis ( células secundárias ). Por empregarem transferência heterogênea de elétrons em vez de difusão ou intercalação no estado sólido , são mais apropriadamente chamados de células de combustível do que de baterias. Na prática industrial, as células de combustível são geralmente, e desnecessariamente, consideradas células primárias, como o H
2/ O
2sistema. A célula de combustível regenerativa unitizada em NASA 's Helios Prototype é uma outra célula de combustível reversível. A Organização Europeia de Patentes classifica as células de fluxo redox (H01M8 / 18C4) como uma subclasse de células de combustível regenerativas (H01M8 / 18). Exemplos de baterias de fluxo redox são a bateria de fluxo redox de vanádio , bateria de brometo de polissulfeto (Regenesys) e bateria de fluxo redox de urânio. As células a combustível Redox são menos comuns comercialmente, embora muitos sistemas tenham sido propostos.
As baterias de fluxo redox de vanádio são as baterias de fluxo mais comercializadas atualmente, devido a uma série de vantagens que oferecem em relação a outras substâncias químicas, apesar de sua energia e densidades de potência limitadas. Uma vez que eles usam vanádio em ambos os eletrodos, eles não sofrem problemas de contaminação cruzada. Pela mesma razão, eles têm ciclos de vida incomparáveis (15.000-20.000 ciclos), o que por sua vez resulta em um custo nivelado recorde de energia (LCOE, ou seja, o custo do sistema dividido pela energia utilizável, o ciclo de vida e a eficiência de ida e volta) , que estão na ordem de algumas dezenas de $ centavos ou € centavos por kWh, ou seja, muito mais baixas do que outras baterias de estado sólido e não tão longe das metas de $ 0,05 e € 0,05, declaradas por agências governamentais dos EUA e da CE.
Um protótipo de bateria de fluxo de zinco - poliiodeto foi demonstrado com uma densidade de energia de 167 Wh / l ( watt-hora por litro ). As células mais antigas de brometo de zinco atingem 70 Wh / l. Para efeito de comparação, as baterias de fosfato de ferro e lítio armazenam 233 Wh / l. A bateria de poliiodeto de zinco é considerada mais segura do que outras baterias de fluxo devido à sua ausência de eletrólitos ácidos, não inflamabilidade e faixa de operação de −4 a 122 ° F (−20 a 50 ° C) que não requer circuito de resfriamento extenso, o que exigiria adicione peso e ocupe espaço. Um problema não resolvido é o acúmulo de zinco no eletrodo negativo que permeou a membrana, reduzindo a eficiência. Por causa da formação de dendrito Zn, as baterias de haleto de Zn não podem operar em alta densidade de corrente (> 20 mA / cm 2 ) e, portanto, têm densidade de potência limitada. Adicionar álcool ao eletrólito da bateria ZnI pode controlar ligeiramente o problema.
Quando a bateria está totalmente descarregada, ambos os tanques contêm a mesma solução eletrolítica: uma mistura de íons de zinco carregados positivamente ( Zn2+
) e íon iodeto carregado negativamente, ( I-
) Quando carregado, um tanque contém outro íon negativo, poliiodeto, ( I-
3) A bateria produz energia bombeando líquido de tanques externos para a área da pilha da bateria, onde os líquidos são misturados. Dentro da pilha, os íons de zinco passam por uma membrana seletiva e se transformam em zinco metálico no lado negativo da pilha. Para aumentar ainda mais a densidade de energia da bateria de fluxo de iodeto de zinco, íons brometo ( Br
-) são usados como o agente complexante para estabilizar o iodo livre, formando íons iodo-brometo ( I
2Br-
) como meio de liberar íons de iodeto para armazenamento de carga.
As químicas de bateria de fluxo tradicionais têm baixa energia específica (o que as torna muito pesadas para veículos totalmente elétricos) e baixa energia específica (o que as torna muito caras para armazenamento de energia estacionária). No entanto, uma alta potência de 1,4 W / cm 2 foi demonstrada para baterias de fluxo de hidrogênio-bromo e uma alta energia específica (530 Wh / kg no nível do tanque) foi demonstrada para baterias de fluxo de bromato de hidrogênio
Um sistema usa polímeros orgânicos e uma solução salina com uma membrana de celulose . O protótipo resistiu a 10.000 ciclos de carga, mantendo uma capacidade substancial. A densidade de energia era de 10 Wh / l. A densidade atual atingiu 100 miliamperes / cm 2 .
Híbrido
A bateria de fluxo híbrido usa um ou mais componentes eletroativos depositados como uma camada sólida. Nesse caso, a célula eletroquímica contém um eletrodo de bateria e um eletrodo de célula de combustível. Este tipo é limitado em energia pela área de superfície do eletrodo. As baterias de fluxo híbrido incluem as baterias de fluxo de zinco-bromo , zinco-cério , chumbo-ácido e ferro-sal. Weng et al. relataram uma bateria de fluxo híbrido recarregável de hidreto de vanádio-metal com OCV experimental de 1,93 V e tensão de operação de 1,70 V, valores muito elevados entre as baterias de fluxo recarregáveis com eletrólitos aquosos. Esta bateria híbrida consiste em um eletrodo positivo de feltro de grafite operando em uma solução mista de VOSO 4 e H 2 SO 4 , e um eletrodo negativo de hidreto metálico em solução aquosa de KOH. Os dois eletrólitos de pH diferentes são separados por uma membrana bipolar. O sistema demonstrou boa reversibilidade e alta eficiência em coulomb (95%), energia (84%) e voltagem (88%). Eles relataram outras melhorias deste novo par redox com conquistas de densidade de corrente aumentada, operação de eletrodos maiores de 100 cm 2 e operação de 10 células grandes em série. Dados preliminares usando uma entrada de energia simulada flutuante testaram a viabilidade em relação ao armazenamento em escala de kWh. Recentemente, uma bateria de fluxo híbrido Mn (VI) / Mn (VII) -Zn de alta densidade de energia foi proposta.
Sem membrana
Uma bateria sem membrana depende de um fluxo laminar no qual dois líquidos são bombeados através de um canal, onde passam por reações eletroquímicas para armazenar ou liberar energia. As soluções fluem em paralelo, com pouca mistura. O fluxo separa naturalmente os líquidos, dispensando a necessidade de membrana.
As membranas são frequentemente os componentes mais caros e menos confiáveis das baterias, pois podem ser corroídas pela exposição repetida a certos reagentes. A ausência de membrana possibilita o uso de solução líquida de bromo e hidrogênio: essa combinação é problemática quando as membranas são utilizadas, pois formam ácido bromídrico que pode destruir a membrana. Ambos os materiais estão disponíveis a baixo custo.
O projeto usa um pequeno canal entre dois eletrodos. O bromo líquido flui através do canal sobre um cátodo de grafite e o ácido bromídrico flui sob um ânodo poroso. Ao mesmo tempo, o gás hidrogênio flui pelo ânodo. A reação química pode ser revertida para recarregar a bateria - uma inovação em qualquer projeto sem membrana. Uma dessas baterias de fluxo sem membrana publicada em agosto de 2013 produziu uma densidade de potência máxima de 0,795 mW / cm 2 , três vezes mais potência do que outros sistemas sem membrana - e uma ordem de magnitude maior do que as baterias de íon-lítio.
Recentemente, foi demonstrada uma bateria de fluxo redox sem membrana em macroescala, capaz de recarregar e recircular os mesmos fluxos de eletrólitos por vários ciclos. A bateria é baseada em católitos orgânicos imiscíveis e líquidos anolíticos aquosos, que apresentam alta capacidade de retenção e eficiência coulombica durante o ciclismo.
Orgânico
Em comparação com as baterias de fluxo redox que são inorgânicas, como baterias de fluxo redox de vanádio e baterias Zn-Br2, que foram desenvolvidas por décadas, as baterias de fluxo redox orgânicas surgiram em 2009. O principal apelo das baterias de fluxo redox orgânicas está nas propriedades redox ajustáveis dos componentes redox-ativos.
As baterias de fluxo redox orgânicas podem ser classificadas em aquosas (AORFBs) e não aquosas (NAORFBs). Os AORFBs usam água como solvente para materiais eletrolíticos, enquanto os NAORFBs empregam solventes orgânicos. AORFBs e NAORFBs podem ser divididos em sistemas orgânicos totais e híbridos. O primeiro usa apenas materiais orgânicos de eletrodo, enquanto o último usa materiais inorgânicos para ânodo ou cátodo. No armazenamento de energia em grande escala, o menor custo do solvente e a maior condutividade proporcionam aos AORFBs um maior potencial comercial, além de oferecer vantagens de segurança em relação aos eletrólitos à base de água. Em vez disso, os NAORFBs fornecem uma janela de voltagem muito maior e ocupam menos espaço físico.
As quinonas e seus derivados são a base de muitos sistemas redox orgânicos. Num estudo, o ácido 1,2-dihydrobenzoquinone-3,5-dissulfónico (BQDS) e ácido 1,4-dihydrobenzoquinone-2-sulfónico (BQS) foram empregadas como cátodos, e convencional de Pb / PBSO 4 foi o anólito em um híbrido ácido AORFB. As quinonas aceitam duas unidades de carga elétrica, em comparação com uma no católito convencional, o que implica que tal bateria poderia armazenar o dobro de energia em um determinado volume.
O ácido 9,10-antraquinona-2,7-dissulfônico (AQDS), também uma quinona , foi avaliado. AQDS sofre redução rápida e reversível de dois elétrons / dois prótons em um eletrodo de carbono vítreo em ácido sulfúrico . Uma bateria de fluxo aquoso com eletrodos de carbono baratos, combinando o par quinona / hidroquinona com o Br
2/ Br-
par redox , produz uma densidade de potência galvânica de pico superior a 6.000 W / m 2 a 13.000 A / m 2 . A ciclagem mostrou> 99% de retenção da capacidade de armazenamento por ciclo. A densidade de energia volumétrica era superior a 20 Wh / L. O ácido antraquinona-2-sulfônico e o ácido antraquinona-2,6-dissulfônico no lado negativo e o ácido 1,2-di-hidrobenzoquinona-3,5-dissulfônico no lado positivo evitam o uso de Br 2 perigoso . A bateria durou 1.000 ciclos sem degradação, embora nenhum dado tenha sido publicado. Embora este sistema orgânico total pareça robusto, ele tem uma voltagem de célula baixa (ca. 0,55 V) e uma densidade de energia baixa (<4 Wh / L).
O ácido bromídrico usado como eletrólito foi substituído por uma solução alcalina muito menos tóxica (1 M KOH ) e ferrocianeto . O pH mais alto é menos corrosivo, permitindo o uso de tanques de polímero de baixo custo. O aumento da resistência elétrica na membrana foi compensado pelo aumento da voltagem. A voltagem da célula era de 1,2 V. A eficiência da célula excedeu 99%, enquanto a eficiência de ida e volta mediu 84%. A bateria tem uma vida útil esperada de pelo menos 1.000 ciclos. Sua densidade de energia teórica era de 19 Wh / L. A estabilidade química do ferrocianeto em solução de KOH com pH alto sem formar Fe (OH) 2 ou Fe (OH) 3 precisa ser verificada antes do aumento de escala.
Outro AORFB orgânico utilizou metil viologen como anólito e 4-hidroxi- 2,2,6,6-tetrametilpiperidina -1-oxil como católito, além de cloreto de sódio e uma membrana de troca aniônica de baixo custo. Este sistema MV / TEMPO tem a tensão de célula mais alta, 1,25 V e, possivelmente, o custo de capital mais baixo ($ 180 / kWh) relatado para AORFBs. Os eletrólitos líquidos à base de água foram projetados para substituir os sistemas atuais sem substituir a infraestrutura existente. Uma bateria de teste de 600 miliwatts permaneceu estável por 100 ciclos com quase 100 por cento de eficiência em densidades de corrente variando de 20 a 100 mA / cm 2 , com desempenho ideal avaliado em 40-50 mA, no qual cerca de 70% da tensão original da bateria era retido. Os AORFBs neutros podem ser mais ecológicos do que os AORFBs ácidos ou alcalinos, ao mesmo tempo que apresentam desempenho eletroquímico comparável aos RFBs corrosivos. O MV / TEMPO AORFB tem uma densidade de energia de 8,4 Wh / L com a limitação do lado TEMPO.
Um conceito de bateria de fluxo é baseado em polímeros orgânicos redox ativos. Emprega viologen e TEMPO com membranas de diálise. A bateria de fluxo redox à base de polímero (pRFB) usa macromoléculas funcionalizadas (semelhantes ao vidro acrílico ou isopor ) dissolvidas em água como material ativo para os eletrodos. Assim, podem ser utilizadas membranas de diálise simples. A membrana funciona como um filtro e é produzida com muito mais facilidade e menor custo do que as membranas seletivas de íons convencionais. Ele retém as grandes moléculas de polímero semelhantes a "espaguete", enquanto permite que os pequenos contra-íons passem. O conceito pode resolver o alto custo da membrana Nafion tradicional , mas o projeto e a síntese do polímero ativo redox com alta solubilidade em água não são triviais.
Alinhado com a sintonia dos componentes redox ativos como a principal vantagem das baterias de fluxo redox orgânicas, foi desenvolvida a ideia de integrar anólito e católito na mesma molécula. Os chamados analitos bifuncionais ou combi-moléculas permitem a utilização do mesmo material nos dois tanques, o que apresenta vantagens relevantes como a diminuição do efeito de crossover. Assim, diaminoantraquinona, também uma quinona, e moléculas baseadas em índigo, bem como moléculas combinando TEMPO / fenazina têm se apresentado como eletrólitos potenciais para o desenvolvimento de baterias simétricas de fluxo redox (SRFB).
Outro candidato a anólito é a fluorenona , reprojetada para aumentar sua solubilidade em água. Uma célula de demonstração de (des) hidrogenação de cetona reversível operou continuamente por 120 dias ao longo de 1.111 ciclos de carga em temperatura ambiente sem o uso de um catalisador, retendo 97% por cento de sua capacidade. A célula oferece mais do que o dobro da densidade de energia dos sistemas baseados em vanádio.
Hidreto metálico
As baterias de fluxo de prótons (PFB) integram um eletrodo de armazenamento de hidreto metálico em uma célula de combustível de membrana de troca de prótons reversível (PEM) . Durante o carregamento, o PFB combina íons de hidrogênio produzidos a partir da divisão da água com elétrons e partículas de metal em um eletrodo de uma célula de combustível. A energia é armazenada na forma de um hidreto de metal no estado sólido. A descarga produz eletricidade e água quando o processo é revertido e os prótons são combinados com o oxigênio ambiente. Metais mais baratos que o lítio podem ser usados e fornecem maior densidade de energia do que as células de lítio.
Complexos de metal
As baterias de fluxo metal-orgânico usam ligantes orgânicos para fornecer propriedades mais favoráveis aos metais redox ativos. Os ligantes podem ser quelatos como o EDTA e podem permitir que o eletrólito esteja em pH neutro ou alcalino, condições sob as quais os complexos aquosos metálicos precipitariam. Ao bloquear a coordenação da água com o metal, os ligantes orgânicos também podem inibir as reações de divisão da água catalisadas pelo metal , resultando em alguns dos sistemas totalmente aquosos de maior voltagem já relatados. Por exemplo, o uso de cromo coordenado a 1,3-propanodiaminotetraacetato (PDTA), deu potenciais celulares de 1,62 V vs. ferrocianeto e um recorde de 2,13 V vs. bromo. As baterias de fluxo metal-orgânico são às vezes conhecidas como baterias de fluxo de química de coordenação, que representam a tecnologia por trás da tecnologia Gridstar Flow da Lockheed Martin.
Nanorrede
O sistema de lítio-enxofre organizado em uma rede de nanopartículas elimina a necessidade de movimentação de carga para dentro e para fora das partículas que estão em contato direto com uma placa condutora. Em vez disso, a rede de nanopartículas permite que a eletricidade flua por todo o líquido. Isso permite que mais energia seja extraída.
Outras baterias do tipo fluxo
Outras baterias de fluxo incluem a bateria de fluxo híbrido de zinco-cério , a bateria de fluxo híbrido de zinco-bromo e a bateria de bromo de hidrogênio .
Semi-sólido
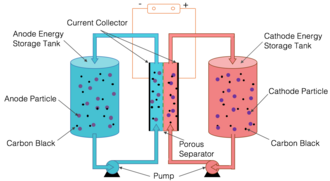
Em uma célula de fluxo semissólida , os eletrodos positivo e negativo são compostos de partículas suspensas em um líquido transportador. As suspensões positivas e negativas são armazenadas em tanques separados e bombeadas através de tubos separados para uma pilha de câmaras de reação adjacentes, onde são separadas por uma barreira, como uma membrana fina e porosa. A abordagem combina a estrutura básica das baterias de fluxo aquoso, que usam material de eletrodo suspenso em um eletrólito líquido, com a química das baterias de íon-lítio em suspensões livres de carbono e lamas com rede de carbono condutora. A bateria de fluxo redox semissólida sem carbono também é às vezes chamada de bateria de fluxo redox de dispersão sólida . A dissolução de um material muda seu comportamento químico significativamente. No entanto, suspender pedaços de material sólido preserva as características do sólido. O resultado é uma suspensão viscosa que flui como melaço .
Químicos
Uma ampla variedade de produtos químicos foi testada para baterias de fluxo.
| Casal | Máx. voltagem da célula (V) | Densidade de potência média do eletrodo (W / m 2 ) | Densidade média de energia do fluido | Ciclos |
|---|---|---|---|---|
| Hidrogênio - bromato de lítio | 1,1 | 15.000 | 750 Wh / kg | |
| Hidrogênio - clorato de lítio | 1,4 | 10.000 | 1400 Wh / kg | |
| Bromo - hidrogênio | 1.07 | 7.950 | ||
| Ferro- estanho | 0,62 | <200 | ||
| Ferro - titânio | 0,43 | <200 | ||
| Ferro- cromo | 1.07 | <200 | ||
| Orgânico (2013) | 0,8 | 13.000 | 21,4 Wh / L | 10 |
| Orgânico (2015) | 1,2 | 7,1 Wh / L | 100 | |
| MV-TEMPO | 1,25 | 8,4 Wh / L | 100 | |
| Metal-orgânico - ferrocianeto | 1,62 | 2000 | 21,7 Wh / L | 75 |
| Metal-orgânico - bromo | 2,13 | 3000 | 35 Wh / L | 10 |
| Vanádio-vanádio (sulfato) | 1,4 | ~ 800 | 25 Wh / L | |
| Vanádio-vanádio (brometo) | 50 Wh / L | 2000 | ||
| Polissulfeto de sódio-bromo | 1,54 | ~ 800 | ||
| Sódio-potássio | ||||
| Sal de enxofre-oxigênio | ||||
| Zinco-bromo | 1,85 | ~ 1.000 | 75 Wh / kg | > 2000 |
| Chumbo-ácido (metanossulfonato) | 1,82 | ~ 1.000 | ||
| Zinco-cério (metanossulfonato) | 2,43 | <1.200–2.500 | ||
| Zn-Mn (VI) / Mn (VII) | 1,2 | 60 Wh / L |
Vantagens
As baterias de fluxo Redox e, em menor medida, as baterias de fluxo híbrido, têm as vantagens de
- layout flexível (devido à separação dos componentes de energia e energia)
- ciclo de vida longo (porque não há transições de fase sólido para sólido )
- tempos de resposta rápidos
- não há necessidade de carga de "equalização" (a sobrecarga de uma bateria para garantir que todas as células tenham uma carga igual)
- sem emissões prejudiciais.
Alguns tipos também oferecem fácil determinação do estado de carga (por meio da dependência da tensão na carga), baixa manutenção e tolerância a sobrecarga / sobredescarga.
Eles estão seguros porque
- eles normalmente não contêm eletrólitos inflamáveis
- eletrólitos podem ser armazenados longe da pilha de energia.
Esses méritos técnicos tornam as baterias de fluxo redox uma opção adequada para armazenamento de energia em grande escala.
Desvantagens
As duas principais desvantagens são
- baixa densidade de energia (você precisa de grandes tanques de eletrólito para armazenar quantidades úteis de energia)
- baixas taxas de carga e descarga (em comparação com outros processos de eletrodos industriais). Isso significa que os eletrodos e separadores de membrana precisam ser grandes, o que aumenta os custos.
Em comparação com células de combustível não reversíveis ou eletrolisadores que usam químicas eletrolíticas semelhantes, as baterias de fluxo geralmente têm uma eficiência um pouco menor.
Formulários
Baterias de fluxo são normalmente consideradas para aplicações estacionárias relativamente grandes (1 kWh - 10 MWh). Estes são para:
- Balanceamento de carga - onde a bateria é conectada a uma rede elétrica para armazenar o excesso de energia elétrica fora do horário de pico e liberar energia elétrica durante os períodos de pico de demanda. O problema comum que limita o uso da maioria dos produtos químicos de bateria de fluxo nesta aplicação é sua baixa potência de área (densidade de corrente operacional), que se traduz em um alto custo de energia.
- Armazenamento de energia de fontes renováveis, como eólica ou solar, para descarga durante os períodos de pico de demanda.
- Pico de barbear, onde picos de demanda são atendidos pela bateria.
- UPS , onde a bateria é usada se a alimentação principal falhar para fornecer um fornecimento ininterrupto.
- Conversão de energia - porque todas as células compartilham o (s) mesmo (s) eletrólito (s). Portanto, o (s) eletrólito (s) podem ser carregados usando um determinado número de células e descarregados com um número diferente. Como a tensão da bateria é proporcional ao número de células usadas, a bateria pode, portanto, atuar como um conversor CC-CC muito poderoso . Além disso, se o número de células for alterado continuamente (no lado da entrada e / ou da saída), a conversão de energia também pode ser AC / DC, AC / AC ou DC – AC com a frequência limitada pelo dispositivo de comutação.
- Veículos elétricos - como as baterias de fluxo podem ser "recarregadas" rapidamente com a substituição do eletrólito, elas podem ser usadas para aplicações em que o veículo precisa receber energia tão rápido quanto um veículo com motor de combustão. Um problema comum encontrado com a maioria dos químicos RFB nas aplicações EV é sua baixa densidade de energia, que se traduziu em um curto alcance de condução. Baterias de fluxo baseadas em halatos altamente solúveis são uma exceção notável.
- Sistema de energia autônomo - um exemplo disso é em estações rádio-base de celular, onde não há energia da rede disponível. A bateria pode ser usada junto com fontes de energia solar ou eólica para compensar seus níveis de energia flutuantes e com um gerador para fazer o uso mais eficiente dele para economizar combustível. Atualmente, as baterias de fluxo estão sendo usadas em aplicações de microrrede solar em todo o Caribe.