Hexobarbital - Hexobarbital
 | |
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Hexobarbital, Hexobarbitona, Metilhexabital, Methexenil, Evipal |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Ligação proteica | 25% |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Painel CompTox ( EPA ) | |
| ECHA InfoCard |
100.000.241 |
| Dados químicos e físicos | |
| Fórmula | C 12 H 16 N 2 O 3 |
| Massa molar | 236,271 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| Quiralidade | Mistura racêmica |
| Densidade | 1,1623 g / cm 3 |
| Ponto de fusão | 146,5 ° C (295,7 ° F) |
| Ponto de ebulição | 378,73 ° C (713,71 ° F) |
| Solubilidade em Água | 0,435 mg / mL (20 ° C) |
| |
| |
| (verificar) | |
Hexobarbital ou hexobarbitone , vendido tanto em formas de sais de ácidos e de sódio como Citopan , evipan , e Tobinal , é um barbiturato derivado tendo hipnóticos e sedativos efeitos. Foi usado nas décadas de 1940 e 1950 como agente indutor de anestesia para cirurgia, bem como hipnótico de ação rápida e curta duração para uso geral, com início de efeitos relativamente rápido e curta duração de ação. Também foi usado para assassinar mulheres prisioneiras no campo de concentração de Ravensbrück . Os barbitúricos modernos (como o tiopental ) suplantaram amplamente o uso do hexobarbital como anestésico, pois permitem um melhor controle da profundidade da anestesia. O hexobarbital ainda é usado em algumas pesquisas científicas.
História
A classe química dos barbitúricos é um dos mais antigos agentes sedativos-hipnóticos conhecidos, datando da introdução do barbital no início do século XX. Na Europa Oriental, o hexobarbital (e outros barbitúricos) têm sido usados regularmente como drogas por mulheres grávidas que tentam o suicídio. Hexobarbital foi considerado por muito tempo como tendo efeitos potencialmente teratogênicos e fetotóxicos. O FDA os classificou como Gravidez Categoria D ou C. Algumas pesquisas, entretanto, indicam que a ingestão de Hexobarbital pode causar anomalias congênitas.
Durante a Segunda Guerra Mundial, Herta Oberheuser foi médica nazista e condenada l criminosa de guerra , investigando os efeitos do hexobarbital. Os experimentos foram realizados principalmente em prisioneiras do campo de concentração de Ravensbrück .
Aplicação em pesquisa
O hexobarbital é usado como narcótico no Teste do Sono Hexobarbital (HST). O HST identifica roedores com alta ou baixa intensidade de oxidação microssomal, de forma rápida (FM) ou metabolizadores lentos (SM). O teste do sono é, por exemplo, usado para prever a suscetibilidade e resistência ao PTSD ou para determinar o efeito de compostos tóxicos no tempo de sono.
Síntese
O hexobarbital pode ser sintetizado pela reação de metil (ciclohexen-1-il) cianoacetato com guanidina e metilato de sódio . Forma-se então um precursor de hexobarbital de sódio que pode ser metilado com sulfato de dimetilo .
Outra via para a síntese do hexobarbital é a reação do éster etílico do ácido metilciclohexenilcianoacético com N-metilureia. Esta reação é feita em duas etapas, na primeira etapa os reagentes são adicionados com terc-butilato em álcool terc-butílico a 20-50 ° C. No segundo estágio, cloreto de hidrogênio é adicionado com etanol e água como solvente .
Reatividade
Uma das citocromo P450 isozimas é codificada pelo gene CYP2B1, em que o substrato é hexobarbital. O hexobarbital e a isozima podem formar um complexo enzima-substrato por meio de uma reação de hidroxilação , que está envolvida no metabolismo dos xenobióticos . a concentração de hexobarbital também desempenha um papel na atividade da oxigenase e oxidase do citocromo microssomal hepático P450.
A triacetil oleandomicina, um inibidor da isoenzima CYP3A4, também inibe o metabolismo e a atividade biológica do hexobarbital, indicando uma estreita relação entre o hexobarbital e o citocromo P450.
Toxicidade
Mecanismo de ações
Os efeitos biológicos do hexobarbital dependem principalmente de sua capacidade de penetrar no sistema nervoso central . O hexobarbital pode potencializar os receptores GABA A , como todos os barbitúricos . Ao longo dos anos, foi descoberto que o enantiômero S (+) do hexobarbital potencializa os receptores GABA A de forma mais eficaz do que seu enantiômero R (-). Quando o GABA se liga ao receptor GABA A , os canais de íon cloreto se abrem de forma que os íons cloreto podem fluir para o neurônio . Isso causa uma hiperpolarização no potencial de membrana do neurônio, o que torna menos provável que o neurônio inicie um potencial de ação . Portanto, este tipo de receptor é o principal receptor de neurotransmissor inibitório no sistema nervoso central de mamíferos. Como um potencializador do receptor GABA A , o hexobarbital liga-se ao sítio de ligação do barbitúrico localizado no canal do íon cloreto, aumentando assim a ligação do GABA e dos benzodiazepínicos ao seu respectivo sítio de ligação, alostericamente. Além disso, o hexobarbital faz com que a abertura do canal do íon cloreto ao seu estado aberto mais longo de 9 milissegundos, fazendo com que o efeito inibitório pós-sináptico seja estendido. Em contraste com o GABA, o glutamato é o principal neurotransmissor excitatório no cérebro dos mamíferos. Além do efeito inibitório, o hexobarbital bloqueia, como todos os barbitúricos, os receptores AMPA , os receptores cainato , os receptores neurais da acetilcolina . E acima de tudo, barbitúricos inibem a libertação de glutamato, causando um bloqueio do canal aberto em Q do tipo de alta voltagem P / activados os canais de cálcio . Em suma, o hexobarbital causa um efeito depressor do SNC no cérebro ao inibir a liberação de glutamato e potencializar o efeito GABA.
Metabolismo
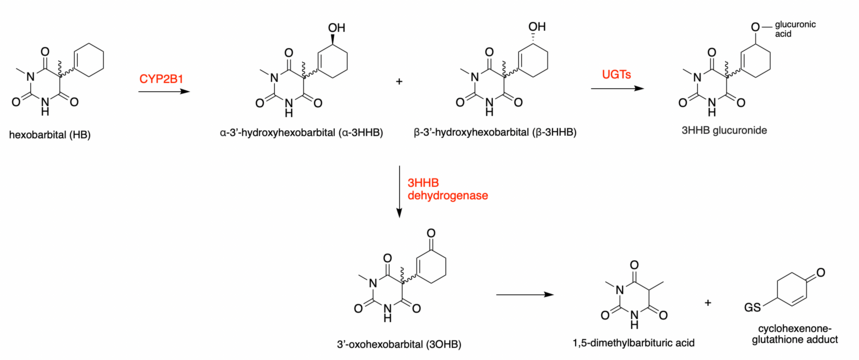
O metabolismo hepático do hexobarbital (HB) pode ser dividido em diferentes vias, todas formando metabólitos diferentes. O enantiômero S (+) de HB metaboliza preferencialmente em β-3'-hidroxihexobarbital e o enantiômero R (-) metaboliza preferencialmente em α-3'-hidroxihexobarbital, a reação, portanto, é estereosseletiva. Ambos os enantiômeros, no entanto, formam os isômeros α e β. No total, quatro enantiômeros para 3'-hidroxihexobarbital (3HHB) podem ser metabolizados. Esta reação é catalisada por um citocromo P450 , CYP2B1. Todos os isômeros 3HHB formados podem sofrer metabolismo adicional via glucuronidação ou desidrogenação .
Se o 3HHB sofre uma reação de glucuronidação , via UDP-glucuronosil transferases (UGTs), ele é rapidamente excretado. 3HHB também pode sofrer desidrogenação , formando uma cetona reativa , 3'-oxohexobarbital (3OHB). A biotransformação de 3HHB em 3OHB é através da enzima 3HHB desidrogenase (3HBD), uma oxidação ligada a NAD (P) +. Esta enzima faz parte da superfamília da aldo-ceto redutase (AKR). Em humanos, o 3HBD tem alta preferência por NAD + . Estas reações também são estereoespecíficas, a conformação R (-) forma preferencialmente 3OHB, uma vez que 3HBD tem a atividade mais alta para este enantiômero nas formas alfa e beta.
Novas evidências provaram o metabolismo adicional de 3OHB em ácido 1,5-dimetilbarbitúrico e um aduto de glutationa ciclohexenona. Esta etapa de biotransformação ocorre por meio de um mecanismo epóxido-diol. A formação de um epóxido reativo, leva à formação dos compostos mencionados.
Experimentos no homem indicaram que os principais metabólitos são 3HHB, 3OHB e ácido 1,5-dimetilbarbitúrico.
Efeitos na saúde no homem
Excreção
A meia-vida plasmática do HB no homem é estimada em 222 ± 54 min. A depuração de HB difere entre os dois enantiômeros e a idade do sujeito humano. A depuração do enantiómero R (-) é quase 10 vezes maior do que a depuração do enantiómero S (+). A folga, em média, em idosos, em comparação com indivíduos jovens, é mais lenta. A excreção é principalmente através da urina, para os três metabólitos principais. O aduto de glutationa ciclohexenona é excretado na bile.
Sintomas
Uma intoxicação no homem com hexobarbital pode resultar em lentidão, incoordenação, dificuldade em pensar, lentidão na fala, julgamento incorreto, sonolência ou coma, respiração superficial e cambaleando. Em alguns casos graves, o coma e a morte podem ser o resultado de uma sobredosagem.
Efeitos em animais
A tabela a seguir apresenta os estudos sobre os efeitos do hexobarbital em animais, realizados na década de 1900. A maioria desses estudos mostrou que o hexobarbital tem efeitos de toxicidade de curto prazo e que pode induzir efeitos hipnóticos em camundongos, coelhos e sapos.
| Organismo | Testtype | Rota | Dose | Efeito | Referência |
|---|---|---|---|---|---|
| rato | LD50 | intraperitoneal | 330 mg / kg (330 mg / kg) | ||
| rato | LDLo | subcutâneo | 400 mg / kg (400 mg / kg) | ||
| mouse | LD50 | oral | 468 mg / kg (468 mg / kg) | Prolongamento do tempo de sono | |
| mouse | LD50 | intraperitoneal | 270 mg / kg (270 mg / kg) | Prolongamento do tempo de sono e tempo de imobilidade, que são potencializados pela L-asparagina | |
| mouse | LDLo | subcutâneo | 250 mg / kg (250 mg / kg) | ||
| mouse | LD50 | intravenoso | 133 mg / kg (133 mg / kg) | Comportamental: sonolência (atividade deprimida geral) | Archives Internationales de Pharmacodynamie et de Therapie., 163 (11), 1966 |
| mouse | LDLo | intrapleural | 340 mg / kg (340 mg / kg) | Efeito hipnótico, que é potencializado por 4,5-di-hidro-6-metil-2 [2- (4-piridil) -etil] -3-piridazinona (U-320) | |
| mouse | LD50 | parenteral | 160 mg / kg (160 mg / kg) | Farmacologia e Toxicologia. Tradução para o inglês de FATOAO., 20 (569), 1957 | |
| Coelho | LDLo | oral | 1200 mg / kg (1200 mg / kg) | Atores ultracurtos; efeito hipnótico
Dose letal mínima: 1200 mg / kg Dose hipnótica mínima: 15 mg / kg |
|
| Coelho | LDLo | intravenoso | 80 mg / kg (80 mg / kg) | Atores ultracurtos; efeito hipnótico
Dose letal mínima: 80 mg / kg Dose hipnótica mínima: 15 mg / kg |
|
| Coelho | LDLo | retal | 175 mg / kg (175 mg / kg) | Atores ultracurtos; efeito hipnótico
Dose letal mínima: 175 mg / kg Dose hipnótica mínima: 15 mg / kg |
|
| Sapo | LDLo | intraperitoneal | 30 mg / kg (30 mg / kg) | ||
| Sapo | LD50 | parenteral | 148 mg / kg (148 mg / kg) | Farmacologia e Toxicologia. Tradução para o inglês de FATOAO., 20 (569), 1957 |
Na cultura popular
No mistério de Agatha Christie, Cards on the Table , de 1937, Hexobarbital é usado em conjunto com Veronal para induzir overdose. É referido por Hercule Poirot como N-metil-ciclo-hexenil-metil-malonil ureia e Evipan.