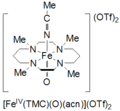Ferro de alta valência - High-valent iron
Ferro de alta valência comumente denota compostos e intermediários nos quais o ferro é encontrado em um estado de oxidação formal > 3 que mostram um número de ligações > 6 com um número de coordenação ≤ 6. O termo é bastante incomum para compostos de ferro coordenados hepta. Ele deve ser diferenciado dos termos hipervalente e hipercoordenado , pois os compostos de ferro de alta valência não violam necessariamente a regra dos 18 elétrons nem necessariamente mostram números de coordenação> 6. O íon ferrato (VI) [FeO 4 ] 2− foi a primeira estrutura nesta classe sintetizada. Os compostos sintéticos discutidos abaixo contêm ferro altamente oxidado em geral, uma vez que os conceitos estão intimamente relacionados.
Compostos oxoiron
Espécies de oxoferril são comumente propostas como intermediários em ciclos catalíticos , especialmente sistemas biológicos nos quais a ativação de O 2 é necessária. O oxigênio diatômico tem um alto potencial de redução (E 0 = 1,23 V), mas a primeira etapa necessária para aproveitar esse potencial é uma redução termodinamicamente desfavorável de um elétron E 0 = -0,16 V. Essa redução ocorre na natureza pela formação de um complexo superóxido em que um metal reduzido é oxidado pelo O 2 . O produto dessa reação é um radical peróxido que é mais prontamente reativo. A abundância dessas espécies na natureza e a química de que dispõem são as razões pelas quais o estudo desses compostos é importante. Um método amplamente aplicável para a geração de espécies de oxoferril de alta valência é a oxidação com iodosobenzeno :
- oxidação simbólica de um composto de ferro usando iodosobenzeno ; L denota o ligante de suporte
Fe (IV) O
Várias sínteses de espécies de oxoiron (IV) foram relatadas. Esses compostos modelam complexos biológicos, como citocromo P450 , NO sintase e isopenicilina N sintase. Dois desses compostos relatados são o oxoiron ligado com tiolato (IV) e o acetato de ciclam oxoiron (IV). O oxoiron ligado com tiolato (IV) é formado pela oxidação de um precursor, [Fe II (TMCS)] (PF 6 ) (TMCS = 1-mercaptoetil-4,8,11-trimetil-1,4,8,11- cyclotetradecane tetraza), e 3-5 equivalentes de H 2 O 2 a -60 C em metanol . O composto de ferro (IV) é de cor azul profundo e mostra características de absorção intensa em 460 nm, 570 nm, 850 nm e 1050 nm. Esta espécie Fe IV (= O) (TMCS) + é estável a -60 ˚C, mas a decomposição é relatada com o aumento da temperatura. O composto 2 foi identificado por espectroscopia de Mõssbauer , de alta resolução com ionização por electrospray espectrometria de massa (ESI-MS), raios-X espectroscopia de absorção , de raio-X estendida estrutura de absorção fina (EXAFS), espectroscopia de ultravioleta-visível (UV-vis), transformada de Fourier espectroscopia de infravermelho (FT-IR) e os resultados foram comparados aos cálculos da teoria funcional da densidade (DFT).
O tetrametilciclam oxoiron (IV) é formado pela reação de Fe II (TMC) (OTf) 2 , TMC = 1,4,8,11-tetrametil-1,4,8,11-tetraazaciclotetradecano; OTf = CF 3 SO 3 , com iodosilbenzeno (PhIO) em CH 3 CN a -40 ˚C. Um segundo método para a formação de oxoiron ciclama (IV) é referida como a reacção de Fe II (TMC) (OTf) 2 com 3 equivalentes de H 2 O 2 durante 3 horas. Esta espécie é de cor verde pálido e tem um máximo de absorção a 820 nm. É relatado como estável por pelo menos 1 mês a -40 ˚C. Foi caracterizado por espectroscopia Mössbauer, ESI-MS, EXAFS, UV-vis, espectroscopia Raman e FT-IR.
Os complexos de bispidina de ferro de alta valência podem oxidar ciclohexano a ciclohexanol e ciclohexanona em 35% de rendimento com uma razão de álcool para cetona de até 4.
Fe (V) O
Fe V TAML (= O), TAML = ligante tetra-amido macrocíclico , é formado pela reação de [Fe III (TAML) (H 2 O)] (PPh 4 ) com 2-5 equivalentes de ácido meta-cloroperbenzóico em - 60 ˚C em n-butironitrila. Este composto verde escuro (dois λ max em 445 e 630 nm respectivamente) é estável em 77 K. A estabilização de Fe (V) é atribuída à forte capacidade de doador π de nitrogênios de amida desprotonados.
Fe (VI) O
Ferrato (VI) é um ânion inorgânico de fórmula química [FeO 4 ] 2− . É fotossensível e contribui com uma cor violeta pálida para seus compostos e soluções. É uma das espécies oxidantes mais fortes e estáveis em água conhecidas. Embora seja classificado como uma base fraca , as soluções concentradas de ferrato (VI) só são estáveis em pH alto .
Estrutura eletronica
A estrutura eletrônica dos compostos de oxoiron porfirina foi revisada.
Compostos de nitridoiron e imidoiron
Os compostos de nitridoiron e imidoiron estão intimamente relacionados à química ferro-dinitrogênio . O significado biológico de nitridoiron (V) porfirinas foi revisto. Um método amplamente aplicável para gerar espécies de nitridoiron de alta valência é a eliminação oxidativa térmica ou fotoquímica de nitrogênio molecular de um complexo de azida .
- a eliminação oxidativa simbólica de nitrogênio produz um complexo de nitridoiron; L denota o ligante de suporte.
Fe (IV) N
Existem vários compostos de nitridoiron (IV) estruturalmente caracterizados.
Fe (V) N
O primeiro composto de nitridoiron (V) foi sintetizado e caracterizado por Wagner e Nakamoto (1988, 1989) usando fotólise e espectroscopia Raman em baixas temperaturas.
Fe (VI) N
Uma segunda espécie de Fe VI além do íon ferrato (VI) , [(Me 3 cy-ac) FeN] (PF 6 ) 2 , foi relatada. Esta espécie é formada por oxidação seguida de fotólise para produzir a espécie Fe (VI). A caracterização do complexo de Fe (VI) foi feita por cálculos Mossbauer, EXAFS, IR e DFT. Ao contrário do íon ferrato (VI), o composto 5 é diamagnético .
Compostos de nitrido μ e catálise de oxidação
Os compostos μ-nitrido di-ferro ftalocianina em ponte catalisam a oxidação do metano a metanol , formaldeído e ácido fórmico usando peróxido de hidrogênio como oxidante sacrificial.
Estrutura eletronica
As espécies nitridoiron (IV) e nitridoiron (V) foram exploradas teoricamente pela primeira vez em 2002.
Veja também
- Catalisador de Jacobsen (manganês de alta valência)
Referências
Leitura adicional
- Solomon et al .; Angewandte Chemie International Edition Volume 47, Issue 47, pages 9071–9074, 10 de novembro de 2008; doi : 10.1002 / anie.200803740