Hidreto - Hydride
Em química , um hidreto é formalmente o ânion de hidrogênio , H - . O termo é aplicado vagamente. Em um extremo, todos os compostos contendo átomos de H ligados covalentemente são chamados de hidretos: água (H 2 O) é um hidreto de oxigênio , a amônia é um hidreto de nitrogênio , etc. Para químicos inorgânicos, hidretos se referem a compostos e íons nos quais o hidrogênio é covalentemente ligado a um elemento menos eletronegativo . Nesses casos, o centro H tem caráter nucleofílico, que contrasta com o caráter prótico dos ácidos. O ânion hidreto é raramente observado.
Quase todos os elementos formam compostos binários com hidrogênio , as exceções sendo He , Ne , Ar , Kr , Pm , Os , Ir , Rn , Fr e Ra . Moléculas exóticas como hidreto de positrônio também foram feitas.
Títulos
As ligações entre o hidrogênio e os outros elementos variam de altamente a um tanto covalentes. Alguns hidretos, por exemplo, hidretos de boro , não estão em conformidade com as regras clássicas de contagem de elétrons e a ligação é descrita em termos de ligações multicêntricas, enquanto os hidretos intersticiais freqüentemente envolvem ligações metálicas . Os hidretos podem ser moléculas discretas , oligômeros ou polímeros , sólidos iônicos , monocamadas adsorvidas quimicamente , metais a granel (intersticiais) ou outros materiais. Enquanto os hidretos tradicionalmente reagem como bases de Lewis ou agentes redutores , alguns hidretos metálicos se comportam como doadores de átomos de hidrogênio e agem como ácidos.
Formulários

- Hidretos como borohidreto de sódio , hidreto de alumínio e lítio , hidreto de diisobutilalumínio (DIBAL) e superhidreto são comumente usados como agentes redutores em síntese química . O hidreto adiciona a um centro eletrofílico, tipicamente carbono insaturado.
- Hidretos como hidreto de sódio e hidreto de potássio são usados como bases fortes na síntese orgânica . O hidreto reage com o ácido de Bronsted fraco liberando H 2 .
- Hidretos como o hidreto de cálcio são usados como dessecantes , ou seja, agentes secantes, para remover vestígios de água dos solventes orgânicos. O hidreto reage com a água formando hidrogênio e sal hidróxido . O solvente seco pode então ser destilado ou transferido por vácuo do "pote de solvente".
- Os hidretos são importantes nas tecnologias de bateria de armazenamento, como a bateria de níquel-hidreto metálico . Vários hidretos de metal foram examinados para uso como meio de armazenamento de hidrogênio para carros elétricos movidos a células de combustível e outros aspectos específicos de uma economia de hidrogênio .
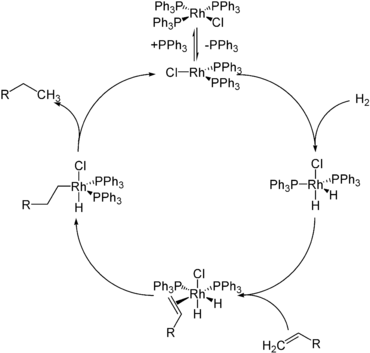
- Os complexos de hidretos são catalisadores e intermediários catalíticos em uma variedade de ciclos catalíticos homogêneos e heterogêneos. Exemplos importantes incluem hidrogenação , hidroformilação , hidrossililação , catalisadores de hidrodessulfurização . Mesmo certas enzimas, a hidrogenase , operam por meio de intermediários de hidreto. O transportador de energia nicotinamida adenina dinucleotídeo reage como um doador de hidreto ou equivalente de hidreto.
Íon hidreto
Os ânions de hidreto livre existem apenas em condições extremas e não são invocados para uma solução homogênea. Em vez disso, muitos compostos têm centros de hidrogênio com caráter hidrídico.
Além do eletrídeo , o íon hidreto é o ânion mais simples possível , consistindo em dois elétrons e um próton . O hidrogênio tem uma afinidade eletrônica relativamente baixa , 72,77 kJ / mol e reage exotermicamente com os prótons como uma poderosa base de Lewis .
A baixa afinidade eletrônica do hidrogênio e a força da ligação H – H (Δ H BE = 436 kJ / mol) significa que o íon hidreto também seria um forte agente redutor
Tipos de hidretos
De acordo com a definição geral, cada elemento da tabela periódica (exceto alguns gases nobres ) forma um ou mais hidretos. Essas substâncias foram classificadas em três tipos principais de acordo com a natureza de sua ligação :
- Hidretos iônicos , que têm caráter de ligação iônica significativa .
- Hidretos covalentes , que incluem os hidrocarbonetos e muitos outros compostos que se ligam covalentemente aos átomos de hidrogênio.
- Hidretos intersticiais , que podem ser descritos como tendo ligações metálicas .
Embora essas divisões não tenham sido usadas universalmente, elas ainda são úteis para entender as diferenças nos hidretos.
Hidretos iônicos
Estes são compostos estequiométricos de hidrogênio. Os hidretos iônicos ou salinos são compostos de hidreto ligado a um metal eletropositivo, geralmente um metal alcalino ou metal alcalino-terroso . Os lantanídeos divalentes , como o európio e o itérbio, formam compostos semelhantes aos dos metais alcalino-terrosos mais pesados. Nestes materiais, o hidreto é visto como um pseudohalide . Os hidretos salinos são insolúveis em solventes convencionais, refletindo suas estruturas não moleculares. Os hidretos iônicos são usados como bases e, ocasionalmente, como reagentes redutores em síntese orgânica .
- C 6 H 5 C (O) CH 3 + KH → C 6 H 5 C (O) CH 2 K + H 2
Os solventes típicos para tais reações são éteres . Água e outros solventes próticos não podem servir como meio para hidretos iônicos porque o íon hidreto é uma base mais forte do que o hidróxido e a maioria dos ânions hidroxila . O gás hidrogênio é liberado em uma reação típica de ácido-base.
Freqüentemente, os hidretos de metal alcalino reagem com os halogenetos de metal. Hidreto de alumínio e lítio (freqüentemente abreviado como LAH) surge de reações de hidreto de lítio com cloreto de alumínio .
- 4 LiH + AlCl 3 → LiAlH 4 + 3 LiCl
Hidretos covalentes
De acordo com algumas definições, os hidretos covalentes abrangem todos os outros compostos que contêm hidrogênio. Algumas definições limitam hidretos a centros de hidrogênio que reagem formalmente como hidretos, ou seja, são nucleofílicos e átomos de hidrogênio ligados a centros de metal. Esses hidretos são formados por todos os verdadeiros não-metais (exceto os elementos do grupo zero) e os elementos como Al, Ga, Sn, Pb, Bi, Po, etc., que são normalmente de natureza metálica, ou seja, esta classe inclui os hidretos de elementos do bloco p. Nessas substâncias, a ligação hidreto é formalmente uma ligação covalente, muito parecida com a ligação feita por um próton em um ácido fraco . Esta categoria inclui hidretos que existem como moléculas discretas, polímeros ou oligômeros e hidrogênio que foi adsorvido quimicamente a uma superfície. Um segmento particularmente importante de hidretos covalentes são hidretos de metal complexos , hidretos solúveis poderosos comumente usados em procedimentos sintéticos.
Os hidretos moleculares freqüentemente envolvem ligantes adicionais; por exemplo, o hidreto de diisobutilalumínio (DIBAL) consiste em dois centros de alumínio ligados por ligantes de hidreto. Hidretos que são solúveis em solventes comuns são amplamente usados em síntese orgânica. Particularmente comuns são borohidreto de sódio (NaBH 4 ) e hidreto de alumínio e lítio e reagentes impedidos, como DIBAL.
Hidretos intersticiais ou hidretos metálicos
Os hidretos intersticiais existem mais comumente em metais ou ligas. Eles são tradicionalmente chamados de "compostos", embora não estejam estritamente de acordo com a definição de um composto, mais se assemelhando a ligas comuns, como o aço. Em tais hidretos, o hidrogênio pode existir como entidades atômicas ou diatômicas. O processamento mecânico ou térmico, como dobra, percussão ou recozimento, pode fazer com que o hidrogênio precipite da solução por desgaseificação. Sua ligação é geralmente considerada metálica . Esses metais de transição em massa formam hidretos binários intersticiais quando expostos ao hidrogênio. Esses sistemas são geralmente não estequiométricos , com quantidades variáveis de átomos de hidrogênio na rede. Na engenharia de materiais, o fenômeno da fragilização por hidrogênio resulta da formação de hidretos intersticiais. Os hidretos desse tipo se formam de acordo com um de dois mecanismos principais. O primeiro mecanismo envolve a adsorção de dihidrogênio, seguida pela clivagem da ligação HH, a deslocalização dos elétrons do hidrogênio e, finalmente, a difusão dos prótons na estrutura metálica. O outro mecanismo principal envolve a redução eletrolítica do hidrogênio ionizado na superfície da rede metálica, também seguida pela difusão dos prótons na rede. O segundo mecanismo é responsável pela expansão temporária de volume observada de certos eletrodos usados em experimentos eletrolíticos.
O paládio absorve até 900 vezes seu próprio volume de hidrogênio em temperatura ambiente, formando hidreto de paládio . Este material tem sido discutido como um meio de transportar hidrogênio para células a combustível veicular . Os hidretos intersticiais mostram-se promissores como forma de armazenamento seguro de hidrogênio . Estudos de difração de nêutrons mostraram que átomos de hidrogênio ocupam aleatoriamente os interstícios octaédricos na rede metálica (em uma rede FCC há um orifício octaédrico por átomo metálico). O limite de absorção em pressões normais é PdH0,7, indicando que aproximadamente 70% dos orifícios octaédricos estão ocupados.
Muitos hidretos intersticiais foram desenvolvidos para absorver e descarregar hidrogênio prontamente em temperatura ambiente e pressão atmosférica. Eles geralmente são baseados em compostos intermetálicos e ligas de solução sólida. No entanto, sua aplicação ainda é limitada, pois são capazes de armazenar apenas cerca de 2 por cento em peso de hidrogênio, insuficiente para aplicações automotivas.
Complexos de hidreto de metal de transição
Os hidretos de metal de transição incluem compostos que podem ser classificados como hidretos covalentes . Alguns são até classificados como hidretos intersticiais e outros hidretos de ligação. O hidreto de metal de transição clássico apresenta uma ligação simples entre o centro de hidrogênio e o metal de transição. Alguns hidretos de metais de transição são ácidos, por exemplo, HCo (CO) 4 e H 2 Fe (CO) 4 . Os ânions [ReH 9 ] 2− e [FeH 6 ] 4− são exemplos da coleção crescente de hidretos de metal homolépticos moleculares conhecidos . Como pseudo-haletos , os ligantes de hidreto são capazes de se ligar a centros de hidrogênio polarizados positivamente. Essa interação, chamada de ligação de dihidrogênio , é semelhante à ligação de hidrogênio , que existe entre prótons polarizados positivamente e átomos eletronegativos com pares solitários abertos.
Deuterides
Hidretos contendo deutério são conhecidos como deuterídeos . Alguns deuterídeos, como LiD , são combustíveis de fusão importantes em armas termonucleares e moderadores úteis em reatores nucleares .
Compostos de ânions mistos
Existem compostos de ânions mistos que contêm hidreto com outros ânions. Estes incluem hidretos de boreto, carboidratos , hidridonitretos , oxidridos e outros.
Apêndice sobre nomenclatura
Protide , deutereto e tritide são usados para descrever os iões ou compostos que contêm enriquecida de hidrogénio-1 , deutério ou trítio , respectivamente.
No significado clássico, hidreto se refere a qualquer forma composta de hidrogênio com outros elementos, variando entre os grupos 1–16 (os compostos binários de hidrogênio ). A seguir está uma lista da nomenclatura para os derivados de hidreto de compostos do grupo principal de acordo com esta definição:
- metais alcalinos e alcalino- terrosos: hidreto de metal
- boro : borano , BH 3
- alumínio : alumane , AlH 3
- gálio : galano , GaH 3
- índio : indigane , InH 3
- tálio : talano , TlH 3
- carbono : alcanos , alcenos , alcinos e todos os hidrocarbonetos
- silício : silano
- germânio : alemão
- estanho : estanano
- chumbo : plumbane
- nitrogênio : amônia ("azano" quando substituído ), hidrazina
- fósforo : fosfina (observe que "fosfano" é o nome recomendado pela IUPAC )
- arsênico : arsine (nota "arsane" é a IUPAC recomendou nome)
- antimônio : estibina (observe que "estibano" é o nome recomendado pela IUPAC )
- bismuto : bismutina (observe que "bismutano" é o nome recomendado pela IUPAC )
- hélio : hidreto de hélio (existe apenas como um íon)
De acordo com a convenção acima, os seguintes são "compostos de hidrogênio" e não "hidretos":
- oxigênio : água ("oxidano" quando substituído; sinônimo: hidreto de oxigênio), peróxido de hidrogênio
- enxofre : sulfeto de hidrogênio ("sulfano" quando substituído) sinônimo: hidreto de enxofre
- selênio : seleneto de hidrogênio ("selano" quando substituído)
- telúrio : telureto de hidrogênio ("telano" quando substituído)
- polônio : polonídeo de hidrogênio ("polano" quando substituído)
- halogênios : haletos de hidrogênio
Exemplos:
- hidreto de níquel : usado em baterias NiMH
- hidreto de paládio : eletrodos em experimentos de fusão a frio
- hidreto de alumínio e lítio : um poderoso agente redutor usado em química orgânica
- borohidreto de sódio : agente redutor de especialidade seletiva, armazenamento de hidrogênio em células de combustível
- hidreto de sódio : uma base poderosa usada em química orgânica
- diborano : agente redutor, combustível de foguete, dopante semicondutor, catalisador, usado em síntese orgânica; também borano , pentaborano e decaborano
- arsina : usado para semicondutores de dopagem
- stibine : usado na indústria de semicondutores
- fosfina : usada para fumigação
- silano : muitos usos industriais, por exemplo, fabricação de materiais compostos e repelentes de água
- amônia : refrigerante , combustível , fertilizante , muitos outros usos industriais
- sulfeto de hidrogênio : componente do gás natural , importante fonte de enxofre
- Quimicamente, até mesmo água e hidrocarbonetos podem ser considerados hidretos.
Todos os hidretos metalóides são altamente inflamáveis. Todos os hidretos não metálicos sólidos, exceto o gelo, são altamente inflamáveis. Mas quando o hidrogênio se combina com os halogênios, ele produz ácidos em vez de hidretos, e eles não são inflamáveis.
Convenção de precedência
De acordo com a convenção IUPAC , por precedência (eletronegatividade estilizada), o hidrogênio está entre os elementos do grupo 15 e do grupo 16 . Portanto, temos NH 3 , "hidreto de nitrogênio" (amônia), versus H 2 O, "óxido de hidrogênio" (água). Essa convenção às vezes é quebrada para o polônio, que com base na metalicidade do polônio é freqüentemente referido como "hidreto de polônio" em vez do esperado "polonídeo de hidrogênio".
Veja também
- Hidreto parental
- Hydron (cátion de hidrogênio)
- Hydronium
- Próton
- Íon hidrogênio
- Compressor de hidreto
- Superidridos
Referências
Bibliografia
WM Mueller, JP Blackledge, GG Libowitz, Metal Hydrides , Academic Press, NY e Londres, (1968)
links externos
-
 Mídia relacionada a hidretos no Wikimedia Commons
Mídia relacionada a hidretos no Wikimedia Commons


