Hidrofosfinação - Hydrophosphination
A hidrofosfinação é a inserção de uma ligação múltipla carbono-carbono em uma ligação fósforo - hidrogênio formando uma nova ligação fósforo-carbono. Como outras hidrofuncionalizações, a taxa e a regioquímica da reação de inserção são influenciadas pelo catalisador. Os catalisadores assumem muitas formas, mas os mais prevalentes são as bases e os iniciadores de radicais livres.
Rotas ácido-base
A aplicação usual de hidrofosfinação envolve reações de fosfina (PH 3 ). Normalmente, a catálise de base permite a adição de aceitadores de Michael , como acrilonitrila para dar tris (cianoetil) fosfina :
- PH 3 + 3 CH 2 = CHZ → P (CH 2 CH 2 Z) 3 (Z = NO 2 , CN, C (O) NH 2 )
A catálise ácida é aplicável à hidrofosfinação com alcenos que formam carbocações estáveis. Esses alquenos incluem isobutileno e muitos análogos:
- PH 3 + R 2 C = CH 2 → R 2 (CH 3 ) CPH 2 (R = Me, alquil, etc)
As bases catalisam a adição de fosfinas secundárias à vinildifenilfosfina :
- HPR 2 + CH 2 = CHPR ' 2 → R 2 PCH 2 CH 2 PR' 2
Métodos de radicais livres
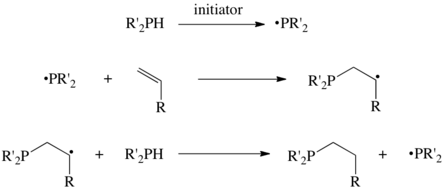
Muitas reações de hidrofosfinação são iniciadas por radicais livres . AIBN e peróxidos são iniciadores típicos, bem como irradiação ultravioleta . Desta forma, a tributilfosfina e trioctilfosfina comercialmente importantes são preparadas com bons rendimentos a partir de 1-buteno e 1-octeno , respectivamente.
As reações ocorrem pela abstração de um átomo de H, o precursor da fosfina, produzindo o radical fosfino, uma espécie de sete elétrons. Este radical então se soma ao alceno e a transferência subsequente do átomo de H completa o ciclo. Algumas hidrofosfinações altamente eficientes parecem não ocorrer via radicais, mas faltam explicações alternativas.
Reações catalisadas por metal
Hidrofosfinações catalisadas por metal não são amplamente utilizadas, embora tenham sido extensivamente pesquisadas. Os estudos concentram-se principalmente em organofosfinas secundárias e primárias (R 2 PH e RPH 2 , respectivamente). Esses substratos se ligam aos metais, e os adutos resultantes inserem alquenos e alquinos nas ligações de PH por meio de diversos mecanismos.
Catalisadores de metal de transição e lantanídeos iniciais
Complexos metálicos de configurações d 0 são catalisadores eficazes para hidrofosfinações de alcenos e alcinos simples. As reações intramoleculares são fáceis, por exemplo, começando com α, ω- pentenilfosfina. A fosfina primária sofre uma metátese de ligação σ com o ligante bis (trimetilsilil) metileno formando o complexo lantanídeo-fosfido. Posteriormente, o alceno ou alcino do terminal pendente é inserido na ligação Ln-P. Finalmente, a protonólise da ligação Ln-C com a fosfina primária inicial libera a nova fosfina e regenera o catalisador. Dado que o metal é pobre em elétrons, a ligação MC é o suficiente para ser protonolisada pela fosfina primária do substrato.
A maioria das hidrofosfinações catalisadas por metal ocorre por meio de intermediários de fosfido de metal . Alguns, entretanto, procedem por intermediários de metal-fosfinideno, ou seja, espécies com ligações duplas M = PR. Um exemplo é a hidrofosfinação catalisada por Ti de difenilacetileno com fenilfosfina. Este sistema envolve um precursor de catalisador catiônico que é estabilizado pelo volumoso 2,4,6-tri (isopropil) fenil- substituinte no fosfinideno e a estreita associação iônica de metiltris (pentafluorofenil) borato. Este precursor sofre troca com fenilfosfina para dar o complexo titânio-fenilfosfinideno, que é o catalisador. A espécie Ti = PPh sofre uma cicloadição [2 + 2] com difenilacetileno para fazer o metalaciclobuteno correspondente. O substrato, fenilfosfina, protonolisa a ligação Ti-C e, após uma mudança de próton, regenera o catalisador e libera a nova fosfina.
Foi demonstrada a hidrofosfinação 1,4-catalisada por titânio de 1,3-dienos com difenilfosfina . É um exemplo raro de um catalisador d 2 . Na primeira etapa, o precursor Ti (II) é inserido na ligação PH da difenilfosfina (Ph 2 PH).
Catalisadores de metal de transição tardia
Os catalisadores de hidrofosfinação de metais de transição tardia, ou seja, aqueles que dependem da tríade de níquel e de elementos vizinhos, geralmente requerem alquenos e alquinos com substituintes que retiram elétrons. Uma base forte é necessária como cocatalisador.
Alguns catalisadores de hidrofosfinação de metal tardio procedem por meio da adição oxidativa de uma ligação PH. Por exemplo, um catalisador de Pt (0) sofre adição oxidativa de uma fosfina secundária para formar o complexo de hidrido Pt (II) fosfido correspondente. Esses sistemas catalisam a hidrofosfinação da acrilonitrila, embora essa reação possa ser realizada sem catalisadores metálicos. A principal etapa de formação da ligação do PC ocorre por meio de uma adição do tipo Michael de esfera externa.
O mecanismo usual de hidrofosfinação para catalisadores de metal tardio envolve a inserção do alceno na ligação metal-fósforo. A inserção na ligação metal-hidrogênio também é possível. O produto fosfina é produzido através da eliminação redutiva de uma ligação PC, em vez de uma ligação PH no sistema de Glueck. O catalisador Ni (0) envolve a adição de oxidação de uma ligação PH ao metal, seguida pela inserção do alceno na ligação MH.
A utilização de hidrofosforilação de precursores de fósforo (V) envolve a inserção de alcenos e alcinos nas ligações de PH de óxidos de fosfina secundários:
- R 2 P (O) H + CH 2 = CHR → R 2 P (O) CH 2 CH 2 R
A reação pode ser realizada usando catalisadores de metal ou iniciadores de radical livre.
Leitura adicional
- Motta, A .; Fragalà, IL; Marks, TJ (2005). "Energetics and Mechanism of Organolanthanide-Mediated Phosphinoalkene Hydrophosphination / Cyclization. A Density Functional Theory Analysis". Organometálicos . 24 (21): 4995. doi : 10.1021 / om050570d .
- Douglass, MR; Stern, CL; Marks, TJ (2001). "Intramolecular Hydrophosphination / Cyclization of Phosphinoalkenes and Phosphinoalkynes Catalyzed by Organolanthanides: Scope, Selectivity, and Mechanism". Journal of the American Chemical Society . 123 (42): 10221–10238. doi : 10.1021 / ja010811i . PMID 11603972 .
- Douglass, MR; Marks, TJ (2000). "Organolanthanide-Catalyzed Intramolecular Hydrophosphination / Cyclization of Phosphinoalkenes and Phosphinoalkynes". Journal of the American Chemical Society . 122 (8): 1824. doi : 10.1021 / ja993633q .
- Douglass, MR; Ogasawara, M .; Hong, S .; Metz, MV; Marks, TJ (2002). " " Ampliando o Telhado ": Síntese e Caracterização de Novos Catalisadores Organolantanídeos QuiralC1-Simétricos Octaidrofluorenil e Sua Implementação nas Ciclizações Estereosseletivas de Aminoalcenos e Fosfinoalcenos". Organometálicos . 21 (2): 283. doi : 10.1021 / om0104013 .
- Kawaoka, AM; Douglass, MR; Marks, TJ (2003). "Homoleptic Lanthanide Alkyl and Amide Precatalysts Efficiently Intramolecular Hydrophosphination / Cyclization. Observations on Scope and Mechanism". Organometálicos . 22 (23): 4630. doi : 10.1021 / om030439a .
- Scriban, C .; Glueck, DS; Zakharov, LN; Kassel, WS; Dipasquale, AG; Golen, JA; Rheingold, AL (2006). "Formação de ligações P-C e C-C por adição de Michael em hidrofosfinação catalisada por platina e nas reações estequiométricas de complexos de fosfido de platina com alcenos ativados". Organometálicos . 25 (24): 5757. doi : 10.1021 / om060631n .
- Scriban, C .; Kovacik, I .; Glueck, DS (2005). "Um aditivo prótico suprime a formação de subprodutos em hidrofosfinação catalisada por platina de olefinas ativadas. Evidência para a formação de ligações P-C e C-C por adição de Michael". Organometálicos . 24 (21): 4871. doi : 10,1021 / om050433g .
- Wicht, DK; Kourkine, IV; Lew, BM; Nthenge, JM; Glueck, DS (1997). "Hidrofosfinação de acrilonitrila catalisada por platina via inserção de olefina em uma ligação Pt-P". Journal of the American Chemical Society . 119 (21): 5039. doi : 10.1021 / ja970355r .
- Kovacik, I .; Wicht, DK; Grewal, NS; Glueck, DS; Incarvito, CD; Guzei, IA; Rheingold, AL (2000). "Pt (Me-Duphos) -Catalyzed Asymmetric Hydrophosphination of Activated Olefins: Enantioselective Synthesis of Chiral Phosphines". Organometálicos . 19 (6): 950. doi : 10.1021 / om990882e .
- Pringle, PG; Smith, MB (1990). "Hidrofosfinação de acrilonitrila catalisada por platina (0)". Journal of the Chemical Society, Chemical Communications (23): 1701. doi : 10.1039 / C39900001701 .
- Sadow, AD; Togni, A. (2005). "Adição Enantiosseletiva de Fosfinas Secundárias a Metacrilonitrila: Catálise e Mecanismo". Journal of the American Chemical Society . 127 (48): 17012-17024. doi : 10.1021 / ja0555163 . PMID 16316248 .
- Huang, Y .; Pullarkat, SA; Li, Y .; Leung, PH (2010). "Hidrofosfinação assimétrica de enonas catalisada por paládio (ii): Acesso eficiente a fosfinas terciárias quirais". Comunicações químicas . 46 (37): 6950–2. doi : 10.1039 / C0CC00925C . PMID 20730193 .
- Xu, C .; Jun Hao Kennard, G .; Hennersdorf, F .; Li, Y .; Pullarkat, SA; Leung, PH (2012). "Fosfaladaciclos quirais como catalisadores eficientes para a hidrofosfinação assimétrica de ésteres de metilidenemalonato substituídos: acesso direto a fosfinas quirais terciárias funcionalizadas". Organometálicos . 31 (8): 3022. doi : 10.1021 / om201115n .
- Huang, Y .; Pullarkat, SA; Teong, S .; Chew, RJ; Li, Y .; Leung, PH (2012). "Construção Intermolecular Assimétrica Catalisada por Paladaciclo de P-Heterociclos Terciários Quirais por Adição Stepwise de H – P – H Bonds a Bis (enones)". Organometálicos . 31 (13): 4871. doi : 10.1021 / om300405h .
- Huang, Y .; Pullarkat, SA; Li, Y .; Leung, PH (2012). "Palladacycle-Catalyzed Asymmetric Hydrophosphination of Enones for Synthesis of C * - and P * -Chiral Tertiary Phosphines". Química Inorgânica . 51 (4): 2533–40. doi : 10.1021 / ic202472f . PMID 22289417 .
- Huang, Y .; Chew, RJ; Li, Y .; Pullarkat, SA; Leung, PH (2011). "Direct Synthesis of Chiral Tertiary Diphosphinesvia Pd (II) -Catalyzed Asymmetric Hydrophosphination of Dienones". Cartas orgânicas . 13 (21): 5862-5. doi : 10.1021 / ol202480r . PMID 21985055 .
- Derrah, EJ; Pantazis, DA; McDonald, R .; Rosenberg, L. (2007). "Um complexo de fosfido de rutênio altamente reativo exibindo ligação Ru-P-π". Organometálicos . 26 (6): 1473. doi : 10.1021 / om0700056 .
- Derrah, EJ; Pantazis, DA; McDonald, R .; Rosenberg, L. (2010). "Concerted [2 + 2] Cycloaddition of Alkenes to a Ruthenium-Phosphorus Double Bond". Angewandte Chemie International Edition . 49 (19): 3367–3370. doi : 10.1002 / anie.201000356 . PMID 20358572 .
- Derrah, EJ; McDonald, R .; Rosenberg, L. (2010). "A cicloadição [2 + 2] de alcinos em uma ligação π Ru – P". Comunicações químicas . 46 (25): 4592–4594. doi : 10.1039 / C002765K . PMID 20458386 .
- Gibson, GL; Morrow, KME; McDonald, R .; Rosenberg, L. (2011). "Síntese diastereosseletiva de um complexo secundário de fosfina" quiral-at-Ru ". Inorganica Chimica Acta . 369 : 133–139. doi : 10.1016 / j.ica.2010.12.058 .