Pressão interna - Internal pressure
| Termodinâmica |
|---|

|
A pressão interna é uma medida de como a energia interna de um sistema muda quando se expande ou se contrai em temperatura constante . Tem as mesmas dimensões da pressão , sendo a unidade SI o pascal .
A pressão interna geralmente recebe o símbolo . É definido como uma derivada parcial da energia interna em relação ao volume a temperatura constante:
Equação de estado termodinâmica
A pressão interna pode ser expressa em termos de temperatura, pressão e sua dependência mútua:
Esta equação é uma das equações termodinâmicas mais simples . Mais precisamente, é uma relação de propriedade termodinâmica, uma vez que é verdadeira para qualquer sistema e conecta a equação de estado a uma ou mais propriedades de energia termodinâmica. Aqui nos referimos a isso como uma "equação de estado termodinâmica".
Derivação da equação de estado termodinâmica A equação termodinâmica fundamental indica o diferencial exato da energia interna : Dividindo esta equação por temperatura constante, obtém-se:
E usando um dos relações Maxwell : , isto dá
Gás perfeito
Em um gás perfeito , não há interações de energia potencial entre as partículas, então qualquer mudança na energia interna do gás é diretamente proporcional à mudança na energia cinética de suas espécies constituintes e, portanto, também à mudança na temperatura:
.
A pressão interna é considerada em temperatura constante, portanto
, o que implica e , finalmente ,
ou seja, a energia interna de um gás perfeito é independente do volume que ocupa. A relação acima pode ser usada como uma definição de um gás perfeito.
A relação pode ser provada sem a necessidade de invocar quaisquer argumentos moleculares. Decorre diretamente da equação de estado termodinâmica se usarmos a lei dos gases ideais .
Gases reais
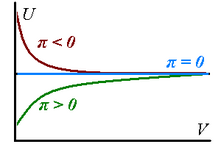
Gases reais têm pressões internas diferentes de zero porque sua energia interna muda conforme os gases se expandem isotermicamente - ela pode aumentar na expansão ( , significando a presença de forças atrativas dominantes entre as partículas do gás) ou diminuir ( , repulsão dominante).
No limite do volume infinito essas pressões internas chegam ao valor zero:
,
correspondendo ao fato de que todos os gases reais podem ser aproximados para serem perfeitos no limite de um volume adequadamente grande. As considerações acima estão resumidas no gráfico à direita.
Se um gás real pode ser descrito pela equação de estado de van der Waals
segue-se da equação de estado termodinâmica que
Como o parâmetro é sempre positivo, sua pressão interna também é: a energia interna de um gás de van der Waals sempre aumenta quando ele se expande isotermicamente.
O parâmetro modela o efeito das forças de atração entre as moléculas do gás. No entanto, pode-se esperar que gases não ideais reais exibam uma mudança de sinal entre as pressões internas positivas e negativas sob as condições ambientais corretas se as interações repulsivas se tornarem importantes, dependendo do sistema de interesse. Em termos gerais, isso tenderia a acontecer em condições tais que o fator de compressão do gás fosse maior do que 1.
Além disso, através do uso da relação em cadeia de Euler, pode-se mostrar que
Definindo como o "coeficiente de Joule" e reconhecendo como a capacidade de calor em volume constante , temos
O coeficiente pode ser obtido medindo a mudança de temperatura para um experimento constante , isto é, uma expansão livre adiabática (veja abaixo). Esse coeficiente costuma ser pequeno e geralmente negativo em pressões modestas (conforme previsto pela equação de van der Waals).
O experimento Joule
James Joule tentou medir a pressão interna de ar na sua experiência expansão por adiabaticamente bombeamento de ar de alta pressão a partir de um recipiente de metal em uma outra evacuado. O banho-maria em que o sistema foi imerso não alterou sua temperatura, significando que não ocorreu alteração na energia interna. Assim, a pressão interna do ar era aparentemente igual a zero e o ar agia como um gás perfeito. Os desvios reais do comportamento perfeito não foram observados, pois são muito pequenos e a capacidade térmica específica da água é relativamente alta.
Referências
Peter Atkins e Julio de Paula, Physical Chemistry 8th edition , pp. 60-61
- ^ J. Westin, um curso em termodinâmica , volume 1, Taylor e Francis, Nova York (1979).