Isótopos de iodo - Isotopes of iodine
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão A r, padrão (I) | 126,904 47 (3) | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Existem 37 isótopos conhecidos de iodo ( 53 I) de 108 I a 144 I; todos sofrem decaimento radioativo, exceto 127 I, que é estável. O iodo é, portanto, um elemento monoisotópico .
Seu isótopo radioativo de vida mais longa , 129 I, tem meia-vida de 15,7 milhões de anos, o que é muito curto para existir como um nuclídeo primordial . Fontes cosmogênicas de 129 I produzem quantidades muito pequenas dele que são muito pequenas para afetar as medições de peso atômico; o iodo é, portanto, também um elemento mononuclídico - encontrado na natureza apenas como um único nuclídeo. A maior parte da radioatividade derivada de 129 I na Terra é produzida pelo homem, um subproduto indesejado de longa duração dos primeiros testes nucleares e acidentes de fissão nuclear.
Todos os outros radioisótopos de iodo têm meia-vida inferior a 60 dias, e quatro deles são usados como traçadores e agentes terapêuticos na medicina. Estes são 123 I, 124 I, 125 I e 131 I. Toda a produção industrial de isótopos de iodo radioativo envolve esses quatro radionuclídeos úteis.
O isótopo 135 I tem meia-vida inferior a sete horas, o que é curto demais para ser usado em biologia. A produção in situ inevitável desse isótopo é importante no controle do reator nuclear, pois ele decai para 135 Xe, o mais poderoso absorvedor de nêutrons conhecido , e o nuclídeo responsável pelo chamado fenômeno do poço de iodo .
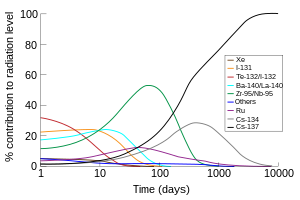
Além da produção comercial, 131 I (meia-vida de 8 dias) é um dos produtos de fissão radioativos comuns da fissão nuclear e, portanto, é produzido inadvertidamente em grandes quantidades dentro de reatores nucleares . Devido à sua volatilidade, meia-vida curta e alta abundância em produtos de fissão, 131 I (junto com o isótopo de iodo de curta duração 132 I do 132 Te de vida longa com meia-vida de 3 dias) é responsável pelo a maior parte da contaminação radioativa durante a primeira semana após a contaminação ambiental acidental do lixo radioativo de uma usina nuclear.
Lista de isótopos
| Nuclídeo |
Z | N |
Massa isotópica ( Da ) |
Meia-vida |
Modo de decaimento |
Isótopo filha |
Giro e paridade |
Abundância natural (fração molar) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Energia de excitação | Proporção normal | Faixa de variação | |||||||||||||||||
| 108 I | 53 | 55 | 107,94348 (39) # | 36 (6) ms | α (90%) | 104 Sb | (1) # | ||||||||||||
| β + (9%) | 108 Te | ||||||||||||||||||
| p (1%) | 107 Te | ||||||||||||||||||
| 109 I | 53 | 56 | 108,93815 (11) | 103 (5) µs | p (99,5%) | 108 Te | (5/2 +) | ||||||||||||
| α (0,5%) | 105 Sb | ||||||||||||||||||
| 110 I | 53 | 57 | 109,93524 (33) # | 650 (20) ms | β + (70,9%) | 110 Te | 1 + # | ||||||||||||
| α (17%) | 106 Sb | ||||||||||||||||||
| β + , p (11%) | 109 Sb | ||||||||||||||||||
| β + , α (1,09%) | 106 Sn | ||||||||||||||||||
| 111 I | 53 | 58 | 110,93028 (32) # | 2,5 (2) s | β + (99,92%) | 111 Te | (5/2 +) # | ||||||||||||
| α (0,088%) | 107 Sb | ||||||||||||||||||
| 112 I | 53 | 59 | 111,92797 (23) # | 3,42 (11) s | β + (99,01%) | 112 Te | |||||||||||||
| β + , p (0,88%) | 111 Sb | ||||||||||||||||||
| β + , α (0,104%) | 108 Sn | ||||||||||||||||||
| α (0,0012%) | 108 Sb | ||||||||||||||||||
| 113 I | 53 | 60 | 112,92364 (6) | 6,6 (2) s | β + (100%) | 113 Te | 5/2 + # | ||||||||||||
| α (3,3 × 10 -7 %) | 109 Sb | ||||||||||||||||||
| β + , α | 109 Sn | ||||||||||||||||||
| 114 I | 53 | 61 | 113,92185 (32) # | 2,1 (2) s | β + | 114 Te | 1+ | ||||||||||||
| β + , p (raro) | 113 Sb | ||||||||||||||||||
| 114m I | 265,9 (5) keV | 6,2 (5) s | β + (91%) | 114 Te | (7) | ||||||||||||||
| TI (9%) | 114 I | ||||||||||||||||||
| 115 eu | 53 | 62 | 114,91805 (3) | 1,3 (2) min | β + | 115 Te | (5/2 +) # | ||||||||||||
| 116 I | 53 | 63 | 115,91681 (10) | 2,91 (15) s | β + | 116 Te | 1+ | ||||||||||||
| 116m I | 400 (50) # keV | 3,27 (16) µs | (7−) | ||||||||||||||||
| 117 I | 53 | 64 | 116,91365 (3) | 2,22 (4) min | β + | 117 Te | (5/2) + | ||||||||||||
| 118 eu | 53 | 65 | 117,913074 (21) | 13,7 (5) min | β + | 118 Te | 2− | ||||||||||||
| 118m I | 190,1 (10) keV | 8,5 (5) min | β + | 118 Te | (7−) | ||||||||||||||
| IT (raro) | 118 eu | ||||||||||||||||||
| 119 I | 53 | 66 | 118,91007 (3) | 19,1 (4) min | β + | 119 Te | 5/2 + | ||||||||||||
| 120 I | 53 | 67 | 119,910048 (19) | 81,6 (2) min | β + | 120 Te | 2− | ||||||||||||
| 120m1 I | 72,61 (9) keV | 228 (15) ns | (1+, 2+, 3+) | ||||||||||||||||
| 120m2 I | 320 (15) keV | 53 (4) min | β + | 120 Te | (7−) | ||||||||||||||
| 121 I | 53 | 68 | 120,907367 (11) | 2,12 (1) h | β + | 121 Te | 5/2 + | ||||||||||||
| 121m I | 2376,9 (4) keV | 9,0 (15) µs | |||||||||||||||||
| 122 I | 53 | 69 | 121,907589 (6) | 3,63 (6) min | β + | 122 Te | 1+ | ||||||||||||
| 123 I | 53 | 70 | 122,905589 (4) | 13,2235 (19) h | CE | 123 Te | 5/2 + | ||||||||||||
| 124 I | 53 | 71 | 123,9062099 (25) | 4,1760 (3) d | β + | 124 Te | 2− | ||||||||||||
| 125 I | 53 | 72 | 124,9046302 (16) | 59,400 (10) d | CE | 125 Te | 5/2 + | ||||||||||||
| 126 I | 53 | 73 | 125,905624 (4) | 12,93 (5) d | β + (56,3%) | 126 Te | 2− | ||||||||||||
| β - (43,7%) | 126 Xe | ||||||||||||||||||
| 127 I | 53 | 74 | 126,904473 (4) | Estábulo | 5/2 + | 1,0000 | |||||||||||||
| 128 I | 53 | 75 | 127,905809 (4) | 24,99 (2) min | β - (93,1%) | 128 Xe | 1+ | ||||||||||||
| β + (6,9%) | 128 Te | ||||||||||||||||||
| 128m1 I | 137,850 (4) keV | 845 (20) ns | 4− | ||||||||||||||||
| 128m2 I | 167,367 (5) keV | 175 (15) ns | (6) - | ||||||||||||||||
| 129 I | 53 | 76 | 128,904988 (3) | 1,57 (4) × 10 7 y | β - | 129 Xe | 7/2 + | Vestígio | |||||||||||
| 130 I | 53 | 77 | 129,906674 (3) | 12,36 (1) h | β - | 130 Xe | 5+ | ||||||||||||
| 130m1 I | 39,9525 (13) keV | 8,84 (6) min | TI (84%) | 130 I | 2+ | ||||||||||||||
| β - (16%) | 130 Xe | ||||||||||||||||||
| 130m2 I | 69,5865 (7) keV | 133 (7) ns | (6) - | ||||||||||||||||
| 130m3 I | 82,3960 (19) keV | 315 (15) ns | - | ||||||||||||||||
| 130m4 I | 85,1099 (10) keV | 254 (4) ns | (6) - | ||||||||||||||||
| 131 I | 53 | 78 | 130,9061246 (12) | 8.02070 (11) d | β - | 131 Xe | 7/2 + | ||||||||||||
| 132 I | 53 | 79 | 131,907997 (6) | 2,295 (13) h | β - | 132 Xe | 4+ | ||||||||||||
| 132m I | 104 (12) keV | 1,387 (15) h | TI (86%) | 132 I | (8−) | ||||||||||||||
| β - (14%) | 132 Xe | ||||||||||||||||||
| 133 I | 53 | 80 | 132,907797 (5) | 20,8 (1) h | β - | 133 Xe | 7/2 + | ||||||||||||
| 133m1 I | 1634,174 (17) keV | 9 (2) s | ISTO | 133 I | (19 / 2−) | ||||||||||||||
| 133m2 I | 1729,160 (17) keV | ~ 170 ns | (15 / 2−) | ||||||||||||||||
| 134 I | 53 | 81 | 133,909744 (9) | 52,5 (2) min | β - | 134 Xe | (4) + | ||||||||||||
| 134m I | 316,49 (22) keV | 3,52 (4) min | TI (97,7%) | 134 I | (8) - | ||||||||||||||
| β - (2,3%) | 134 Xe | ||||||||||||||||||
| 135 I | 53 | 82 | 134,910048 (8) | 6,57 (2) h | β - | 135 Xe | 7/2 + | ||||||||||||
| 136 I | 53 | 83 | 135,91465 (5) | 83,4 (10) s | β - | 136 Xe | (1−) | ||||||||||||
| 136m I | 650 (120) keV | 46,9 (10) s | β - | 136 Xe | (6−) | ||||||||||||||
| 137 I | 53 | 84 | 136,917871 (30) | 24,13 (12) s | β - (92,86%) | 137 Xe | (7/2 +) | ||||||||||||
| β - , n (7,14%) | 136 Xe | ||||||||||||||||||
| 138 I | 53 | 85 | 137,92235 (9) | 6,23 (3) s | β - (94,54%) | 138 Xe | (2−) | ||||||||||||
| β - , n (5,46%) | 137 Xe | ||||||||||||||||||
| 139 I | 53 | 86 | 138,92610 (3) | 2.282 (10) s | β - (90%) | 139 Xe | 7/2 + # | ||||||||||||
| β - , n (10%) | 138 Xe | ||||||||||||||||||
| 140 I | 53 | 87 | 139,93100 (21) # | 860 (40) ms | β - (90,7%) | 140 Xe | (3) (- #) | ||||||||||||
| β - , n (9,3%) | 139 Xe | ||||||||||||||||||
| 141 I | 53 | 88 | 140,93503 (21) # | 430 (20) ms | β - (78%) | 141 Xe | 7/2 + # | ||||||||||||
| β - , n (22%) | 140 Xe | ||||||||||||||||||
| 142 I | 53 | 89 | 141,94018 (43) # | ~ 200 ms | β - (75%) | 142 Xe | 2− # | ||||||||||||
| β - , n (25%) | 141 Xe | ||||||||||||||||||
| 143 I | 53 | 90 | 142,94456 (43) # | 100 # ms [> 300 ns] | β - | 143 Xe | 7/2 + # | ||||||||||||
| 144 I | 53 | 91 | 143,94999 (54) # | 50 # ms [> 300 ns] | β - | 144 Xe | 1− # | ||||||||||||
| Este cabeçalho e rodapé da tabela: | |||||||||||||||||||
- ^ m I - Isômero nuclear excitado.
- ^ () - A incerteza (1 σ ) é dada de forma concisa entre parênteses após os últimos dígitos correspondentes.
- ^ # - Massa atômica marcada com #: valor e incerteza derivados não de dados puramente experimentais, mas pelo menos parcialmente de tendências da superfície de massa (TMS).
- ^ a b c # - Os valores marcados com # não são derivados puramente de dados experimentais, mas pelo menos parcialmente de tendências de nuclídeos vizinhos (TNN).
-
^
Modos de decadência:
CE: Captura de elétrons ISTO: Transição isomérica n: Emissão de nêutrons p: Emissão de prótons - ^ Símbolo em negrito e itálico como filha - o produto filha está quase estável.
- ^ Símbolo em negrito como filha - o produto filha é estável.
- ^ () valor de rotação - Indica rotação com argumentos de atribuição fracos.
- ^ a b c d Tem usos médicos
- ^ a b c Produto de fissão
- ^ Teoricamente capaz de fissão espontânea
- ^ Pode ser usado para datar certos eventos iniciais na história do Sistema Solar e algum uso para datar águas subterrâneas
- ^ Nuclídeo cosmogênico , também encontrado como contaminação nuclear
- ^ Produzido como um produto de decaimento de 135 Te em reatores nucleares, por sua vez decai para 135 Xe, que, se permitido a acumulação, pode desligar os reatores devido aofenômeno de caroço de iodo
Radioisótopos notáveis
Os radioisótopos de iodo são chamados de iodo radioativo ou radioiodo . Existem dezenas, mas cerca de meia dúzia são os mais notáveis em ciências aplicadas , como ciências da vida e energia nuclear, conforme detalhado a seguir. As menções ao radioiodo em contextos de cuidados de saúde referem-se mais frequentemente ao iodo-131 do que a outros isótopos.
Iodo-129 como um radionuclídeo extinto
Foi demonstrado que os excessos do 129 Xe estável em meteoritos resultam da decomposição do iodo-129 "primordial" recentemente produzido pelas supernovas que criaram a poeira e o gás a partir dos quais o sistema solar se formou. Este isótopo decaiu há muito tempo e é, portanto, referido como "extinto". Historicamente, 129 I foi o primeiro radionuclídeo extinto a ser identificado como presente no início do sistema solar . Sua decadência é a base do esquema de datação radiométrica I-Xe iodo-xenônio , que cobre os primeiros 85 milhões de anos de evolução do sistema solar .
Iodo-129 como um marcador de longa vida para contaminação por fissão nuclear
Iodo-129 ( 129 I; meia-vida de 15,7 milhões de anos) é um produto da fragmentação de raios cósmicos em vários isótopos de xenônio na atmosfera , na interação do múon de raios cósmicos com telúrio-130, e também da fissão de urânio e plutônio , ambos em subsuperfície rochas e reatores nucleares. Processos nucleares artificiais, em particular o reprocessamento de combustível nuclear e testes de armas nucleares atmosféricas, agora inundaram o sinal natural para este isótopo. No entanto, agora serve como um traçador de águas subterrâneas como indicador da dispersão de resíduos nucleares no ambiente natural. De maneira semelhante, 129 I foi usado em estudos de água da chuva para rastrear produtos de fissão após o desastre de Chernobyl .
Em alguns aspectos, 129 I é semelhante a 36 Cl . É um halogênio solúvel, existe principalmente como um ânion não adsorvente e é produzido por reações cosmogênicas, termonucleares e in situ. Em estudos hidrológicos, as concentrações de 129 I são geralmente relatadas como a razão de 129 I para o I total (que é virtualmente 127 I). Como é o caso com 36 Cl / Cl, as relações de 129 I / I na natureza são bastante pequenas, 10 −14 a 10 −10 (o pico termonuclear 129 I / I durante as décadas de 1960 e 1970 atingiu cerca de 10 −7 ). 129 I difere de 36 Cl porque sua meia-vida é mais longa (15,7 vs. 0,301 milhão de anos), é altamente biofílica e ocorre em múltiplas formas iônicas (comumente, I - e IO 3 - ), que têm diferentes comportamentos químicos . Isso torna bastante fácil para 129 I entrar na biosfera à medida que é incorporado à vegetação, solo, leite, tecido animal, etc.
Radioiodos 123 I, 124 I, 125 I e 131 I em medicina e biologia

Dos muitos isótopos de iodo, apenas dois são normalmente usados em um ambiente médico: iodo-123 e iodo-131 . Como o 131 I tem um modo de decaimento beta e gama, ele pode ser usado para radioterapia ou para exames de imagem. O 123 I, que não tem atividade beta, é mais adequado para imagens de medicina nuclear de rotina da tireoide e outros processos médicos e menos prejudicial internamente ao paciente. Existem algumas situações em que o iodo-124 e o iodo-125 também são usados na medicina.
Devido à captação preferencial de iodo pela tireoide, o radioiodo é amplamente utilizado em exames de imagem e, no caso do 131 I, destruindo tecidos disfuncionais da tireoide. Outros tipos de tecido absorvem seletivamente certos agentes radiofarmacêuticos contendo iodo-131 e eliminando agentes radiofarmacêuticos (como o MIBG ). O iodo-125 é o único outro radioisótopo de iodo usado na radioterapia, mas apenas como uma cápsula implantada na braquiterapia , onde o isótopo nunca tem chance de ser liberado para interação química com os tecidos do corpo.
Iodo-131
Iodo-131 (131
eu
) é um isótopo emissor de beta com meia-vida de oito dias e radiação beta comparativamente energética (média de 190 keV e energia máxima de 606 keV), que penetra 0,6 a 2,0 mm a partir do local de absorção. Esta radiação beta pode ser usada para a destruição de nódulos tireoidianos ou tecido tireoidiano hiperfuncionante e para a eliminação do tecido tireoidiano remanescente após a cirurgia para o tratamento da doença de Graves . O objetivo desta terapia, que foi explorado pela primeira vez pelo Dr. Saul Hertz em 1941, é destruir o tecido da tireóide que não poderia ser removido cirurgicamente. Neste procedimento, o 131 I é administrado por via intravenosa ou oral após uma varredura diagnóstica. Esse procedimento também pode ser usado, com doses mais altas de radioiodo, para tratar pacientes com câncer de tireoide .
O 131 I é absorvido pelo tecido tireoidiano e aí concentrado. As partículas beta emitidas pelo radioisótopo destroem o tecido tireoidiano associado com poucos danos aos tecidos circundantes (mais de 2,0 mm dos tecidos que absorvem o iodo). Devido à destruição semelhante, 131 I é o radioisótopo de iodo usado em outros radiofármacos marcados com iodo solúveis em água (como o MIBG ) usados terapeuticamente para destruir tecidos.
A radiação beta de alta energia (até 606 keV) de 131 I faz com que seja o mais cancerígeno dos isótopos de iodo. Acredita-se que cause a maioria dos cânceres de tireoide em excesso observados após a contaminação por fissão nuclear (como queda de bomba ou acidentes graves com reatores nucleares, como o desastre de Chernobyl ). No entanto, esses efeitos epidemiológicos são vistos principalmente em crianças e no tratamento de adultos e crianças com tratamentos terapêuticos 131 I e a epidemiologia de adultos expostos a doses baixas de 131 I não demonstraram carcinogenicidade.
Iodo-123 e iodo-125
Os isótopos emissores de gama iodo-123 (meia-vida de 13 horas), e (menos comumente) o iodo-125 de vida mais longa e menos energético (meia-vida de 59 dias) são usados como traçadores de imagem nuclear para avaliar as análises anatômicas e fisiológicas função da tireóide. Resultados anormais podem ser causados por doenças como a doença de Graves ou tireoidite de Hashimoto . Ambos os isótopos decaem por captura de elétrons (EC) para os nuclídeos de telúrio correspondentes , mas em nenhum dos casos são os nuclídeos metaestáveis 123m Te e 125m Te (que são de energia mais alta e não são produzidos a partir de iodo radioativo). Em vez disso, os nuclídeos de telúrio excitados decaem imediatamente (meia-vida muito curta para ser detectada). Após EC, o 123 Te excitado de 123 I emite um elétron de conversão interno de alta velocidade de 127 keV (não um raio beta ) cerca de 13% do tempo, mas isso causa poucos danos celulares devido à meia-vida curta do nuclídeo e a relativa pequena fração de tais eventos. No restante dos casos, um raio gama de 159 keV é emitido, o que é adequado para imagens gama.
O 125 Te excitado resultante da captura de elétrons de 125 I também emite um elétron de conversão interno de energia muito mais baixa (35,5 keV), que causa relativamente poucos danos devido à sua baixa energia, embora sua emissão seja mais comum. A gama de energia relativamente baixa do decaimento de 125 I / 125 Te é pouco adequada para imagens, mas ainda pode ser vista, e este isótopo de vida mais longa é necessário em testes que requerem vários dias de imagens, por exemplo, imagens de varredura de fibrinogênio para detectar coágulos de sangue.
Tanto o 123 I quanto o 125 I emitem copiosos elétrons Auger de baixa energia após seu decaimento, mas eles não causam danos graves (quebras de DNA de fita dupla) nas células, a menos que o nuclídeo seja incorporado a um medicamento que se acumula no núcleo, ou no DNA (este nunca é o caso na medicina clínica, mas tem sido visto em modelos animais experimentais).
O iodo-125 também é comumente usado por oncologistas de radiação em braquiterapia de baixa taxa de dose no tratamento de câncer em locais diferentes da tireoide, especialmente no câncer de próstata . Quando o 125 I é usado terapeuticamente, ele é encapsulado em sementes de titânio e implantado na área do tumor, onde permanece. A baixa energia do espectro gama, neste caso, limita os danos da radiação aos tecidos distantes da cápsula implantada. O iodo-125, devido à sua meia-vida mais longa adequada e espectro gama menos penetrante, também é frequentemente preferido para testes de laboratório que dependem do iodo como um marcador que é contado por um contador gama , como no radioimunoensaio .
A maioria das imagens médicas com iodo é feita com uma câmera gama padrão . No entanto, os raios gama do iodo-123 e do iodo-131 também podem ser vistos por imagem de tomografia computadorizada por emissão de fóton único (SPECT).
Iodo-124
Iodo-124 é um isótopo de iodo rico em prótons, com meia-vida de 4,18 dias. Seus modos de decaimento são: 74,4% de captura de elétrons, 25,6% de emissão de pósitrons. 124 I decai para 124 Te. O iodo-124 pode ser produzido por inúmeras reações nucleares por meio de um ciclotron . O material de partida mais comum usado é 124 Te.
O iodo-124 como o sal de iodeto pode ser usado para obter imagens diretas da tireoide usando tomografia por emissão de pósitrons (PET). O iodo-124 também pode ser usado como um radiotraçador PET com uma meia-vida útil mais longa em comparação com o flúor-18 . Neste uso, o nuclídeo é quimicamente ligado a um fármaco para formar um radiofármaco emissor de pósitrons e injetado no corpo, onde novamente é captado por varredura PET.
Iodo-135 e controle de reator nuclear
Iodo-135 é um isótopo de iodo com meia-vida de 6,6 horas. É um isótopo importante do ponto de vista da física do reator nuclear . É produzido em quantidades relativamente grandes como um produto de fissão e decai para xenônio-135 , que é um veneno nuclear com uma seção transversal de nêutrons térmicos muito grande , que é uma causa de múltiplas complicações no controle de reatores nucleares . O processo de acúmulo de xenônio-135 a partir do iodo-135 acumulado pode impedir temporariamente o reinício de um reator de desligamento. Isso é conhecido como envenenamento por xenônio ou "queda em uma cova de iodo ".
Iodo-128 e outros isótopos
Isótopos produzidos por fissão de iodo não discutidos acima (iodo-128, iodo-130, iodo-132 e iodo-133) têm meia-vida de várias horas ou minutos, tornando-os quase inúteis em outras áreas aplicáveis. Os mencionados são ricos em nêutrons e sofrem decaimento beta em isótopos de xenônio. O iodo-128 (meia-vida de 25 minutos) pode decair para telúrio-128 por captura de elétrons ou para xenônio-128 por decaimento beta. Tem uma radioatividade específica de2,177 × 10 6 TBq / g .
Iodeto não radioativo ( 127 I) como proteção contra a absorção indesejada de radioiodo pela tireoide
Coloquialmente, os materiais radioativos podem ser descritos como "quentes" e os materiais não radioativos podem ser descritos como "frios". Há casos em que o iodeto frio é administrado a pessoas para prevenir a absorção de iodeto quente pela glândula tireóide. Por exemplo, o bloqueio da captação de iodo pela tireoide com iodeto de potássio é usado na cintilografia de medicina nuclear e terapia com alguns compostos radioiodados que não são direcionados à tireoide, como o iobenguano ( MIBG ), que costumava gerar imagens ou tratar tumores do tecido neural, ou iodado fibrinogênio, que é usado em varreduras de fibrinogênio para investigar a coagulação. Esses compostos contêm iodo, mas não na forma de iodeto. No entanto, uma vez que eles podem ser metabolizados ou se decompor em iodeto radioativo, é comum administrar iodeto de potássio não radioativo para garantir que os metabólitos desses radiofármacos não sejam sequestrados pela glândula tireoide e inadvertidamente administrar uma dose radiológica nesse tecido.
O iodeto de potássio foi distribuído a populações expostas a acidentes de fissão nuclear , como o desastre de Chernobyl . A solução de iodeto de SSKI , um s aturated s olução de potássio ( K ) i odide em água, tem sido utilizado para bloquear a absorção do iodo radioactivo (que não tem efeito sobre outros radioisótopos de fissão). Comprimidos contendo iodeto de potássio agora também são fabricados e estocados em locais centrais do desastre por alguns governos para essa finalidade. Em teoria, muitos efeitos nocivos do câncer tardio da precipitação nuclear podem ser evitados desta forma, uma vez que um excesso de cânceres de tireoide, presumivelmente devido à captação de radioiodo, é o único efeito comprovado de contaminação por radioisótopo após um acidente de fissão, ou da contaminação por precipitação de uma bomba atômica (a radiação imediata da bomba também causa outros tipos de câncer, como leucemias, diretamente). A ingestão de grandes quantidades de iodeto satura os receptores da tireoide e evita a captação da maior parte do iodo-131 radioativo que pode estar presente na exposição ao produto da fissão (embora não proteja de outros radioisótopos, nem de qualquer outra forma de radiação direta). O efeito protetor do KI dura aproximadamente 24 horas, então deve ser dosado diariamente até que o risco de exposição significativa a radioiodos de produtos de fissão não exista mais. O iodo-131 (o contaminante de radioiodo mais comum na precipitação radioativa) também decai de forma relativamente rápida com meia-vida de oito dias, de modo que 99,95% do radioiodo original desapareceu após três meses.
Referências
- Massas de isótopos de:
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The N UBASE Evaluation of nuclear and decay properties" , Nuclear Physics A , 729 : 3–128, Bibcode : 2003NuPhA.729 .... 3A , doi : 10.1016 / j.nuclphysa.2003.11 0,001
- Composições isotópicas e massas atômicas padrão de:
- de Laeter, John Robert ; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin JR; Taylor, Philip DP (2003). "Pesos atômicos dos elementos. Revisão 2000 (Relatório Técnico IUPAC)" . Química pura e aplicada . 75 (6): 683–800. doi : 10.1351 / pac200375060683 .
- Wieser, Michael E. (2006). "Pesos atômicos dos elementos 2005 (Relatório Técnico IUPAC)" . Química pura e aplicada . 78 (11): 2051–2066. doi : 10.1351 / pac200678112051 . Resumo da postura .
- Dados de meia-vida, spin e isômero selecionados das seguintes fontes.
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The N UBASE Evaluation of nuclear and decay properties" , Nuclear Physics A , 729 : 3–128, Bibcode : 2003NuPhA.729 .... 3A , doi : 10.1016 / j.nuclphysa.2003.11 0,001
- Centro Nacional de Dados Nucleares . "Banco de dados NuDat 2.x" . Laboratório Nacional de Brookhaven .
- Holden, Norman E. (2004). "11. Tabela dos Isótopos". Em Lide, David R. (ed.). CRC Handbook of Chemistry and Physics (85ª ed.). Boca Raton, Flórida : CRC Press . ISBN 978-0-8493-0485-9.
