Reação halofórmica - Haloform reaction
| Reação halofórmica | |
|---|---|
| Nomeado após | Adolf Lieben |
| Tipo de reação | Reação de substituição |
| Identificadores | |
| Portal de Química Orgânica | reação de halofórmio |
A reação de halofórmio é uma reação química onde um halofórmio (CHX 3 , onde X é um halogênio ) é produzido pela halogenação exaustiva de uma metil cetona (RCOCH 3 , onde R pode ser um átomo de hidrogênio, um grupo alquil ou aril ) , na presença de uma base . A reacção pode ser usado para transformar acetilo grupos em grupos carboxilo ou para produzir clorofmio (CHCl 3 ), bromofórmio (CHBr 3 ), ou iodofórmio (CHI 3 ). [Nota: o fluorofórmio (CHF 3 ) não pode ser preparado desta forma.]
Mecanismo
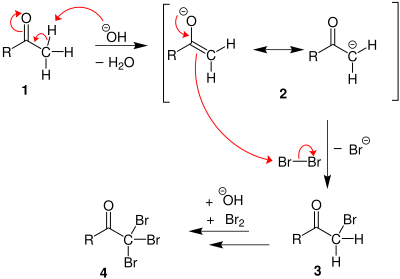
Na primeira etapa, o halogênio se desproporciona na presença de hidróxido para dar o haleto e o hipohalito.
Se um álcool secundário estiver presente, ele é oxidado a uma cetona pelo hipo-halito:
Se uma metil cetona estiver presente, ela reage com o hipohalito em um processo de três etapas:
1. Em condições básicas, a cetona sofre tautomerização ceto-enólica. O enolato sofre ataque eletrofílico pelo hipo-halito (contendo um halogênio com carga +1 formal).
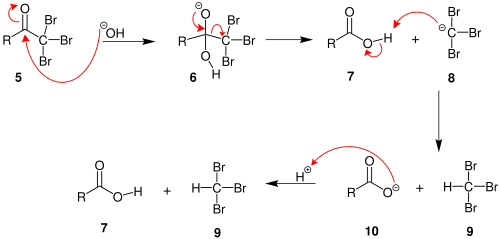
2. Quando a posição α (alfa) foi exaustivamente halogenada, a molécula sofre uma substituição de acila nucleofílica por hidróxido, com - CX 3 sendo o grupo de saída estabilizado por três grupos de retirada de elétrons . Na terceira etapa, o ânion - CX 3 abstrai um próton do solvente ou do ácido carboxílico formado na etapa anterior e forma o halofórmio. Pelo menos em alguns casos ( hidrato de cloral ), a reação pode parar e o produto intermediário isolado se as condições forem ácidas e o hipohalito for usado.
Escopo
Os substratos são amplamente limitados a metil cetonas e álcoois secundários oxidáveis a metil cetonas, como o isopropanol . Os únicos álcool e aldeído primários a sofrer essa reação são o etanol e o acetaldeído , respectivamente. 1,3-dicetonas como acetilacetona também dão a reação halofórmio. Os β-cetoácidos, como o ácido acetoacético , também farão o teste após aquecimento. O cloreto de acetila e a acetamida não dão esse teste. O halogênio usado pode ser cloro , bromo , iodo ou hipoclorito de sódio . O fluorofórmio (CHF 3 ) não pode ser preparado por este método, pois exigiria a presença do íon hipofluorito altamente instável . No entanto, as cetonas com a estrutura RCOCF 3 clivam após o tratamento com base para produzir fluorofórmio; isso é equivalente à segunda e terceira etapas do processo mostrado acima.
Formulários
Balança de laboratório
Esta reação forma a base do teste de iodofórmio que foi comumente usado na história como um teste químico para determinar a presença de uma metil cetona, ou um álcool secundário oxidável a uma metil cetona. Quando iodo e hidróxido de sódio são usados como reagentes, uma reação positiva dá iodofórmio , que é um sólido à temperatura ambiente e tende a precipitar da solução causando uma turvação distinta.
Em química orgânica , esta reação pode ser usada para converter uma metil cetona terminal no ácido carboxílico análogo.
Industrialmente
Antigamente, era usado para produzir iodofórmio, bromofórmio e até clorofórmio industrialmente.
Como um subproduto da cloração da água
A cloração da água pode resultar na formação de haloformas se a água contiver impurezas reativas adequadas (por exemplo, ácido húmico ). Existe a preocupação de que tais reações possam levar à presença de compostos cancerígenos na água potável.
História
A reação haloforma é uma das reações orgânicas mais antigas conhecidas. Em 1822, Georges-Simon Serullas adicionou potássio metálico a uma solução de iodo em etanol e água para formar formato de potássio e iodofórmio, denominado na linguagem da época hidroiodeto de carbono . Em 1832, Justus von Liebig relatou a reação do cloral com o hidróxido de cálcio para formar clorofórmio e formato de cálcio. A reação foi redescoberta por Adolf Lieben em 1870. O teste de iodofórmio também é chamado de reação haloforma de Lieben . Uma revisão da reação haloforma com uma seção de história foi publicada em 1934.