Efeito de isótopo cinético - Kinetic isotope effect
Na reação de brometo de metila com cianeto ,
o efeito isotópico cinético do carbono no grupo metila foi de 1,082 ± 0,008.
Na química orgânica , um efeito isotópico cinético ( KIE ) é a mudança na taxa de reação de uma reação química quando um dos átomos nos reagentes é substituído por um de seus isótopos . Formalmente, é a razão das constantes de taxa para as reações envolvendo os reagentes substituídos isotopicamente leves ( k L ) e pesados ( k H ) (isotopólogos):
Esta mudança na taxa de reação é um efeito da mecânica quântica que resulta principalmente de isotopólogos mais pesados com frequências vibracionais mais baixas em comparação com seus equivalentes mais leves. Na maioria dos casos, isso implica em um maior aporte energético necessário para que os isotopólogos mais pesados atinjam o estado de transição (ou, em casos raros, o limite de dissociação ) e, conseqüentemente, uma taxa de reação mais lenta. O estudo dos efeitos do isótopo cinético pode ajudar na elucidação do mecanismo de reação de certas reações químicas e é ocasionalmente explorado no desenvolvimento de drogas para melhorar a farmacocinética desfavorável , protegendo ligações CH metabolicamente vulneráveis.
Fundo
O efeito isotópico cinético é considerado uma das ferramentas mais essenciais e sensíveis para o estudo dos mecanismos de reação , cujo conhecimento permite melhorar as qualidades desejáveis das reações correspondentes. Por exemplo, efeitos de isótopos cinéticos podem ser usados para revelar se uma reação de substituição nucleofílica segue uma via unimolecular (S N 1) ou bimolecular (S N 2).
Na reação de brometo de metila e cianeto (mostrado na introdução), o efeito do isótopo cinético do carbono metílico observado indica um mecanismo S N 2. Dependendo da via, diferentes estratégias podem ser usadas para estabilizar o estado de transição da etapa de determinação da taxa da reação e melhorar a taxa e a seletividade da reação , que são importantes para aplicações industriais.
As mudanças na taxa isotópica são mais pronunciadas quando a mudança relativa da massa é maior, uma vez que o efeito está relacionado às frequências vibracionais das ligações afetadas. Por exemplo, mudar um átomo de hidrogênio (H) para seu isótopo deutério (D) representa um aumento de 100% na massa, enquanto que ao substituir o carbono -12 pelo carbono-13, a massa aumenta apenas 8%. A taxa de uma reação envolvendo uma ligação C – H é normalmente 6–10 vezes mais rápida do que a ligação C – D correspondente, enquanto uma reação 12 C é apenas 4 por cento mais rápida do que a reação 13 C correspondente (embora, em ambos os casos, o isótopo é uma unidade de massa atômica mais pesada).
A substituição isotópica pode modificar a taxa de reação de várias maneiras. Em muitos casos, a diferença de taxa pode ser racionalizada observando que a massa de um átomo afeta a frequência vibracional da ligação química que ele forma, mesmo se a superfície de energia potencial para a reação for quase idêntica. Isótopos mais pesados ( classicamente ) levarão a frequências de vibração mais baixas ou, vistos mecanicamente , terão energia de ponto zero mais baixa . Com uma energia de ponto zero mais baixa, mais energia deve ser fornecida para quebrar a ligação, resultando em uma energia de ativação mais alta para a clivagem da ligação, que por sua vez diminui a taxa medida (ver, por exemplo, a equação de Arrhenius ).
Classificação
Efeitos de isótopos cinéticos primários
Um efeito de isótopo cinético primário pode ser encontrado quando uma ligação ao átomo marcado isotopicamente está sendo formada ou quebrada. Dependendo da forma como um efeito isotópico cinético é sondado (medição paralela de taxas comparada competição intramolecular versus competição intramolecular), a observação de um efeito isotópico cinético primário é indicativo de rompimento / formação de uma ligação com o isótopo para o passo limitante da taxa , ou subsequente (s) etapa (s) de determinação do produto. (O equívoco de que um efeito de isótopo cinético primário deve refletir a clivagem / formação de ligação ao isótopo na etapa de limitação de taxa é frequentemente repetido em livros e na literatura primária: consulte a seção sobre experimentos abaixo. )
Para as reações de substituição nucleofílica mencionadas anteriormente, os efeitos do isótopo cinético primário foram investigados para ambos os grupos de saída, os nucleófilos e o carbono-α no qual ocorre a substituição. A interpretação dos efeitos do isótopo cinético do grupo de saída foi difícil no início devido às contribuições significativas de fatores independentes da temperatura. Os efeitos do isótopo cinético no carbono α podem ser usados para desenvolver algum entendimento sobre a simetria do estado de transição nas reações S N 2, embora este efeito do isótopo cinético seja menos sensível do que o ideal, também devido à contribuição de não-vibracional fatores.
Efeitos de isótopos cinéticos secundários
Um efeito de isótopo cinético secundário é observado quando nenhuma ligação ao átomo marcado isotopicamente no reagente é quebrada ou formada. Os efeitos do isótopo cinético secundário tendem a ser muito menores do que os efeitos do isótopo cinético primário; no entanto, os efeitos do isótopo de deutério secundário podem ser tão grandes quanto 1,4 por átomo de deutério, e técnicas foram desenvolvidas para medir os efeitos do isótopo de elemento pesado com uma precisão muito alta, então os efeitos do isótopo cinético secundário ainda são muito úteis para elucidar os mecanismos de reação.
Para as reações de substituição nucleofílica acima mencionadas, os efeitos do isótopo cinético do hidrogênio secundário no carbono α fornecem um meio direto para distinguir entre as reações S N 1 e S N 2. Verificou-se que as reações S N 1 normalmente levam a grandes efeitos de isótopos cinéticos secundários, aproximando-se de seu máximo teórico em cerca de 1,22, enquanto as reações S N 2 normalmente produzem efeitos de isótopos cinéticos primários que são muito próximos ou menores do que a unidade. Os efeitos do isótopo cinético maiores do que 1 são referidos como efeitos do isótopo cinético normal , enquanto os efeitos do isótopo cinético menores do que um são referidos como efeitos do isótopo cinético inverso . Em geral, espera-se que constantes de força menores no estado de transição produzam um efeito de isótopo cinético normal, e constantes de força maiores no estado de transição devem produzir um efeito de isótopo cinético inverso quando as contribuições vibracionais de alongamento dominam o efeito de isótopo cinético.
As magnitudes de tais efeitos de isótopos secundários no carbono α são amplamente determinadas pelas vibrações C α -H (D). Para uma reação S N 1, uma vez que o carbono é convertido em um íon carbênio hibridizado sp 2 durante o estado de transição para a etapa de determinação de taxa com um aumento na ordem de ligação C α -H (D), um efeito de isótopo cinético inverso seria esperado se apenas as vibrações de alongamento fossem importantes. Os grandes efeitos de isótopos cinéticos normais observados são causados por contribuições vibracionais de flexão fora do plano significativas ao passar dos reagentes para o estado de transição da formação de carbênio. Para as reações S N 2, as vibrações de flexão ainda desempenham um papel importante para o efeito do isótopo cinético, mas as contribuições vibracionais de alongamento são de magnitude mais comparável e o efeito do isótopo cinético resultante pode ser normal ou inverso, dependendo das contribuições específicas das respectivas vibrações.
Teoria
O tratamento teórico dos efeitos de isótopos depende fortemente da teoria do estado de transição , que assume uma única superfície de energia potencial para a reação e uma barreira entre os reagentes e os produtos nesta superfície, no topo da qual reside o estado de transição. O efeito do isótopo cinético surge em grande parte das mudanças nos estados básicos vibracionais produzidos pela perturbação isotópica ao longo da via de energia mínima da superfície de energia potencial, que só pode ser explicada com tratamentos mecânicos quânticos do sistema. Dependendo da massa do átomo que se move ao longo da coordenada de reação e da natureza (largura e altura) da barreira de energia, o tunelamento mecânico quântico também pode dar uma grande contribuição para um efeito de isótopo cinético observado e pode precisar ser considerado separadamente, além disso ao modelo "semi-clássico" da teoria do estado de transição.
O efeito do isótopo cinético de deutério ( 2 H KIE) é de longe o tipo mais comum, útil e bem compreendido de efeito do isótopo cinético. A previsão precisa do valor numérico de um efeito de isótopo cinético de deutério usando cálculos da teoria do funcional de densidade agora é relativamente rotineira. Além disso, vários modelos qualitativos e semiquantitativos permitem que estimativas aproximadas dos efeitos do isótopo de deutério sejam feitas sem cálculos, muitas vezes fornecendo informações suficientes para racionalizar dados experimentais ou mesmo apoiar ou refutar diferentes possibilidades mecanísticas. Os materiais de partida contendo deutério estão frequentemente disponíveis comercialmente, tornando a síntese de materiais de partida enriquecidos isotopicamente relativamente simples. Além disso, devido à grande diferença relativa na massa de deutério e prótio e às diferenças concomitantes nas frequências vibracionais, a magnitude do efeito do isótopo é maior do que qualquer outro par de isótopos, exceto prótio e trítio, permitindo que os efeitos dos isótopos primários e secundários ser facilmente medido e interpretado. Em contraste, os efeitos secundários são geralmente muito pequenos para elementos mais pesados e próximos em magnitude à incerteza experimental, o que complica sua interpretação e limita sua utilidade. No contexto dos efeitos do isótopo, o hidrogênio é frequentemente usado para se referir ao isótopo leve, o protium ( 1 H), especificamente. No restante deste artigo, a referência ao hidrogênio e ao deutério em construções gramaticais paralelas ou comparações diretas entre eles deve ser interpretada como se referindo ao prótio e ao deutério.
A teoria dos efeitos do isótopo cinético foi formulada pela primeira vez por Jacob Bigeleisen em 1949. A fórmula geral de Bigeleisen para os efeitos do isótopo cinético do deutério (que também é aplicável a elementos mais pesados) é fornecida abaixo. Emprega teoria do estado de transição e de um tratamento mecânico estatística dos níveis de translação, rotação, e vibracionais para o cálculo das constantes de velocidade k H e k D . No entanto, essa fórmula é "semiclássica", pois negligencia a contribuição do tunelamento quântico, que muitas vezes é introduzido como um fator de correção separado. A fórmula de Bigeleisen também não lida com diferenças nas interações repulsivas não ligadas causadas pela ligação C – D ligeiramente mais curta em comparação com uma ligação C – H. Na equação, as quantidades com os subscritos H ou D referem-se às espécies substituídas por hidrogênio ou deutério, respectivamente, enquanto as quantidades com ou sem a adaga dupla, ‡, referem-se ao estado de transição ou estado fundamental do reagente, respectivamente. (Estritamente falando, um termo resultante de uma diferença isotópica nos coeficientes de transmissão também deve ser incluído.)
- ,
onde nós definimos
- e .
Aqui, h é a constante de Planck , k B é a constante de Boltzmann , é a frequência da vibração, expressa em números de onda , c é a velocidade da luz , N A é a constante de Avogadro e R é a constante de gás universal . O σ X (X = H ou D) são os números de simetria para os reagentes e estados de transição. Os M X são as massas moleculares das espécies correspondentes e os termos I q X ( q = x , y ou z ) são os momentos de inércia em torno dos três eixos principais. O u i X são diretamente proporcionais às frequências vibracionais correspondentes, ν i , e à energia do ponto zero vibracional (veja abaixo). Os inteiros N e N ‡ são o número de átomos nos reagentes e os estados de transição, respectivamente. A complicada expressão dada acima pode ser representada como o produto de quatro fatores separados:
- .
Para o caso especial dos efeitos do isótopo de deutério, argumentaremos que os três primeiros termos podem ser tratados como iguais ou bem aproximados pela unidade. O primeiro fator S (contendo o σ X ) é a razão dos números de simetria para as várias espécies. Este será um número racional (uma proporção de inteiros) que depende do número de rotações moleculares e de ligação que levam à permutação de átomos ou grupos idênticos nos reagentes e no estado de transição. Para sistemas de baixa simetria, todos os σ X (reagente e estado de transição) serão unitários; assim, S muitas vezes pode ser negligenciado. O fator MMI (contendo os M X e I q X ) refere-se à relação entre as massas moleculares e os momentos de inércia. Uma vez que o hidrogênio e o deutério tendem a ser muito mais leves em comparação com a maioria dos reagentes e estados de transição, há pouca diferença nas massas moleculares e momentos de inércia entre as moléculas contendo H e D, então o fator MMI é geralmente aproximado como unidade. O fator EXC (contendo o produto das funções de partição vibracional ) corrige o efeito isotópico cinético causado pelas reações de moléculas excitadas vibracionalmente. A fração de moléculas com energia suficiente para ter vibrações de ligação de estado excitado A – H / D é geralmente pequena para reações em ou perto da temperatura ambiente (ligações ao hidrogênio geralmente vibram a 1000 cm -1 ou mais, então exp (- u i ) = exp (- hν i / k B T ) <0,01 em 298 K, resultando em contribuições desprezíveis dos fatores 1 – exp (- u i )). Assim, para efeitos de isótopos cinéticos de hidrogênio / deutério, os valores observados são tipicamente dominados pelo último fator, ZPE (uma função exponencial de diferenças de energia de ponto zero vibracional), consistindo em contribuições das diferenças de energia de ponto zero para cada um dos modos dos reagentes e estado de transição, que podem ser representados da seguinte forma:
- ,
onde nós definimos
- e .
As somas no expoente da segunda expressão podem ser interpretadas como percorrendo todos os modos vibracionais do estado fundamental do reagente e do estado de transição. Alternativamente, pode-se interpretá-los como executando aqueles modos exclusivos para o reagente ou o estado de transição ou cujas frequências vibracionais mudam substancialmente ao avançar ao longo da coordenada de reação. Os pares restantes de reagente e modos vibracionais de estado de transição têm muito semelhantes e , e os cancelamentos ocorrem quando as somas no expoente são calculadas. Assim, na prática, os KIEs de deutério são frequentemente amplamente dependentes de um punhado de modos vibracionais principais por causa desse cancelamento, tornando possíveis análises qualitativas de k H / k D.
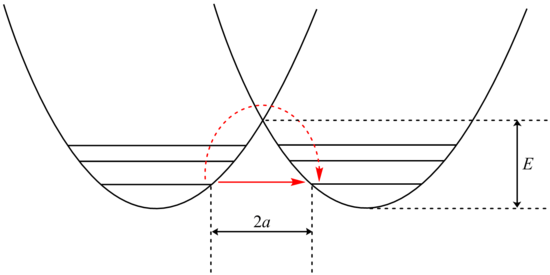
Como mencionado, especialmente para substituição de hidrogênio / deutério, a maioria dos efeitos de isótopos cinéticos surgem da diferença na energia do ponto zero (ZPE) entre os reagentes e o estado de transição dos isotopólogos em questão, e esta diferença pode ser entendida qualitativamente com a seguinte descrição : dentro da aproximação de Born-Oppenheimer , a superfície de energia potencial é a mesma para ambas as espécies isotópicas. No entanto, um tratamento mecânico quântico da energia introduz níveis vibracionais discretos nesta curva, e o estado de energia mais baixo possível de uma molécula corresponde ao nível de energia vibracional mais baixo, que é ligeiramente mais alto em energia do que o mínimo da curva de energia potencial. Essa diferença, conhecida como energia do ponto zero, é uma manifestação do princípio da incerteza de Heisenberg que exige uma incerteza no comprimento da ligação CH ou CD. Uma vez que as espécies mais pesadas (neste caso, a deuterada) se comportam mais "classicamente", seus níveis de energia vibracional estão mais próximos da curva de energia potencial clássica e tem uma energia de ponto zero mais baixa. As diferenças de energia do ponto zero entre as duas espécies isotópicas, pelo menos na maioria dos casos, diminuem no estado de transição, uma vez que a constante da força de ligação diminui durante a quebra da ligação. Portanto, a energia do ponto zero inferior da espécie deuterada se traduz em uma energia de ativação maior para sua reação, conforme mostrado na figura a seguir, levando a um efeito isotópico cinético normal. Este efeito deve, em princípio, ser levado em consideração todos os 3 N− 6 modos vibracionais para o material de partida e 3 N ‡ - 7 modos vibracionais no estado de transição (um modo, aquele correspondente à coordenada de reação, está faltando no estado de transição, uma vez que uma ligação se rompe e não há força restauradora contra o movimento). O oscilador harmônico é uma boa aproximação para uma ligação vibratória, pelo menos para estados vibracionais de baixa energia. A mecânica quântica dá a energia do ponto zero vibracional como . Assim, podemos interpretar prontamente o fator de ½ e as somas dos termos sobre os modos vibracionais do estado fundamental e do estado de transição no expoente da fórmula simplificada acima. Para um oscilador harmônico, a frequência vibracional é inversamente proporcional à raiz quadrada da massa reduzida do sistema vibratório:
- ,
onde k f é a constante de força . Além disso, a massa reduzida é aproximada pela massa do átomo leve do sistema, X = H ou D. Como m D é de aproximadamente 2 m H ,
- .
No caso de uma dissociação de ligação C – H / D homolítica, o termo do estado de transição desaparece, e negligenciando outros modos vibracionais, k H / k D = exp (½Δ u i ). Assim, um efeito isotópico maior é observado para uma ligação C – H / D mais rígida ("mais forte"). Para a maioria das reações de interesse, um átomo de hidrogênio é transferido entre dois átomos, com um estado de transição [A ··· H ··· B] ‡ e os modos vibracionais no estado de transição precisam ser levados em consideração. No entanto, ainda é geralmente verdade que a clivagem de uma ligação com uma frequência vibracional mais alta dará um efeito de isótopo maior.

Para calcular o valor máximo possível para um KIE de deutério sem tunelamento, consideramos o caso em que a diferença de energia de ponto zero entre as vibrações de alongamento de uma ligação típica de carbono-hidrogênio (3000 cm −1 ) e ligação carbono-deutério (2200 cm −1 ) desaparece no estado de transição (uma diferença de energia de (1/2) (3000 - 2200 cm −1 ) = 400 cm −1 , ou cerca de 1,15 kcal / mol), sem qualquer compensação de uma energia de ponto zero diferença no estado de transição (por exemplo, do trecho A ··· H ··· B simétrico, que é exclusivo do estado de transição). A fórmula simplificada fornecida acima prevê um máximo para k H / k D como 6,9. Se o desaparecimento completo de duas vibrações de flexão também estiver incluído, valores k H / k D tão grandes quanto 15-20 podem ser previstos. É muito improvável que as frequências de curvatura desapareçam no estado de transição, no entanto, e há apenas alguns casos em que os valores de k H / k D excedem 7 a 8 próximos à temperatura ambiente. Além disso, muitas vezes é descoberto que o tunelamento é um fator importante quando eles excedem esses valores. Um valor de k H / k D ~ 10 é considerado máximo para um efeito de isótopo cinético primário semiclássico (sem tunelamento) para reações que ocorrem em torno de 298 K. (A fórmula para k H / k D tem uma dependência da temperatura, portanto, efeitos de isótopos maiores são possíveis em temperaturas mais baixas). Dependendo da natureza do estado de transição de transferência de H (simétrico vs. "precoce" ou "tardio" e linear vs. curvado), a extensão em que um efeito de isótopo de deutério primário se aproxima desse máximo varia. Um modelo desenvolvido por Westheimer previu que estados de transição simétricos (termoneutros, pelo Postulado de Hammond ), lineares têm os maiores efeitos de isótopos, enquanto estados de transição que são "precoces" ou "tardios" (para reações exotérmicas ou endotérmicas, respectivamente), ou não lineares (por exemplo, cíclico) exibem efeitos menores. Desde então, essas previsões receberam amplo apoio experimental.
Para efeitos de isótopos de deutério secundários, Streitwieser propôs que o enfraquecimento (ou fortalecimento, no caso de um efeito de isótopo inverso) dos modos de flexão do estado fundamental do reagente para o estado de transição são em grande parte responsáveis pelos efeitos isotópicos observados. Essas mudanças são atribuídas a uma mudança no ambiente estérico quando o carbono ligado ao H / D passa por re-hibridização de sp 3 para sp 2 ou vice-versa (um efeito de isótopo cinético secundário α), ou enfraquecimento da ligação devido à hiperconjugação nos casos em que um carbocátion está sendo gerado a um átomo de carbono de distância (um efeito de isótopo cinético secundário β). Esses efeitos isotópicos têm um máximo teórico de k H / k D = 2 0,5 ≈ 1,4. Para um efeito de isótopo cinético secundário na posição α, a re-hibridização de sp 3 para sp 2 produz um efeito de isótopo normal, enquanto a re-hibridização de sp 2 para sp 3 resulta em um efeito de isótopo inverso com um mínimo teórico de k H / k D = 2 -0,5 ≈ 0,7. Na prática, k H / k D ~ 1,1-1,2 e k H / k D ~ 0,8-0,9 são típicos para efeitos do isótopo cinético secundário α, enquanto k H / k D ~ 1,15-1,3 são típicos para efeito do isótopo cinético secundário β. Para reagentes contendo vários átomos de hidrogênio β isotopicamente substituídos, o efeito isotópico observado é frequentemente o resultado de vários H / Ds na posição β agindo em conjunto. Nestes casos, o efeito de cada átomo marcado isotopicamente é multiplicativo, e casos em que k H / k D > 2 não são incomuns.
As seguintes expressões simples relacionadas aos efeitos do isótopo cinético de deutério e trítio, que também são conhecidas como a equação de Swain (ou as equações de Swain-Schaad-Stivers), podem ser derivadas da expressão geral fornecida acima usando algumas simplificações:
- ;
ou seja,
- .
Ao derivar essas expressões, foi usada a aproximação razoável de que as massas reduzidas são aproximadamente iguais às massas do hidrogênio, deutério ou trítio. Além disso, o movimento vibracional foi assumido como aproximado por um oscilador harmônico, de modo que (X = H, D ou T). O subscrito " s " refere-se a esses efeitos de isótopos cinéticos "semi-clássicos", que desconsideram o tunelamento quântico. As contribuições de tunelamento devem ser tratadas separadamente como um fator de correção.
Para efeitos de isótopos envolvendo outros elementos além do hidrogênio, muitas dessas simplificações não são válidas, e a magnitude do efeito do isótopo pode depender fortemente de alguns ou de todos os fatores negligenciados. Assim, os efeitos do isótopo cinético para outros elementos além do hidrogênio são frequentemente muito mais difíceis de racionalizar ou interpretar. Em muitos casos e especialmente para reações de transferência de hidrogênio, as contribuições para os efeitos do isótopo cinético do tunelamento são significativas (veja abaixo).
Tunelamento
Em alguns casos, um aumento de taxa adicional é visto para o isótopo mais leve, possivelmente devido ao tunelamento mecânico quântico . Isso é tipicamente observado apenas para reações envolvendo ligações a átomos de hidrogênio. O tunelamento ocorre quando uma molécula penetra através de uma barreira de energia potencial, em vez de sobre ela. Embora não seja permitido pelas leis da mecânica clássica , as partículas podem passar por regiões classicamente proibidas do espaço na mecânica quântica com base na dualidade onda-partícula .
A análise do tunelamento pode ser feita usando a modificação de Bell da equação de Arrhenius , que inclui a adição de um fator de tunelamento, Q:
onde A é o parâmetro Arrhenius, E é a altura da barreira e
onde e
O exame do termo β mostra dependência exponencial da massa da partícula. Como resultado, o tunelamento é muito mais provável para uma partícula mais leve como o hidrogênio. Simplesmente dobrar a massa de um próton de tunelamento, substituindo-o por seu isótopo de deutério, reduz drasticamente a taxa de tais reações. Como resultado, efeitos de isótopos cinéticos muito grandes são observados que não podem ser explicados por diferenças nas energias do ponto zero.
Além disso, o termo β depende linearmente com a largura da barreira, 2a. Tal como acontece com a massa, o tunelamento é maior para barreiras de largura pequena. A distância ideal de tunelamento de prótons entre o átomo doador e o átomo aceitador é de 0,4 Å.
O tunelamento é um efeito da mecânica quântica ligado às leis da mecânica ondulatória, não à cinética . Portanto, o tunelamento tende a se tornar mais importante em baixas temperaturas, onde mesmo as menores barreiras de energia cinética podem não ser superadas, mas podem ser atravessadas.
Peter S. Zuev et al. relataram constantes de taxa para a expansão do anel de 1-metilciclobutilfluorocarbeno ser 4,0 x 10 -6 / s em nitrogênio e 4,0 x 10-5 / s em argônio a 8 kelvin. Eles calcularam que a 8 kelvin, a reação ocorreria por meio de um único estado quântico do reagente, de modo que a constante de taxa relatada seja independente da temperatura e a contribuição de tunelamento para a taxa fosse 152 ordens de magnitude maior do que a contribuição de passagem sobre o estado de transição barreira de energia.
Portanto, apesar do fato de que as reações químicas convencionais tendem a diminuir drasticamente à medida que a temperatura diminui, as reações de tunelamento raramente mudam. As partículas que túneis através de uma barreira de ativação são um resultado direto do fato de que a função de onda de uma espécie intermediária, reagente ou produto não está confinada ao poço de energia de uma calha particular ao longo da superfície de energia de uma reação, mas pode "vazar" para o próximo mínimo de energia. À luz disso, o tunelamento deve ser independente da temperatura.
Para a captação de hidrogénio a partir de n-alcanos gasosos e cicloalcanos por átomos de hidrogénio sobre o intervalo de temperatura 363-463 K, H / D cinética isótopo dados de efeito foram caracterizados por pequenas de factor preexponential rácios A H / A D variando 0,43-0,54 e grande diferenças de energia de ativação de 9,0 a 9,7 kJ / mol. Baseando seus argumentos na teoria do estado de transição , as pequenas razões do fator A associadas às grandes diferenças de energia de ativação (geralmente cerca de 4,5 kJ / mol para ligações C – H (D)) forneceram fortes evidências de tunelamento. Para o propósito desta discussão, é importante que a razão do fator A para as várias parafinas que eles usaram fosse aproximadamente constante em toda a faixa de temperatura.
A observação de que o tunelamento não é totalmente independente da temperatura pode ser explicada pelo fato de que nem todas as moléculas de uma determinada espécie ocupam seu estado vibracional fundamental em temperaturas variáveis. Adicionar energia térmica a um poço de energia potencial pode fazer com que níveis vibracionais mais elevados, além do estado fundamental, se tornem povoados. Para uma reação convencional conduzida cineticamente, essa excitação teria apenas uma pequena influência na taxa. No entanto, para uma reação de tunelamento, a diferença entre a energia do ponto zero e o primeiro nível de energia vibracional pode ser enorme. O termo de correção de tunelamento Q é linearmente dependente da largura da barreira e essa largura é significativamente diminuída à medida que o número de modos vibracionais no potencial de Morse aumenta. A diminuição da largura da barreira pode ter um impacto tão grande na taxa de tunelamento que mesmo uma pequena população de estados vibracionais excitados dominaria este processo.Para determinar se o tunelamento está envolvido no KIE de uma reação com H ou D, alguns critérios são considerados:
- Δ ( E a H - E a D )> Δ ( ZPE H - ZPE D ) ( E a = energia de ativação; ZPE = energia do ponto zero)
- A reação ainda ocorre em temperaturas mais baixas.
- Os fatores pré-exponenciais de Arrhenius A D / A H não são iguais a 1.
- Uma grande entropia negativa de ativação.
- As geometrias dos reagentes e produtos são geralmente muito semelhantes.
Também para reações onde os isótopos incluem H, D e T, um critério de tunelamento são as relações Swain-Schaad que comparam as constantes de taxa ( k ) das reações onde H, D ou T são trocados:
- k H / k T = ( k D / k T ) X e k H / k T = ( k H / k D ) Y
Em reações orgânicas, este efeito de tunelamento de prótons foi observado em reações como a desprotonação e iodação de nitropropano com base de piridina impedida com um KIE relatado de 25 a 25 ° C:
e em um deslocamento de hidrogênio 1,5-sigmatrópico, embora seja observado que é difícil extrapolar os valores experimentais obtidos em temperaturas elevadas para temperaturas mais baixas:
Há muito se especula que a alta eficiência da catálise enzimática em reações de transferência de íons de prótons ou hidretos pode ser parcialmente devido ao efeito de tunelamento da mecânica quântica. O ambiente no sítio ativo de uma enzima posiciona o átomo doador e aceitador próximo à distância ideal de tunelamento, onde as cadeias laterais de aminoácidos podem "forçar" o átomo doador e o aceitador mais próximos por interações eletrostáticas e não covalentes. Também é possível que a enzima e seu ambiente hidrofóbico incomum dentro de um local de reação forneçam vibração promotora de tunelamento. Estudos sobre a cetosteróide isomerase forneceram evidências experimentais de que a enzima realmente aumenta o movimento acoplado / tunelamento de hidrogênio, comparando os efeitos dos isótopos cinéticos primários e secundários da reação em condições catalisadas por enzimas e não catalisadas por enzimas.
Existem muitos exemplos de tunelamento de prótons em reações catalisadas por enzimas que foram descobertas pelo KIE. Um exemplo bem estudado é a metilamina desidrogenase, onde grandes KIEs primários de 5–55 foram observados para a etapa de transferência de prótons.

Outro exemplo de contribuição do tunelamento para a transferência de prótons em reações enzimáticas é a reação realizada pela álcool desidrogenase . KIEs competitivos para a etapa de transferência de hidrogênio a 25 ° C resultaram em 3,6 e 10,2 para KIEs primários e secundários, respectivamente.
Efeito de isótopo cinético transitório
O efeito isotópico expresso com as equações fornecidas acima refere-se apenas a reações que podem ser descritas com cinética de primeira ordem . Em todos os casos em que isso não seja possível, os efeitos do isótopo cinético transiente devem ser levados em consideração usando as equações GEBIK e GEBIF.
Experimentos
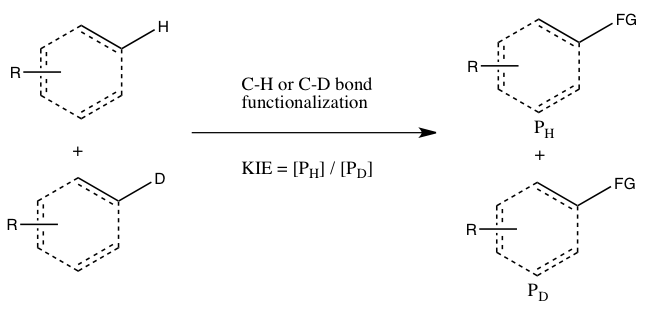
Simmons e Hartwig referem-se aos três casos a seguir como os principais tipos de experimentos de efeito de isótopo cinético envolvendo funcionalização de ligações CH:
- A) KIE determinado a partir de taxas absolutas de duas reações paralelas
Neste experimento, as constantes de taxa para o substrato normal e seu análogo marcado isotopicamente são determinados independentemente, e o KIE é obtido como uma proporção dos dois. A precisão do KIE medido é severamente limitada pela precisão com a qual cada uma dessas constantes de taxa pode ser medida. Além disso, reproduzir as condições exatas nas duas reações paralelas pode ser muito desafiador. No entanto, uma medição de um grande efeito de isótopo cinético por meio da comparação direta de constantes de taxa é indicativo de que a clivagem da ligação CH ocorre na etapa de determinação da taxa. (Um valor menor pode indicar um efeito de isótopo devido a um pré-equilíbrio, de modo que a clivagem da ligação CH ocorre em algum lugar antes da etapa de determinação da taxa.)
- B) KIE determinado a partir de uma competição intermolecular
Neste tipo de experimento, os mesmos substratos que são usados no Experimento A são empregados, mas eles podem reagir no mesmo recipiente, em vez de dois recipientes separados. O efeito do isótopo cinético desta experiência é determinado pela quantidade relativa de produtos formados a partir da funcionalização CH versus CD (ou pode ser inferido a partir das quantidades relativas de materiais de partida que não reagiram). É necessário extinguir a reação antes de sua conclusão para observar o efeito do isótopo cinético (consulte a seção Avaliação abaixo). Geralmente, a reação é interrompida em baixa conversão (~ 5 a 10% de conversão) ou um grande excesso (> 5 equiv.) Da mistura isotópica é usado. Este tipo de experimento garante que as funcionalizações de ligações CH e CD ocorram exatamente sob as mesmas condições, e a proporção dos produtos das funcionalizações de ligações CH e CD pode ser medida com muito maior precisão do que as constantes de taxa no Experimento A. Além disso, apenas uma única medição de concentração de produto de uma única amostra. No entanto, um efeito de isótopo cinético observado a partir desta experiência é mais difícil de interpretar, uma vez que pode significar que a clivagem da ligação CH ocorre durante a etapa de determinação da taxa ou em uma etapa de determinação do produto que se segue à etapa de determinação da taxa. A ausência de um efeito de isótopo cinético, pelo menos de acordo com Simmons e Hartwig, é, no entanto, indicativa de que a clivagem da ligação CH não ocorre durante a etapa de determinação da taxa.
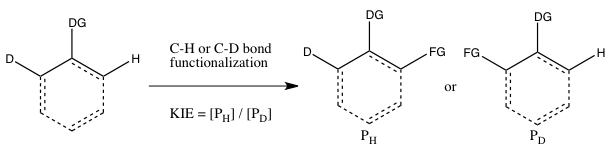
- C) KIE determinado a partir de uma competição intramolecular
Este tipo de experimento é análogo ao Experimento B, exceto que desta vez há uma competição intramolecular pela funcionalização da ligação CH ou CD. Na maioria dos casos, o substrato possui um grupo direcionador (DG) entre as ligações CH e CD. O cálculo do efeito do isótopo cinético deste experimento e sua interpretação seguem as mesmas considerações do Experimento B. No entanto, os resultados dos Experimentos B e C serão diferentes se a ligação irreversível do substrato contendo o isótopo ocorrer no Experimento B antes de a clivagem da ligação CH ou CD. Em tal cenário, um efeito de isótopo pode ser observado no Experimento C (onde a escolha do isótopo pode ocorrer mesmo após a ligação do substrato), mas não no Experimento B (uma vez que a escolha de se a ligação CH ou CD cliva já é feita assim que o substrato liga-se irreversivelmente). Em contraste com o Experimento B, a reação não precisa ser interrompida com baixo consumo de material de partida isotópico para obter um k H / k D preciso , uma vez que a razão de H e D no material de partida é 1: 1, independentemente do extensão da conversão.
Um exemplo de não ativação de CH de efeitos isotópicos diferentes sendo observados no caso de competição intermolecular (Experiência B) e intramolecular (Experiência C) é a fotólise de difenildiazometano na presença de t- butilamina. Para explicar esse resultado, foi proposta a formação de difenilcarbeno, seguida de ataque nucleofílico irreversível pela t- butilamina. Como há pouca diferença isotópica na taxa de ataque nucleofílico, o experimento intermolecular resultou em um KIE próximo a 1. No caso intramolecular, no entanto, a razão do produto é determinada pela transferência de prótons que ocorre após o ataque nucleofílico, um processo para que existe um KIE substancial de 2.6.
Assim, os experimentos A, B e C fornecerão resultados de diferentes níveis de precisão e requerem diferentes configurações experimentais e formas de análise de dados. Como resultado, a viabilidade de cada tipo de experimento dependerá do perfil cinético e estequiométrico da reação, bem como das características físicas da mistura de reação (por exemplo, homogêneo vs. heterogêneo). Além disso, como observado no parágrafo acima, os experimentos fornecem dados de efeito de isótopo cinético para diferentes etapas de uma reação de múltiplas etapas, dependendo das localizações relativas da etapa de limitação de taxa, etapas de determinação de produto e / ou clivagem de CH / D Passo.
Os exemplos hipotéticos abaixo ilustram cenários comuns. Considere o seguinte diagrama de coordenadas de reação. Para uma reação com este perfil, todos os três experimentos (A, B e C) produzirão um efeito de isótopo cinético primário significativo:
Por outro lado, se uma reação segue o seguinte perfil de energia, no qual a clivagem da ligação CH ou CD é irreversível, mas ocorre após a etapa de determinação da taxa (RDS), nenhum efeito de isótopo cinético significativo será observado com o Experimento A, uma vez que o a taxa geral não é afetada pela substituição isotópica. No entanto, a etapa de clivagem da ligação CH irreversível dará um efeito de isótopo cinético primário com os outros dois experimentos, uma vez que a segunda etapa ainda afetaria a distribuição do produto. Portanto, com as Experiências B e C, é possível observar o efeito do isótopo cinético mesmo se a clivagem da ligação CH ou CD ocorrer não na etapa de determinação da taxa, mas na etapa de determinação do produto.
Uma grande parte do efeito do isótopo cinético surge das diferenças de energia do ponto zero vibracional entre o estado fundamental do reagente e o estado de transição que variam entre o reagente e seu análogo isotopicamente substituído. Embora seja possível realizar cálculos envolvidos de efeitos de isótopos cinéticos usando química computacional, muito do trabalho realizado é de ordem mais simples que envolve a investigação de se substituições isotópicas particulares produzem um efeito de isótopo cinético detectável ou não. Mudanças vibracionais de substituição isotópica em átomos distantes do local onde a reação ocorre tendem a se cancelar entre o reagente e o estado de transição. Portanto, a presença de um efeito de isótopo cinético indica que o átomo marcado isotopicamente está no local da reação ou muito próximo dele.
A ausência de um efeito isotópico é mais difícil de interpretar: pode significar que o átomo marcado isotopicamente está longe do local da reação, mas também pode significar que existem certos efeitos compensatórios que levam à falta de um efeito isotópico cinético observável. Por exemplo, as diferenças entre o reagente e as energias de ponto zero do estado de transição podem ser idênticas entre o reagente normal e sua versão marcada isotopicamente. Alternativamente, pode significar que a substituição isotópica está no local da reação, mas as mudanças vibracionais associadas às ligações a este átomo ocorrem após a etapa de determinação da taxa. Tal caso é ilustrado no exemplo a seguir, no qual ABCD representa o esqueleto atômico de uma molécula.
Assumindo condições de estado estacionário para o ABC intermediário, a taxa geral de reação é a seguinte:
Se a primeira etapa é determinante da taxa, esta equação se reduz a:
Ou se a segunda etapa é determinante da taxa, a equação se reduz a:
Na maioria dos casos, a substituição isotópica em A, especialmente se for um átomo pesado, não alterará k 1 ou k 2 , mas muito provavelmente alterará k 3 . Portanto, se a primeira etapa for determinante da taxa, não haverá um efeito de isótopo cinético observável na reação geral com marcação isotópica de A, mas haverá um se a segunda etapa for determinante da taxa. Para casos intermediários onde ambas as etapas têm taxas comparáveis, a magnitude do efeito do isótopo cinético dependerá da razão de k 3 e k 2 .
A substituição isotópica de D alterará k 1 e k 2, mas não afetará k 3 . O efeito do isótopo cinético sempre será observável com esta substituição, uma vez que k 1 aparece na expressão da taxa simplificada, independentemente de qual etapa é determinante da taxa, mas será menos pronunciado se a segunda etapa for determinante da taxa devido a algum cancelamento entre o isótopo efeitos em k 1 e k 2 . Esse resultado está relacionado ao fato de que os efeitos do isótopo de equilíbrio são geralmente menores do que os efeitos do isótopo cinético.
A substituição isotópica de B irá alterar claramente k 3 , mas também pode alterar k 1 em menor extensão se as vibrações da ligação BC forem afetadas no estado de transição da primeira etapa. Portanto, pode haver um pequeno efeito de isótopo, mesmo se a primeira etapa for determinante da taxa.
Esta consideração hipotética revela como a observação dos efeitos do isótopo cinético pode ser usada para investigar os mecanismos de reação. A existência de um efeito de isótopo cinético é indicativa de uma mudança na constante de força vibracional de uma ligação associada ao átomo marcado isotopicamente na etapa de controle de taxa ou antes dela. Cálculos intrincados podem ser usados para aprender uma grande quantidade de detalhes sobre o estado de transição dos efeitos de isótopos cinéticos observados. Mais comumente, no entanto, o mero conhecimento qualitativo de que uma ligação associada ao átomo marcado isotopicamente é alterada de uma certa maneira pode ser muito útil.Avaliação das razões de constante de taxa de reações de competição intermoleculares
Em reações de competição, o efeito do isótopo cinético é calculado a partir do produto isotópico ou das razões de reagentes remanescentes após a reação, mas essas razões dependem fortemente da extensão da conclusão da reação. Mais comumente, o substrato isotópico consistirá em moléculas marcadas em uma posição específica e suas contrapartes comuns não marcadas. Também é possível no caso de efeitos do isótopo cinético 13 C, bem como em casos semelhantes, simplesmente contar com a abundância natural do carbono isotópico para os experimentos do efeito do isótopo cinético, eliminando a necessidade de marcação isotópica. Os dois substratos isotópicos irão reagir pelo mesmo mecanismo, mas em taxas diferentes. A razão entre as quantidades das duas espécies nos reagentes e nos produtos, portanto, mudará gradualmente ao longo da reação, e essa mudança gradual pode ser tratada da seguinte maneira: Suponha que duas moléculas isotópicas, A 1 e A 2 , sofrer reações irreversíveis de competição da seguinte maneira:
O efeito do isótopo cinético para este cenário é considerado:
Onde F 1 e F 2 se referem à fração de conversões para as espécies isotópicas A 1 e A 2 , respectivamente.
Neste tratamento, todos os outros reagentes são considerados não isotópicos. Assumindo ainda que a reação é de primeira ordem em relação ao substrato isotópico A, a seguinte expressão geral de taxa para ambas as reações pode ser escrita:
Uma vez que f ([B], [C], ...) não depende da composição isotópica de A, pode ser resolvido em ambas as expressões de taxa com A 1 e A 2 , e os dois podem ser equacionados para derivar as seguintes relações :
Onde [A 1 ] 0 e [A 2 ] 0 são as concentrações iniciais de A 1 e A 2 , respectivamente. Isso leva à seguinte expressão de efeito de isótopo cinético:
Que também pode ser expresso em termos de quantidades de fração de conversão das duas reações, F 1 e F 2 , onde 1-F n = [A n ] / [A n ] 0 para n = 1 ou 2, como segue:
Quanto à obtenção dos efeitos isotópicos cinéticos, misturas de substratos contendo isótopos estáveis podem ser analisadas usando um espectrômetro de massa, que produz as razões das moléculas isotópicas no substrato inicial (definido aqui como [A 2 ] 0 / [A 1 ] 0 = R 0 ), no substrato após alguma conversão ([A 2 ] / [A 1 ] = R), ou no produto ([P 2 ] / [P 1 ] = R P ). Quando uma das espécies, por exemplo, 2, é um isótopo radioativo, sua mistura com as outras espécies também pode ser analisada por sua radioatividade, que é medida em atividades molares que são proporcionais a [A 2 ] 0 / ([A 1 ] 0 + [A 2 ] 0 ) ≈ [A 2 ] 0 / [A 1 ] 0 = R 0 no substrato inicial, [A 2 ] / ([A 1 ] + [A 2 ]) ≈ [A 2 ] / [ A 1 ] = R no substrato após alguma conversão, e [R 2 ] / ([R 1 ] + [R 2 ]) ≈ [R 2 ] / [R 1 ] = R P , de modo que as mesmas razões que em o outro caso pode ser medido desde que o isótopo radioativo esteja presente em quantidades traçadoras. Essas razões também podem ser determinadas usando espectroscopia de NMR.
Quando a composição do substrato é seguida, a seguinte expressão de efeito de isótopo cinético em termos de R 0 e R pode ser derivada:
Tomando a razão de R e R 0 usando a expressão anteriormente derivada para F 2 , obtém-se:
O enriquecimento isotópico do material de partida pode ser calculado a partir da dependência de R / R 0 em F 1 para vários efeitos de isótopos cinéticos, resultando na figura a seguir. Por causa da dependência exponencial, mesmo efeitos de isótopos cinéticos muito baixos levam a grandes mudanças na composição isotópica do material de partida em conversões altas.
Quando os produtos são seguidos, o efeito do isótopo cinético pode ser calculado usando a razão de produtos R P juntamente com R 0 da seguinte forma:
Medição do efeito do isótopo cinético em abundância natural
A medição do efeito do isótopo cinético em abundância natural é um método geral simples para medir os efeitos do isótopo cinético (KIE) para reações químicas realizadas com materiais de abundância natural . Esta técnica para medir KIEs supera muitas limitações dos métodos de medição KIE anteriores. As medições KIE de materiais marcados isotopicamente requerem uma nova síntese para cada material marcado isotopicamente (um processo muitas vezes proibitivamente difícil), uma reação de competição e uma análise. A medição KIE em abundância natural evita esses problemas, aproveitando as vantagens de técnicas quantitativas de alta precisão ( espectroscopia de ressonância magnética nuclear , espectrometria de massa de razão de isótopos ) para medir seletivamente o fracionamento cinético de isótopos , em produto ou material inicial para uma determinada reação química .
NMR de pulso único
A espectroscopia quantitativa de ressonância magnética nuclear de pulso único (NMR) é um método adequado para medir o fracionamento cinético de isótopos para medições KIE de abundância natural. Pascal et al. foram inspirados por estudos que demonstram variações dramáticas de deutério dentro de compostos idênticos de fontes diferentes e levantaram a hipótese de que o NMR poderia ser usado para medir os efeitos do isótopo cinético de deutério em abundância natural. Pascal e seus colegas testaram sua hipótese estudando a reação de inserção do diazomalonato de dimetila no ciclohexano . Pascal et al. mediu um KIE de 2,2 usando2
H
NMR para materiais de abundância natural.
Singleton e colegas de trabalho demonstraram a capacidade de 13
C
Medições KIE de abundância natural baseadas em RMN para estudar o mecanismo da cicloadição [4 + 2] de isopreno com anidrido maleico . Estudos anteriores de Gajewski em materiais enriquecidos isotopicamente observaram resultados de KIE que sugeriam um estado de transição assíncrono, mas eram sempre consistentes, dentro do erro, para um mecanismo de reação perfeitamente síncrono .
Este trabalho de Singleton et al. estabeleceu a medição de múltiplos13
C
O KIE está dentro do projeto de um único experimento. Esses2
H
e 13
C
As medições KIE determinadas em abundância natural encontraram os hidrogênios "internos" do dieno com uma experiência mais pronunciada 2
H
KIE do que os hidrogênios “externos” e o C1 e C4 experimentam um KIE significativo. Essas observações-chave sugerem um mecanismo de reação assíncrona para a cicloadição de isopreno com anidrido maleico .
As limitações para determinar KIEs em abundância natural usando NMR são que o material recuperado deve ter uma quantidade e pureza adequadas para análise de NMR (o sinal de interesse deve ser distinto de outros sinais), a reação de interesse deve ser irreversível e o mecanismo de reação não deve mudar durante a reação química .
Detalhes experimentais para o uso de NMR de pulso único quantitativo para medir o efeito do isótopo cinético em abundância natural da seguinte forma: o experimento precisa ser realizado em condições quantitativas, incluindo um tempo de relaxamento de 5 T 1, ângulo de rotação medido de 90 °, uma resolução digital de pelo menos 5 pontos em um pico e um sinal: ruído maior que 250. O FID bruto é preenchido com zero a pelo menos 256K pontos antes da transformação de Fourier. Os espectros de NMR são faseados e, em seguida, tratados com uma correção de linha de base de ordem zero sem qualquer correção de inclinação. As integrações de sinais são determinadas numericamente com uma tolerância mínima para cada sinal integrado.
Exemplos de elucidação de mecanismo de reação organometálica
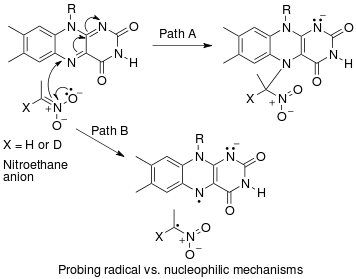
Colletto et al. desenvolveram uma -arilação regiosseletiva de benzo [b] tiofenos à temperatura ambiente com iodetos de arila como parceiros de acoplamento e procuraram entender o mecanismo dessa reação realizando medições de efeito de isótopo cinético de abundância natural por meio de RMN de pulso único.
A observação de um efeito do isótopo 13 C primário em C3, um efeito do isótopo 2 H inverso , um efeito do isótopo 13 C secundário em C2 e a falta de um efeito do isótopo 2 H em C2 leva Colletto et al. sugerir um mecanismo de reação do tipo Heck para a -arilação regiosseletiva de benzo [b] tiofenos à temperatura ambiente com iodetos de arila como parceiros de acoplamento.
Frost et al. buscou entender os efeitos dos aditivos de ácido de Lewis no mecanismo de ativação enantiosseletiva da ligação CN catalisada por paládio usando medições do efeito do isótopo cinético de abundância natural via NMR de pulso único.
O efeito do isótopo cinético 13 C primário observado na ausência de BPh 3 sugere um mecanismo de reação com taxa de oxidação cis limitante na ligação C-CN da cianoformamida . A adição de BPh 3 causa uma diminuição relativa no efeito do isótopo cinético 13 C observado, o que levou Frost et al. para sugerir uma mudança na etapa de limitação de taxa de oxidação cis para coordenação de paládio à cianoformamida.
DEPT-55 NMR
Embora as medições do efeito do isótopo cinético em abundância natural sejam uma ferramenta poderosa para compreender os mecanismos de reação, as quantidades de material necessárias para a análise podem tornar esta técnica inacessível para reações que empregam reagentes caros ou materiais de partida instáveis. A fim de mitigar essas limitações, Jacobsen e colaboradores desenvolveram a transferência de polarização de 1 H para 13 C como um meio de reduzir o tempo e o material necessários para medições de efeito de isótopo cinético em abundância natural. O aprimoramento sem distorção por transferência de polarização (DEPT) aproveita a maior razão giromagnética de 1 H sobre 13 C para melhorar teoricamente a sensibilidade de medição por um fator de 4 ou diminuir o tempo de experimento por um fator de 16. Este método para medição de isótopo cinético de abundância natural é favorável para análise de reações contendo materiais de partida instáveis e catalisadores ou produtos que são relativamente caros.
Jacobsen e colaboradores identificaram a glicosilação catalisada por tiouréia da galactose como uma reação que atendia a ambos os critérios mencionados (materiais caros e substratos instáveis) e era uma reação com um mecanismo mal compreendido. A glicosilação é um caso especial de substituição nucleofílica que carece de uma definição clara entre o caráter mecanístico S N 1 e S N 2. A presença de oxigênio adjacente ao local de deslocamento (isto é, C1) pode estabilizar a carga positiva. Esta estabilização de carga pode fazer com que qualquer via combinada potencial se torne assíncrona e se aproxima de intermediários com caráter de oxocarbênio do mecanismo S N 1 para glicosilação.
Jacobsen e colaboradores observaram pequenos KIEs normais em C1, C2 e C5, o que sugere um caráter significativo de oxocarbênio no estado de transição e um mecanismo de reação assíncrona com um grande grau de separação de carga.
Espectrometria de massa de razão isotópica
Espectrometria de massa de razão de isótopos de alta precisão (IRMS) é outro método para medir o fracionamento cinético de isótopos para medições KIE de abundância natural. Widlanski e colegas de trabalho demonstraram34
S
KIE em medições de abundância natural para a hidrólise de monoésteres de sulfato . Sua observação de um grande KIE sugere que a clivagem da ligação SO é o controle da taxa e provavelmente descarta um mecanismo de reação associado .
A principal limitação para determinar KIEs em abundância natural usando IRMS é a degradação seletiva do local necessária sem fracionamento isotópico em uma pequena molécula analisável, uma tarefa não trivial.
Estudos de caso
Efeitos de isótopos de hidrogênio primários
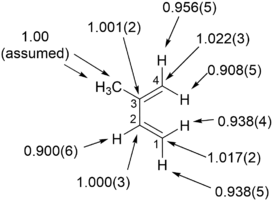
Os efeitos do isótopo cinético do hidrogênio primário referem-se a casos em que uma ligação ao hidrogênio marcado isotopicamente é formada ou quebrada em uma taxa e / ou etapa de determinação do produto de uma reação. Esses são os efeitos de isótopos cinéticos mais comumente medidos, e grande parte da teoria abordada anteriormente se refere aos efeitos de isótopos cinéticos primários. Quando há evidência adequada de que a transferência do hidrogênio marcado ocorre na etapa de determinação da taxa de uma reação, se um efeito de isótopo cinético bastante grande for observado, por exemplo, kH / kD de pelo menos 5-6 ou kH / kT cerca de 10-13 à temperatura ambiente, é bem provável que a transferência de hidrogênio seja linear e que o hidrogênio esteja bastante simetricamente localizado no estado de transição. Normalmente não é possível fazer comentários sobre as contribuições do tunelamento para o efeito do isótopo observado, a menos que o efeito seja muito grande. Se o efeito do isótopo cinético primário não for tão grande, geralmente é considerado um indicativo de uma contribuição significativa do movimento do átomo pesado para a coordenada da reação, embora também possa significar que a transferência de hidrogênio segue uma via não linear.
Efeitos do isótopo de hidrogênio secundário
Os efeitos de isótopos de hidrogênio secundários ou efeito de isótopos cinéticos secundários (SKIE) surgem nos casos em que a substituição isotópica está distante da ligação sendo quebrada. O átomo remoto, no entanto, influencia as vibrações internas do sistema que, por meio de mudanças na energia do ponto zero (ZPE), afetam as taxas de reações químicas. Tais efeitos são expressos como razões de taxa para o isótopo leve para aquele do isótopo pesado e podem ser efeitos "normais" (a razão é maior ou igual a 1) ou "inversos" (a razão é menor que 1). SKIE são definidos como efeitos de isótopos secundários α, β (etc.) onde tais prefixos se referem à posição da substituição isotópica em relação ao centro de reação (ver carbono alfa e beta ). O prefixo α se refere ao isótopo associado ao centro de reação, enquanto o prefixo β se refere ao isótopo associado a um átomo vizinho ao centro de reação e assim por diante.
Na físico-química orgânica, o SKIE é discutido em termos de efeitos eletrônicos , como indução, hibridização de ligações ou hiperconjugação . Essas propriedades são determinadas pela distribuição de elétrons e dependem da média vibracional do comprimento da ligação e dos ângulos que não são muito afetados pela substituição isotópica. Assim, o uso do termo "efeito isotópico eletrônico", embora legítimo, é desencorajado, pois pode ser mal interpretado para sugerir que o efeito isotópico é de natureza eletrônica e não vibracional.
SKIE's podem ser explicados em termos de mudanças na hibridização orbital. Quando a hibridização de um átomo de carbono muda de sp 3 para sp 2 , vários modos vibracionais (alongamentos, flexão no plano e fora do plano) são afetados. A curvatura no plano e fora do plano em um carbono hibridizado sp 3 são semelhantes em frequência devido à simetria de um carbono hibridizado sp 3 . Em um carbono hibridizado sp 2, a dobra no plano é muito mais rígida do que a dobra fora do plano, resultando em uma grande diferença na frequência, o ZPE e, portanto, o SKIE (que existe quando há uma diferença no ZPE do reagente e estado de transição). A mudança máxima teórica causada pela diferença de frequência de flexão foi calculada como 1,4.
Quando o carbono sofre uma reação que muda sua hibridização de sp 3 para sp 2 , a constante de força de flexão fora do plano no estado de transição é mais fraca, pois está desenvolvendo o caráter de sp 2 e um SKIE "normal" é observado com valores típicos de 1,1 a 1.2. Por outro lado, quando a hibridização do carbono muda de sp 2 para sp 3 , as constantes de força de flexão fora do plano no estado de transição aumentam e um SKIE inverso é observado com valores típicos de 0,8 a 0,9.
Mais geralmente, o SKIE para reações reversíveis pode ser "normal" de uma maneira e "inversa" de outra se a ligação no estado de transição estiver no meio da rigidez entre o substrato e o produto, ou eles podem ser "normais" em ambas as formas se a ligação for mais fraca no estado de transição, ou "inverso" de ambas as maneiras se a ligação for mais forte no estado de transição do que em qualquer um dos reagentes.
Um exemplo de um efeito de isótopo cinético secundário α "inverso" pode ser visto no trabalho de Fitzpatrick e Kurtz que usaram tal efeito para distinguir entre duas vias propostas para a reação de d-aminoácido oxidase com ânions nitroalcano . O caminho A envolveu um ataque nucleofílico à coenzima FAD , enquanto o caminho B envolve um intermediário de radical livre. Como o caminho A resulta na hibridização de mudança de carbono intermediária de sp 2 para sp 3, um SKIE "inverso" é esperado. Se o caminho B ocorrer, então nenhum SKIE deve ser observado, pois o radical livre intermediário não altera a hibridização. Um SKIE de 0,84 foi observado e o Caminho A verificado conforme mostrado no esquema abaixo.
Outro exemplo de SKIE é a oxidação de álcoois benzílicos por dimetildioxirano, onde três estados de transição para diferentes mecanismos foram propostos. Novamente, ao considerar como e se os átomos de hidrogênio estavam envolvidos em cada um, os pesquisadores previram se esperariam ou não um efeito de substituição isotópica deles. Então, a análise dos dados experimentais para a reação permitiu que eles escolhessem qual caminho era mais provável com base no efeito do isótopo observado.
Efeitos de isótopos de hidrogênio secundários dos hidrogênios de metileno também foram usados para mostrar que o rearranjo de Cope em 1,5-hexadieno segue uma via de rearranjo de ligação concertada, e não uma das vias alternativas propostas de radical alil ou 1,4-diil, todas as quais são apresentado no esquema a seguir.
Mecanismos alternativos para o rearranjo Cope de 1,5-hexadieno: (de cima para baixo), radical alil, vias sincronizadas sincronizadas e 1,4-dyil. A via predominante é a do meio, que possui seis elétrons π deslocalizados correspondendo a um intermediário aromático.
Efeitos do isótopo estérico
|
|
|
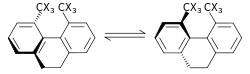
O efeito do isótopo estérico é um SKIE que não envolve quebra de ligação ou formação. Este efeito é atribuído às diferentes amplitudes vibracionais dos isotopólogos . Um exemplo de tal efeito é a racemização de 9,10-di-hidro-4,5-dimetilfenantreno. A menor amplitude de vibração para o deutério em comparação com o hidrogênio nas ligações C – H (carbono – hidrogênio), C – D (carbono – deutério) resulta em um raio de van der Waals menor ou tamanho efetivo, além de uma diferença no ZPE entre os dois. Quando há um volume efetivo maior de moléculas contendo uma em relação à outra, isso pode ser manifestado por um efeito estérico na constante de velocidade. Para o exemplo acima, o deutério racemiza mais rápido do que o isotopólogo de hidrogênio, resultando em um efeito de isótopo estérico. Um modelo para o efeito do isótopo estérico foi desenvolvido por Bartell. Um efeito de isótopo estérico é geralmente pequeno, a menos que as transformações passem por um estado de transição com carga estérica severa, como no processo de racemização mostrado acima.
Outro exemplo do efeito do isótopo estérico é na reação de deslipping de rotaxanos. O isótopo de deutério, devido ao seu menor tamanho efetivo, permite uma passagem mais fácil das rolhas através do macrociclo, resultando em taxas mais rápidas de deslipping para os rotaxanos deuterados .
Efeitos de isótopos cinéticos inversos
As reações são conhecidas onde a espécie deuterada reage mais rápido do que o análogo não deuterado, e esses casos são considerados como exibindo efeitos de isótopo cinético inverso (IKIE). IKIE's são frequentemente observados na eliminação redutiva de hidretos de alquil metal, por exemplo ( Me 2 NCH 2 CH 2 NMe 2 ) PtMe (H). Em tais casos, a ligação CD no estado de transição, uma espécie agóstica , é altamente estabilizada em relação à ligação C – H.
Um efeito inverso também pode ocorrer em uma reação de várias etapas se a constante de taxa geral depender de um pré-equilíbrio antes da etapa de determinação de taxa que tem um efeito de isótopo de equilíbrio inverso . Por exemplo, as taxas de reações catalisadas por ácido são geralmente 2-3 vezes maiores para reações em D 2 O catalisadas por D 3 O + do que para reações análogas em H 2 O catalisadas por H 3 O +. Isso pode ser explicado por um mecanismo de catálise específica de íons de hidrogênio de um reagente R por H 3 O + (ou D 3 O + ).
- H 3 O + + R ⇌ RH + + H 2 O
- RH + + H 2 O → H 3 O + + P
A taxa de formação de produtos é então d [P] / dt = k 2 [RH + ] = k 2 K 1 [H 3 O + ] [R] = k obs [H 3 O + ] [R]. Na primeira etapa, H 3 O + é geralmente um ácido mais forte do que RH + . A deuteração muda o equilíbrio em direção às espécies de ácido RD + com ligações mais fortes, nas quais o efeito da deuteração na energia vibracional de ponto zero é maior, de modo que a constante de equilíbrio deuterada K 1D é maior do que K 1H . Este efeito de isótopo de equilíbrio na primeira etapa geralmente supera o efeito de isótopo cinético na segunda etapa, de modo que há um efeito de isótopo inverso aparente e a constante de taxa geral observada k obs = k 2 K 1 diminui.
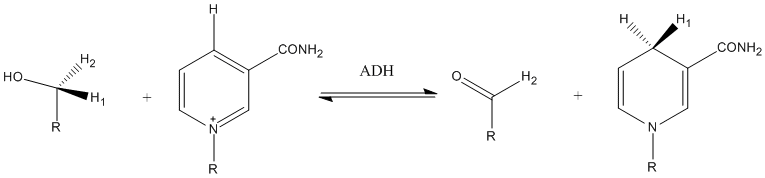
Efeitos do isótopo cinético do hidrogênio solvente
Para que os efeitos do isótopo do solvente sejam mensuráveis, uma fração finita do solvente deve ter uma composição isotópica diferente do resto. Portanto, grandes quantidades das espécies isotópicas menos comuns devem estar disponíveis, limitando os efeitos isotópicos observáveis do solvente a substituições isotópicas envolvendo hidrogênio. Os efeitos de isótopos cinéticos detectáveis ocorrem apenas quando os solutos trocam o hidrogênio com o solvente ou quando há uma interação específica soluto-solvente perto do local da reação. Ambos os fenômenos são comuns para solventes próticos, nos quais o hidrogênio é trocável, e eles podem formar interações dipolo-dipolo ou ligações de hidrogênio com moléculas polares.
Efeitos de isótopos de carbono-13
A maioria das reações orgânicas envolve a quebra e formação de ligações a um carbono; portanto, é razoável esperar efeitos detectáveis de isótopos de carbono. Quando 13 C é usado como rótulo, a mudança na massa do isótopo é de apenas ~ 8%, o que limita os efeitos do isótopo cinético observáveis a valores muito menores do que os observáveis com os efeitos do isótopo de hidrogênio.
Compensando as variações na abundância natural de 13 C
Freqüentemente, a maior fonte de erro em um estudo que depende da abundância natural de carbono é a ligeira variação na própria abundância natural do 13 C. Tais variações surgem porque os materiais de partida usados na reação são eles próprios produtos de algumas outras reações que têm efeitos isotópicos cinéticos e correspondentes enriquecimentos isotópicos nos produtos. Para compensar esse erro quando a espectroscopia de NMR é usada para determinar o efeito do isótopo cinético, as seguintes diretrizes foram propostas:
- Escolha um carbono que esteja distante do centro de reação que servirá como referência e suponha que não tenha um efeito isotópico cinético na reação.
- No material de partida que não sofreu qualquer reação, determine as razões das outras integrais de pico de NMR de carbono em relação ao carbono de referência.
- Obtenha as mesmas proporções para os carbonos em uma amostra do material de partida após ter sofrido alguma reação.
- As razões das últimas razões para as primeiras geram R / R 0 .
Se estas, bem como outras precauções listadas por Jankowski forem seguidas, efeitos cinéticos de isótopos com precisões de três casas decimais podem ser alcançados.
Efeitos de isótopos com elementos mais pesados que o carbono
A interpretação dos efeitos do isótopo do carbono geralmente é complicada pela formação e quebra simultâneas de ligações com o carbono. Mesmo as reações que envolvem apenas a clivagem da ligação do carbono, como as reações S N 1, envolvem o fortalecimento das ligações restantes ao carbono. Em muitas dessas reações, os efeitos do isótopo do grupo de saída tendem a ser mais fáceis de interpretar. Por exemplo, as reações de substituição e eliminação nas quais o cloro atua como um grupo de saída são convenientes de interpretar, especialmente porque o cloro atua como uma espécie monoatômica sem ligação interna para complicar a coordenada da reação e tem dois isótopos estáveis, 35 Cl e 37 Cl , ambos com alta abundância. O principal desafio para a interpretação de tais efeitos isotópicos é a solvatação do grupo de saída.
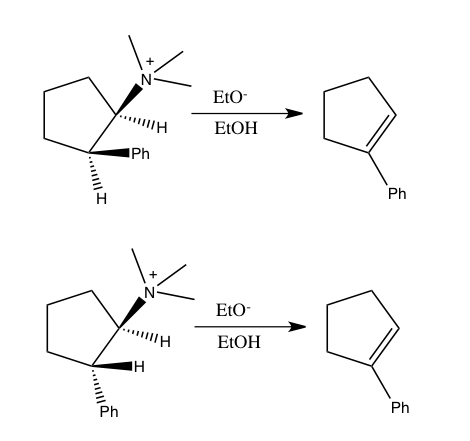
Devido às incertezas experimentais, a medição do efeito do isótopo pode envolver uma incerteza significativa. Freqüentemente, os efeitos isotópicos são determinados por meio de estudos complementares em uma série de isotopômeros. Consequentemente, é bastante útil combinar efeitos de isótopos de hidrogênio com efeitos de isótopos de átomos pesados. Por exemplo, determinar o efeito do isótopo de nitrogênio junto com o efeito do isótopo de hidrogênio foi usado para mostrar que a reação do íon 2-feniletiltrimetilamônio com etóxido em etanol a 40 ° C segue um mecanismo E2, em oposição a mecanismos alternativos não combinados. Esta conclusão foi alcançada ao mostrar que esta reação produz um efeito de isótopo de nitrogênio, k 14 / k 15 , de 1,0133 ± 0,0002 juntamente com um efeito de isótopo cinético de hidrogênio de 3,2 no hidrogênio que sai.
Da mesma forma, a combinação dos efeitos dos isótopos do nitrogênio e do hidrogênio foi usada para mostrar que as eliminações de sin de sais de amônio simples também seguem um mecanismo combinado, que era uma questão de debate antes. Nas duas reações seguintes de íon 2-fenilciclopentiltrimetilamônio com etóxido, ambas produzindo 1-fenilciclopenteno, ambos os isômeros exibiram um efeito isotópico de nitrogênio k 14 / k 15 a 60 ° C. Embora a reação do isômero trans, que segue a eliminação de sin, tenha um menor efeito de isótopo cinético de nitrogênio (1,0064) em comparação com o isômero cis que sofre anti-eliminação (1,0108), ambos os resultados são grandes o suficiente para serem indicativos de enfraquecimento da ligação CN no estado de transição que ocorreria em um processo combinado.
Outros exemplos
Uma vez que os efeitos do isótopo cinético surgem de diferenças nas massas isotópicas, os maiores efeitos do isótopo cinético observáveis estão associados às substituições isotópicas de hidrogênio por deutério (aumento de 100% na massa) ou trítio (aumento de 200% na massa). Os efeitos isotópicos cinéticos das razões de massa isotópica podem ser tão grandes quanto 36,4 usando múons. Eles produziram o átomo de hidrogênio mais leve, 0,11 H (0,113 amu), no qual um elétron orbita em torno de um "núcleo" de múon positivo (μ + ) com massa de 206 elétrons. Eles também prepararam o análogo do átomo de hidrogênio mais pesado substituindo um elétron no hélio por um múon negativo (μ - ) para formar Heμ com uma massa atômica de 4,116 amu. Como o múon negativo é muito mais pesado que um elétron, ele orbita muito mais perto do núcleo, protegendo efetivamente um próton, fazendo com que Heμ se comporte como 4,1 H. Com essas espécies exóticas, a reação de H com 1 H 2 foi investigada. As constantes de taxa de reação dos análogos de hidrogênio mais leves e mais pesados com 1 H 2 foram então usadas para calcular o efeito do isótopo cinético k 0,11 / k 4,1 , no qual há uma diferença de 36,4 vezes nas massas isotópicas. Para esta reação, a substituição isotópica produz um efeito de isótopo cinético inverso, e os autores relatam um efeito de isótopo cinético tão baixo quanto 1,74 x 10 −4 , que é o menor efeito de isótopo cinético já relatado.
O efeito do isótopo cinético leva a uma distribuição específica dos isótopos de deutério em produtos naturais, dependendo da rota pela qual foram sintetizados na natureza. Por espectroscopia de RMN, portanto, é fácil detectar se o álcool no vinho foi fermentado a partir da glicose ou da sacarose adicionada ilicitamente .
Outro mecanismo de reação que foi elucidado usando o efeito do isótopo cinético é a halogenação do tolueno :
Neste estudo particular de "KIE intramolecular", um hidrogênio benzílico sofre substituição radical por bromo usando N- bromossuccinimida como agente de bromação. Verificou-se que PhCH 3 brominates 4.86x mais rápido do que PhCD 3 . Um grande KIE de 5,56 está associado à reação das cetonas com bromo e hidróxido de sódio .
Nesta reação, a etapa de limitação da velocidade é a formação do enolato por desprotonação da cetona. Neste estudo, o KIE é calculado a partir das constantes de taxa de reação para 2,4-dimetil-3-pentanona regular e seu isômero deuterado por medições de densidade óptica .
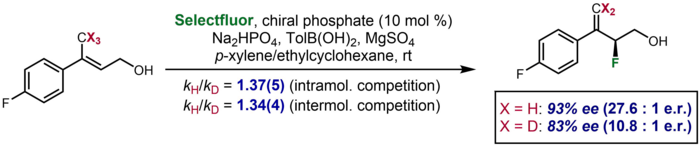
Na catálise assimétrica, existem casos raros em que um efeito de isótopo cinético se manifesta como uma diferença significativa na enantiosseletividade observada para um substrato deuterado em comparação com um não deuterado. Um exemplo foi relatado por Toste e colaboradores, no qual um substrato deuterado produziu uma enantiosseletividade de 83% ee, em comparação com 93% ee para o substrato não deuterado. O efeito foi considerado para corroborar dados KIE de competição inter e intramolecular adicionais que sugeriram clivagem da ligação CH / D na etapa de enantiodeterminação.
Veja também
- Experiência cruzada (química)
- Constante de equilíbrio # Efeito da substituição isotópica
- Efeito isotópico na peroxidação lipídica
- Efeitos isotópicos cinéticos de RuBisCO (ribulose-1,5-bisfosfato carboxilase oxigenase)
- Efeito de isótopo magnético
- Mecanismo de reação
- Fracionamento de isótopos cinéticos transitórios
Referências
Leitura adicional
- Bell RP, Crooks JE (20 de julho de 1965). "Efeitos isotópicos do hidrogênio cinético na ionização de algumas substâncias cetônicas". Proceedings of the Royal Society of London A . 286 (1406): 285–299. Bibcode : 1965RSPSA.286..285B . doi : 10.1098 / rspa.1965.0144 .

![{\ displaystyle {\ begin {matriz} \\ {\ ce {{CN ^ {-}} + {^ {12} CH3-Br} -> [k_ {12}] {^ {12} CH3-CN} + Br ^ {-}}} \\ {\ ce {{CN ^ {-}} + {^ {13} CH3-Br} -> [k_ {13}] {^ {13} CH3-CN} + Br ^ {-}}} \\ {} \ end {matriz}} \ qquad {\ text {KIE}} = {\ frac {k_ {12}} {k_ {13}}} = 1,082 \ pm 0,008}](https://wikimedia.org/api/rest_v1/media/math/render/svg/438109ea220fd190ccc57f3e2c3726c47c24aae0)




![{\ displaystyle {\ frac {k _ {{\ ce {H}}}} {k _ {{\ ce {D}}}}} = \ left ({\ frac {\ sigma _ {{\ ce {H}} } \ sigma _ {{\ ce {D}}} ^ {\ ddagger}} {\ sigma _ {{\ ce {D}}} \ sigma _ {{\ ce {H}}} ^ {\ ddagger}} } \ right) \ left ({\ frac {M _ {{\ ce {H}}} ^ {\ ddagger} M _ {{\ ce {D}}}} {M _ {{\ ce {D}}} ^ { \ ddagger} M _ {{\ ce {H}}}}} \ right) ^ {\ frac {3} {2}} \ left ({\ frac {I_ {x {\ ce {H}}} ^ {\ ddagger} I_ {y {\ ce {H}}} ^ {\ ddagger} I_ {z {\ ce {H}}} ^ {\ ddagger}} {I_ {x {\ ce {D}}} ^ {\ ddagger} I_ {y {\ ce {D}}} ^ {\ ddagger} I_ {z {\ ce {D}}} ^ {\ ddagger}}} {\ frac {I_ {x {\ ce {D}} } I_ {y {\ ce {D}}} I_ {z {\ ce {D}}}} {I_ {x {\ ce {H}}} I_ {y {\ ce {H}}} I_ {z {\ ce {H}}}}} \ right) ^ {\ frac {1} {2}} \ left ({\ frac {\ prod \ limits _ {i = 1} ^ {3N ^ {\ ddagger} - 7} {\ frac {1-e ^ {- u_ {i {\ ce {D}}} ^ {\ ddagger}}} {1-e ^ {- u_ {i {\ ce {H}}} ^ { \ ddagger}}}}} {\ prod \ limits _ {i = 1} ^ {3N-6} {\ frac {1-e ^ {- u_ {i {\ ce {D}}}}} {1- e ^ {- u_ {i {\ ce {H}}}}}}}} \ right) e ^ {- {\ frac {1} {2}} \ left [\ sum \ limits _ {i = 1} ^ {3N ^ {\ ddagger} -7} (u_ {i {\ ce {H}}} ^ {\ ddagger} -u_ {i {\ ce {D}}} ^ {\ ddagger}) - \ sum \ limites _ {i = 1} ^ {3N-6} (u_ {i {\ ce {H}}} - u_ {i {\ ce {D}}}) \ direita]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93f26faede9d0fba35d6f675e641c716e7284c0d)




![{\ displaystyle {\ begin {alinhados} {\ frac {k _ {{\ ce {H}}}} {k _ {{\ ce {D}}}}} & \ cong \ exp \ left \ {- {\ frac {1} {2}} \ left [\ sum \ limits _ {i = 1} ^ {3N ^ {\ ddagger} -7} (u_ {i {\ ce {H}}} ^ {\ ddagger} -u_ {i {\ ce {D}}} ^ {\ ddagger}) - \ sum \ limits _ {i = 1} ^ {3N-6} (u_ {i {\ ce {H}}} - u_ {i { \ ce {D}}}) \ direita] \ direita \} \\ & \ cong \ exp \ left [\ sum _ {i} ^ {\ mathrm {(reagir.)}} {\ frac {1} {2 }} \ Delta u_ {i} - \ sum _ {i} ^ {\ mathrm {(TS)}} {\ frac {1} {2}} \ Delta u_ {i} ^ {\ ddagger} \ right] \ fim {alinhado}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20d669d624e10fcb89d116442c5543998ea4fbf8)























![{\ frac {d [A]} {dt}} = {\ frac {k_ {1} k_ {3} [ABCD]} {k_ {2} [D] + k_ {3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f71c52221df559ae3b305086cf125e2cfbfa62c4)
![{\ frac {d [A]} {dt}} = k_ {1} [ABCD]](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cfaea2beb4c13e320a49b4f66ede1c5a85d0fba)
![{\ frac {d [A]} {dt}} = {\ frac {k_ {1} k_ {3} [ABCD]} {k_ {2} [D]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea50a8acf1a1307f4d9c2b4605f62578e2f79771)
![{\ displaystyle {\ begin {align} {\ ce {{A1} + {B} + {C} + \ cdots}} \ & {\ ce {-> [k_ {1}] P1}} \\ {\ ce {{A2} + {B} + {C} + \ cdots}} \ & {\ ce {-> [k_ {2}] P2}} \ end {alinhado}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a3e1c66994bddc0e6b39e89f23e4e0ec7a47b5c)

![{\ displaystyle {\ text {rate}} = {- d [{\ ce {A}} _ {n}] \ over dt} = k_ {n} \ times [{\ ce {A}} _ {n} ] \ times f ([{\ ce {B}}], [{\ ce {C}}], \ cdots) {\ text {onde}} n = 1 {\ text {ou}} 2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26ca6ed80abd2295998fb23de5de165477f2848e)
![{\ displaystyle {1 \ over k_ {1}} \ times {\ ce {{\ mathit {d}} [A1] \ over [A1]}} = {1 \ over k_ {2}} \ times {\ ce {{\ mathit {d}} [A2] \ over [A2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec95ce0a836f8db29e8a86da2d3a2390214f462c)
![{\ displaystyle {1 \ over k_ {1}} \ times \ int \ limits _ {\ ce {[A1] ^ {0}}} ^ {\ ce {[A1]}} {d [{\ ce {A }} '_ {1}] \ over [{\ ce {A}}' _ {1}]} = {1 \ over k_ {2}} \ times \ int \ limits _ {\ ce {[A2] ^ {0}}} ^ {\ ce {[A2]}} {d [{\ ce {A}} '_ {2}] \ over [{\ ce {A}}' _ {2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b3f5c1311b00398d60afa93ae27d58ac423fd32)
![{\ displaystyle {k_ {1} \ over k_ {2}} = {\ frac {\ ce {\ ln ([A1] / [A1] ^ {0})}} {\ ce {\ ln ([A2] / [A2] ^ {0})}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4f8b9f334d8799e9e6fc51d105e53d0148086f1)


![{\ displaystyle {\ text {KIE}} = {\ frac {k_ {1}} {k_ {2}}} = {\ frac {\ ln (1-F_ {1})} {\ ln [(1- F_ {1}) R / R_ {0}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f819291ca2e6641dfaf1a2d31025c40927bdd7a)
![{\ displaystyle {R \ over R_ {0}} = {\ ce {{\ frac {[A2] / [A1]} {[A2] ^ 0 / [A1] ^ 0}}}} = {\ ce { {\ frac {[A2] / [A2] ^ 0} {[A1] / [A1] ^ 0}}}} = {\ frac {1-F_ {2}} {1-F_ {1}}} = (1-F_ {1}) ^ {(k_ {2} / k_ {1}) - 1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/61529d236e7c75ed167c0a1e43f996134b54b908)

![{k_ {1} \ over k_ {2}} = {\ frac {\ ln (1-F_ {1})} {\ ln [1- (F_ {1} R_ {P} / R_ {0})] }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37f721659b133bfa69404286f90a8309fea92944)