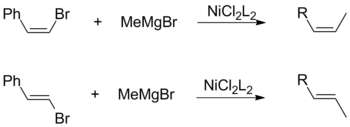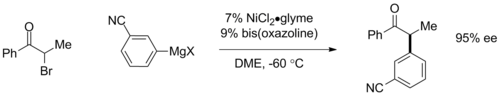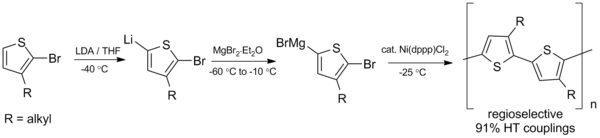Acoplamento Kumada - Kumada coupling
| Acoplamento Kumada | |
|---|---|
| Nomeado após | Makoto Kumada |
| Tipo de reação | Reação de acoplamento |
| Identificadores | |
| Portal de Química Orgânica | acoplamento kumada |
| ID de ontologia RSC | RXNO: 0000144 |
Em química orgânica , o acoplamento Kumada é um tipo de reação de acoplamento cruzado , útil para gerar ligações carbono-carbono pela reação de um reagente de Grignard e um haleto orgânico. O procedimento usa catalisadores de metal de transição , normalmente níquel ou paládio, para acoplar uma combinação de dois grupos alquil , aril ou vinil . Os grupos de Robert Corriu e Makoto Kumada relataram a reação de forma independente em 1972.
A reação é notável por estar entre os primeiros métodos de acoplamento cruzado catalítico relatados. Apesar do desenvolvimento subsequente de reações alternativas ( Suzuki , Sonogashira , Stille , Hiyama , Negishi ), o acoplamento Kumada continua a ser empregado em muitas aplicações sintéticas , incluindo a produção em escala industrial de aliscireno , um medicamento para hipertensão , e politiofenos , útil em produtos orgânicos dispositivos eletrônicos.
História
As primeiras investigações sobre o acoplamento catalítico de reagentes de Grignard com haletos orgânicos datam do estudo de 1941 de catalisadores de cobalto por Karasch e Fields. Em 1971, Tamura e Kochi desenvolveram esse trabalho em uma série de publicações demonstrando a viabilidade de catalisadores à base de prata, cobre e ferro. No entanto, essas abordagens iniciais produziram baixos rendimentos devido à formação substancial de produtos de homoacoplamento, onde duas espécies idênticas são acopladas.
Esses esforços culminaram em 1972, quando os grupos Corriu e Kumada relataram concomitantemente o uso de catalisadores contendo níquel. Com a introdução dos catalisadores de paládio em 1975 pelo grupo Murahashi, o escopo da reação foi ampliado ainda mais. Posteriormente, muitas técnicas de acoplamento adicionais foram desenvolvidas, culminando no Prêmio Nobel de Química de 2010 , reconhecido por Ei-ichi Negishi , Akira Suzuki e Richard F. Heck por suas contribuições para o campo.
Mecanismo
Catálise de paládio
De acordo com o mecanismo amplamente aceito, o acoplamento Kumada catalisado por paládio é considerado análogo ao papel do paládio em outras reações de acoplamento cruzado. O ciclo catalítico proposto envolve os estados de oxidação de paládio (0) e paládio (II). Inicialmente, o catalisador Pd (0) rico em elétrons ( 1 ) se insere na ligação R – X do haleto orgânico. Esta adição oxidativa forma um complexo organo-Pd (II) ( 2 ). A subsequente transmetalação com o reagente de Grignard forma um complexo hetero-organometálico ( 3 ). Antes da próxima etapa, a isomerização é necessária para trazer os ligantes orgânicos próximos uns dos outros em posições cis mutuamente. Finalmente, a eliminação redutiva de ( 4 ) forma uma ligação carbono-carbono e libera o produto de acoplamento cruzado enquanto regenera o catalisador Pd (0) ( 1 ). Para catalisadores de paládio, a adição oxidativa freqüentemente determinante da taxa ocorre mais lentamente do que com sistemas de catalisador de níquel.
Catálise de níquel
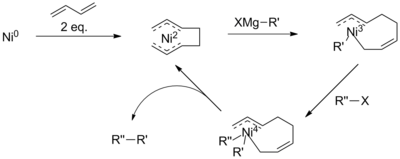
O conhecimento atual do mecanismo para o acoplamento catalisado por níquel é limitado. De fato, acredita-se que o mecanismo de reação ocorre de maneira diferente em diferentes condições de reação e quando são usados diferentes ligantes de níquel. Em geral, o mecanismo ainda pode ser descrito como análogo ao esquema de paládio (direita). Sob certas condições de reação, entretanto, o mecanismo falha em explicar todas as observações. O exame por Vicic e colegas de trabalho usando ligante de terpiridina tridentado identificou intermediários de um ciclo catalítico Ni (II) -Ni (I) -Ni (III), sugerindo um esquema mais complicado. Além disso, com a adição de butadieno, acredita-se que a reação envolva um intermediário de Ni (IV).
Escopo
Halogenetos e pseudohalides orgânicos
O acoplamento Kumada foi demonstrado com sucesso para uma variedade de halogenetos de arila ou vinila. No lugar do reagente haleto, também podem ser usados pseudo-halogenetos, e o acoplamento mostrou ser bastante eficaz usando espécies tosilato e triflato em várias condições.
Apesar do amplo sucesso com os acoplamentos de arila e vinila, o uso de halogenetos de alquila é menos geral devido a vários fatores complicadores. Não tendo elétrons π, os haletos de alquila requerem mecanismos de adição oxidativa diferentes dos grupos arila ou vinila, e esses processos são atualmente mal compreendidos. Além disso, a presença de β-hidrogênios torna os haletos de alquila suscetíveis a processos de eliminação competitiva .
Esses problemas foram contornados pela presença de um grupo ativador, como a carbonila nas α-bromocetonas, que impulsiona a reação. No entanto, os acoplamentos Kumada também têm sido realizados com cadeias alquílicas não ativadas, muitas vezes por meio do uso de catalisadores ou reagentes adicionais. Por exemplo, com a adição de 1,3-butadienos, Kambe e colegas de trabalho demonstraram acoplamentos alquil-alquil catalisados por níquel que, de outra forma, não seriam reativos.
Embora pouco compreendido, o mecanismo dessa reação é proposto para envolver a formação de um complexo de octadienil níquel. Propõe-se que este catalisador seja submetido à transmetalação com um reagente de Grignard primeiro, antes da eliminação redutiva do haleto, reduzindo o risco de eliminação do β-hidreto. No entanto, a presença de um intermediário de Ni (IV) é contrária aos mecanismos propostos para acoplamentos de haleto de arila ou vinila.
Reagente de Grignard
Os acoplamentos envolvendo reagentes de Grignard aril e vinil foram relatados nas publicações originais de Kumada e Corriu. Os reagentes Alquil Grignard também podem ser usados sem dificuldade, pois não sofrem processos de eliminação de β-hidreto. Embora o reagente de Grignard inerentemente tenha baixa tolerância de grupo funcional, sínteses de baixa temperatura foram preparadas com grupos aril altamente funcionalizados.
Catalisadores
Os acoplamentos Kumada podem ser realizados com uma variedade de catalisadores de níquel (II) ou paládio (II). As estruturas dos precursores catalíticos podem ser geralmente formuladas como ML 2 X 2 , onde L é um ligante de fosfina. As escolhas comuns para L 2 incluem ligantes difosfina bidentados, como dppe e dppp, entre outros.
O trabalho de Fürstner e colegas de trabalho em catalisadores à base de ferro mostrou rendimentos razoáveis. A espécie catalítica nessas reações é proposta como um "reagente de Grignard inorgânico" consistindo de Fe (MgX).
2 .
Condições de reação
A reação é tipicamente realizada em tetra-hidrofurano ou éter dietílico como solvente. Esses solventes etéreos são convenientes porque são solventes típicos para gerar o reagente de Grignard. Devido à alta reatividade do reagente de Grignard, os acoplamentos Kumada têm tolerância de grupo funcional limitada, o que pode ser problemático em grandes sínteses. Em particular, os reagentes de Grignard são sensíveis à protonólise mesmo de grupos levemente ácidos, como álcoois . Eles também adicionam carbonilas e outros grupos oxidativos.
Como em muitas reações de acoplamento, o catalisador de paládio de metal de transição é frequentemente sensível ao ar, exigindo um argônio inerte ou ambiente de reação de nitrogênio.
Uma amostra de preparação sintética está disponível no site da Organic Syntheses .
Seletividade
Estereosseletividade
Ambos cis e trans halogenetos de olefinas promover a retenção global de configuração geométrica quando acoplado com alquilo Grignards. Esta observação é independente de outros fatores, incluindo a escolha de ligantes de catalisador e substituintes vinílicos.
Por outro lado, um acoplamento Kumada usando reagentes de Grignard vinílicos prossegue sem estereoespecificidade para formar uma mistura de cis- e trans- alquenos. O grau de isomerização depende de uma variedade de fatores, incluindo razões de reagentes e a identidade do grupo haleto. De acordo com Kumada, essa perda de estereoquímica é atribuível a reações colaterais entre dois equivalentes do reagente de Grignard alílico.
Enantiosseletividade
Os acoplamentos Kumada assimétricos podem ser efetuados através da utilização de ligandos quirais . Usando ligantes ferroceno planar quirais , excessos enantioméricos (ee) para cima de 95% foram observados em acoplamentos de arila. Mais recentemente, Gregory Fu e colegas de trabalho demonstraram acoplamentos enantioconvergentes de α-bromocetonas usando catalisadores com base em ligantes bis-oxazolina, em que o catalisador quiral converte uma mistura racêmica de material de partida em um enantiômero de produto com até 95% ee. A última reação também é significativa por envolver um acoplamento de haleto de alquila tradicionalmente inacessível.
Quimiosseletividade
Os reagentes de Grignard normalmente não se acoplam com arenos clorados. Essa baixa reatividade é a base para quimiosseletividade para inserção de níquel na ligação C – Br do bromoclorobenzeno usando um catalisador à base de NiCl 2 .
Formulários
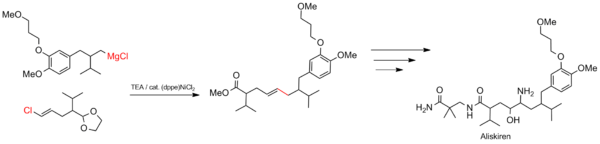
Síntese de Aliscireno
O acoplamento Kumada é adequado para processos industriais em grande escala, como síntese de drogas. A reação é usada para construir o esqueleto de carbono do aliscireno (nome comercial Tekturna), um tratamento para hipertensão .
Síntese de politiofenos
O acoplamento Kumada também se mostra promissor na síntese de polímeros conjugados , polímeros como os polialquiltiofenos (PAT), que têm uma variedade de aplicações potenciais em células solares orgânicas e diodos emissores de luz . Em 1992, McCollough e Lowe desenvolveram a primeira síntese de polialquiltiofenos regiorregulares utilizando o esquema de acoplamento Kumada ilustrado abaixo, que requer temperaturas abaixo de zero.
Desde esta preparação inicial, a síntese foi aprimorada para obter maiores rendimentos e operar em temperatura ambiente.
Veja também
- Reação diabólica
- Acoplamento Hiyama
- Reação de Suzuki
- Acoplamento negishi
- Reação de Petasis
- Reação de Stille
- Acoplamento sonogashira