Cloreto de chumbo (II) - Lead(II) chloride

|
|

|
|
| Nomes | |
|---|---|
|
Nomes IUPAC
Cloreto de chumbo (II)
Dicloreto de chumbo |
|
| Outros nomes
Cloreto
Plumbous Cotunnite |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard |
100.028.950 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| PbCl 2 | |
| Massa molar | 278,10 g / mol |
| Aparência | sólido branco sem cheiro |
| Densidade | 5,85 g / cm 3 |
| Ponto de fusão | 501 ° C (934 ° F; 774 K) |
| Ponto de ebulição | 950 ° C (1.740 ° F; 1.220 K) |
| 0,99 g / L (20 ° C) | |
|
Produto de solubilidade ( K sp )
|
1,7 × 10 −5 (20 ° C) |
| Solubilidade | ligeiramente solúvel em HCl diluído , amônia ; insolúvel em álcool Solúvel em água quente , bem como na presença de hidróxido alcalino Solúvel em HCl relacionado (> 6M) |
| −73,8 · 10 −6 cm 3 / mol | |
|
Índice de refração ( n D )
|
2,199 |
| Estrutura | |
| Ortorrômbico , oP12 | |
| Pnma, No. 62 | |
| Termoquímica | |
|
Entropia molar padrão ( S |
135,98 J K −1 mol −1 |
| -359,41 kJ / mol | |
| Perigos | |
| Ficha de dados de segurança | Veja: página de dados |
| Pictogramas GHS |
  
|
| Palavra-sinal GHS | Perigo |
| H302 , H332 , H351 , H360 , H372 , H400 , H410 | |
| P201 , P261 , P273 , P304 + 340 , P308 + 313 , P312 , P391 | |
| NFPA 704 (diamante de fogo) | |
| Dose ou concentração letal (LD, LC): | |
|
LD Lo (o mais baixo publicado )
|
1500 mg / kg (cobaia, oral) |
| Compostos relacionados | |
|
Outros ânions
|
Flúor de chumbo (II) Brometo de chumbo (II) Iodeto de chumbo (II) |
|
Outros cátions
|
Cloreto de chumbo (IV) Cloreto de estanho (II) Cloreto de germânio (II) |
|
Compostos relacionados
|
Cloreto de tálio (I) Cloreto de bismuto |
| Página de dados suplementares | |
|
Índice de refração ( n ), constante dielétrica (ε r ), etc. |
|
|
Dados termodinâmicos |
Comportamento da fase sólido-líquido-gás |
| UV , IR , NMR , MS | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Chumbo (II), cloreto de (PbCl 2 ) é um composto inorgânico que é um sólido branco, sob condições ambientais. É pouco solúvel em água. O cloreto de chumbo (II) é um dos reagentes à base de chumbo mais importantes . Também ocorre naturalmente na forma do mineral cotunnita .
Estrutura e propriedades
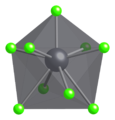
No PbCl 2 sólido , cada íon de chumbo é coordenado por nove íons de cloreto em uma formação de prisma triangular tricipado - seis estão nos vértices de um prisma triangular e três estão além dos centros de cada face do prisma retangular. Os 9 íons de cloreto não são equidistantes do átomo de chumbo central, 7 estão em 280-309 pm e 2 em 370 pm. O PbCl 2 forma agulhas ortorrômbicas brancas.
Modelo ball-and-stick de parte da estrutura cristalina da cotunnita
Geometria de coordenação de Pb 2+
Na fase gasosa, as moléculas de PbCl 2 têm uma estrutura curvada com o ângulo Cl – Pb – Cl sendo 98 ° e cada distância de ligação Pb –- Cl sendo 2,44 Å. Esse PbCl 2 é emitido por motores de combustão interna que usam aditivos de cloreto de etileno- tetraetila chumbo para fins antidetonantes.
PbCl 2 é moderadamente solúvel em água, produto de solubilidade K sp = 1,7 × 10 −5 a 20 ° C. É um dos apenas 5 cloretos comumente insolúveis em água, os outros 4 sendo cloreto de tálio (I) , cloreto de prata (AgCl) com K sp = 1,8 × 10 -10 , cloreto de cobre (I) (CuCl) com K sp = 1,72 × 10 −7 e cloreto de mercúrio (I) (Hg 2 Cl 2 ) com K sp = 1,3 × 10 −18 .
Ocorrência
O PbCl 2 ocorre naturalmente na forma do mineral cotunnita . É incolor, branco, amarelo ou verde com densidade de 5,3–5,8 g / cm 3 . A dureza na escala de Mohs é 1,5–2. A estrutura cristalina é dipiramidal ortorrômbica e o grupo de pontos é 2 / m 2 / m 2 / m. Cada Pb tem um número de coordenação de 9. Cotunnite ocorre perto de vulcões: Vesúvio , Itália; Tarapacá , Chile; e Tolbachik , Rússia.
Síntese
Duplo deslocamento / metátese
O cloreto de chumbo (II) precipita após a adição de fontes de cloreto aquoso (HCl, NaCl, KCl) aos compostos de chumbo (II)
- Compostos solúveis de chumbo
-
Nitrato de chumbo (II)
- Pb (NO 3 ) 2 + 2 NaCl (aq) → PbCl 2 (s) + NaNO 3 (aq)
-
Acetato de chumbo (II)
- Pb (CH 3 COO) 2 (aq) + HCl (aq) → PbCl 2 (s) + 2 CH 3 COOH
-
Nitrato de chumbo (II)
- Compostos insolúveis de chumbo
-
Carbonato de chumbo (II)
- PbCO 3 + 2 HCl (aq) → PbCl 2 (s) + CO 2 (g) + H 2 O
-
Dióxido de chumbo
- PbO 2 (s) + 4 HCl → PbCl 2 (s) + Cl 2 + 2 H 2 O
-
Óxido de chumbo (II)
- PbO (s) + 2 HCl → PbCl 2 (s) + H 2 O
-
Carbonato de chumbo (II)
Redução Direta
O PbCl 2 pode ser formado pela redução do cloreto de cobre (II) pelo chumbo metálico:
- Pb + CuCl 2 → PbCl 2 + Cu
Cloração direta
O PbCl 2 também se forma pela ação do gás cloro no metal de chumbo:
- Pb + Cl 2 → PbCl 2
Reações
A adição de íons cloreto a uma suspensão de PbCl 2 dá origem a íons complexos solúveis . Nessas reações, o cloreto adicional (ou outros ligantes ) rompem as pontes de cloreto que compreendem a estrutura polimérica de PbCl2 (s) sólido (s) .
- PbCl 2 (s) + Cl - → [PbCl 3 ] - (aq)
- PbCl 2 (s) + 2 Cl - → [PbCl 4 ] 2− (aq)
PbCl 2 reage com NaNO 2 fundido para dar PbO:
- PbCl 2 (l) + 3 NaNO 2 → PbO + NaNO 3 + 2 NO + 2 NaCl
PbCl 2 é usado na síntese de cloreto de chumbo (IV) (PbCl 4 ): Cl 2 é borbulhado através de uma solução saturada de PbCl 2 em NH 4 Cl aquoso formando [NH 4 ] 2 [PbCl 6 ]. Este último reage com ácido sulfúrico concentrado frio (H 2 SO 4 ) formando PbCl 4 como um óleo.
O cloreto de chumbo (II) é o principal precursor dos derivados organometálicos do chumbo, como os plumbocenos . Os agentes alquilantes usuais são empregados, incluindo reagentes de Grignard e compostos de organolítio:
- 2 PbCl 2 + 4 RLi → R 4 Pb + 4 LiCl + Pb
- 2 PbCl 2 + 4 RMgBr → R 4 Pb + Pb + 4 MgBrCl
- 3 PbCl 2 + 6 RMgBr → R 3 Pb-PbR 3 + Pb + 6 MgBrCl
Essas reações produzem derivados que são mais semelhantes aos compostos de organossilício, ou seja , que o Pb (II) tende a se desproporcionalmente na alquilação.
O PbCl 2 pode ser usado para produzir PbO 2 tratando-o com hipoclorito de sódio (NaClO), formando um precipitado marrom-avermelhado de PbO 2 .
Usos
- O PbCl 2 fundido é usado na síntese de titanato de chumbo e cerâmica de titanato de bário e chumbo por reações de substituição catiônica:
- x PbCl 2 (l) + BaTiO 3 (s) → Ba 1− x Pb x TiO 3 + x BaCl 2
- O PbCl 2 é usado na produção de vidro transmissor infravermelho e vidro ornamental denominado vidro aurene . O vidro Aurene tem uma superfície iridescente formada por pulverização com PbCl 2 e reaquecimento sob condições controladas. O cloreto estanoso (SnCl 2 ) é usado para o mesmo propósito.
- Pb é usado em serviço HCl embora o PbCl 2 formada é ligeiramente solúvel em HCl. A adição de 6–25% de antimônio (Sb) aumenta a resistência à corrosão.
- Um cloreto básico de chumbo, PbCl 2 · Pb (OH) 2 , é conhecido como chumbo branco de Pattinson e é usado como pigmento em tinta branca. A tinta com chumbo está agora proibida como um perigo para a saúde em muitos países pela Convenção de Chumbo Branco (Pintura), 1921 .
- PbCl 2 é um intermediário no refino de minério de bismuto (Bi). O minério contendo Bi, Pb e Zn é primeiro tratado com soda cáustica derretida para remover vestígios de arsênio e telúrio . Isso é seguido pelo processo Parkes para remover qualquer prata e ouro presentes. O minério agora contém Bi, Pb e Zn. É tratado com gás Cl 2 a 500 ° C. O ZnCl 2 se forma primeiro e é removido. Em seguida, PbCl 2 formas e é removido deixando puro Bi. BiCl 3 se formaria por último.
Toxicidade
Como outros compostos de chumbo solúveis, a exposição ao PbCl 2 pode causar envenenamento por chumbo .