Leishmania -Leishmania
| Leishmania | |
|---|---|

|
|
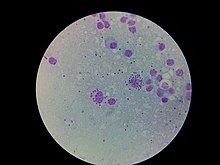
| L. donovani em célula de medula óssea | |
|
Classificação científica |
|
| Domínio: | Eukaryota |
| Filo: | Euglenozoa |
| Classe: | Kinetoplastea |
| Pedido: | Trypanosomatida |
| Gênero: |
Leishmania Borovsky 1898 ( Ross 1903) |
| Espécies | |
|
L. aethiopica |
|
Leishmania / l i ʃ m eɪ n i ə / é um género de tripanossomas que são responsáveis pela doença leishmaniose . Eles são espalhados por flebotomíneos do gênero Phlebotomus no Velho Mundo e do gênero Lutzomyia no Novo Mundo . Pelo menos 93 espécies de flebotomíneos são vetores comprovados ou prováveis em todo o mundo. Seus hospedeiros primários são vertebrados ; Leishmania comumente infecta hyraxes , canídeos , roedores e humanos .
História
A primeira referência escrita aos sintomas conspícuos da leishmaniose cutânea surgiu nos Paleotrópicos em textos orientais que datam do século 7 aC (supostamente transcritas de fontes várias centenas de anos mais antigas, entre 1500 e 2000 aC). Devido à sua ampla e persistente prevalência ao longo da antiguidade como uma doença misteriosa de diversos desfechos sintomáticos, a leishmaniose foi apelidada com vários nomes que variam de "lepra branca" a " febre negra ". Alguns desses nomes sugerem ligações com crenças culturais negativas ou mitologia, que ainda hoje alimentam a estigmatização social da leishmaniose.
Membros de um gênero antigo do parasita Leishmania , Paleoleishmania , foram detectados em flebotomíneos fossilizados que datam do início do período Cretáceo , no entanto, o agente causador da doença só foi descoberto em 1901 como um achado simultâneo por William Boog Leishman e Charles Donovan . Eles visualizaram de forma independente parasitas unicelulares microscópicos (mais tarde chamados de corpos de Leishman-Donovan) vivendo dentro das células de órgãos humanos infectados. O gênero parasita seria posteriormente classificado como protozoários tripanossomatídeos sob a designação filogenética , Leishmania donovani . Várias espécies foram classificadas e agrupadas em dois subgêneros principais, ou seja, Leishmania Viannia (geralmente localizada nos Neotrópicos ) ou Leishmania Leishmania (geralmente localizada nos Paleotrópicos , com a principal exceção do subgrupo L. mexicana ).
Epidemiologia
Leishmania afeta atualmente 6 milhões de pessoas em 98 países. Cerca de 0,9-1,6 milhões de novos casos ocorrem a cada ano, e 21 espécies são conhecidas por causar doenças em humanos.
Estrutura
As espécies de Leishmania são eucariotas unicelulares com um núcleo bem definido e outras organelas celulares, incluindo cinetoplastos e flagelos . Dependendo do estágio de seu ciclo de vida, eles existem em duas variantes estruturais, como:
- A forma amastigota é encontrada nos fagócitos mononucleares e no sistema circulatório de humanos. É uma forma intracelular e imóvel, desprovida de flagelos externos. O flagelo curto é embutido na extremidade anterior sem se projetar. Tem forma oval e mede de 3 a 6 µm de comprimento e de 1 a 3 µm de largura. O cinetoplasto e o corpo basal ficam em direção à extremidade anterior.
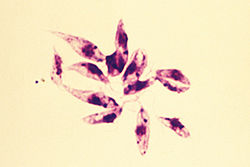
- A forma promastigota é encontrada no trato alimentar de flebotomíneos. É uma forma extracelular e móvel. É consideravelmente maior e altamente alongado, medindo 15-30 µm de comprimento e 5 µm de largura. Tem a forma de um fuso, afinando em ambas as extremidades. Um longo flagelo (próximo ao comprimento do corpo) é projetado externamente na extremidade anterior. O núcleo fica no centro e na frente dele estão o cinetoplasto e o corpo basal.
Evolução
Os detalhes da evolução deste gênero são debatidos, mas Leishmania aparentemente evoluiu de uma linhagem tripanossômica ancestral. A linhagem mais antiga é a de Bodonidae , seguida por Trypanosoma brucei , esta última confinada ao continente africano. Grupos de Trypanosoma cruzi com tripanossomas de morcegos, mamíferos sul-americanos e cangurus sugerem uma origem no hemisfério sul. Esses clados são apenas remotamente relacionados.
Os clados restantes nesta árvore são Blastocrithidia , Herpetomonas e Phytomonas . Os quatro gêneros Leptomonas , Crithidia , Leishmania e Endotrypanum formam os ramos terminais, sugerindo uma origem relativamente recente. Vários desses gêneros podem ser polifiléticos e podem precisar de divisão adicional.
As origens do próprio gênero Leishmania não são claras. Uma teoria propõe uma origem africana, com migração para as Américas. Outro propõe a migração das Américas para o Velho Mundo por meio da ponte de terra do Estreito de Bering, há cerca de 15 milhões de anos. Uma terceira teoria propõe uma origem paleártica . Essas migrações implicariam na migração subsequente do vetor e do reservatório ou adaptações sucessivas ao longo do caminho. Uma migração mais recente é a de L. infantum dos países mediterrâneos para a América Latina (conhecida como L. chagasi ), desde a colonização européia do Novo Mundo , onde os parasitas pegaram seus atuais vetores do Novo Mundo em seus respectivos ecossistemas. Esta é a causa das epidemias agora evidentes. Uma epidemia recente do Novo Mundo diz respeito a cães de caça nos EUA.
Embora tenha sido sugerido que Leishmania pode ter evoluído nos Neotrópicos . isso provavelmente é verdade para espécies pertencentes aos subgêneros Viannia e Endotrypanum . No entanto, há evidências de que a evolução primária dos subgêneros Leishmania e Sauroleishmania é o Velho Mundo. Enquanto as espécies Mundinia parecem ser mais universais em sua evolução. Uma teoria é que diferentes linhagens ficaram isoladas geograficamente durante diferentes períodos e é isso que deu origem a esse mosaicismo evolutivo. Mas não há dúvida de que os Leishmaniinae são um grupo monofilético.
Uma grande análise do conjunto de dados sugere que a Leishmania evoluiu de 90 a 100 milhões de anos atrás em Gondwana . As espécies infectantes de répteis são originárias de clados de mamíferos.
As espécies de Sauroleishmania foram originalmente definidas com base no fato de infectarem répteis ( lagartos ) em vez de mamíferos . Com base em evidências moleculares, eles foram movidos para o status de subgênero dentro de Leishmania . Este subgênero provavelmente evoluiu de um grupo que originalmente infectou mamíferos.
Taxonomia
53 espécies são reconhecidas neste gênero. O status de vários deles é disputado, então o número final pode ser diferente. Pelo menos 20 espécies infectam humanos. Para tornar as coisas mais complexas, híbridos podem estar envolvidos, como foi relatado no Brasil com um híbrido entre Leishmania (V.) guyanensis e Leishmania (V.) shawi shawi .
O gênero está atualmente dividido em 4 subgêneros: Leishmania , Sauroleishmania , Mundinia e Viannia . A divisão em dois subgêneros ( Leishmania e Viannia ) foi feita por Lainson e Shaw em 1987 com base em sua localização no intestino do inseto. As espécies do subgênero Viannia se desenvolvem no intestino posterior: L. (V.) braziliensis foi proposta como espécie-tipo para este subgênero. Esta divisão foi confirmada por todos os estudos subsequentes. Shaw, Camargo e Teixeira criaram o subgênero Mundinia enquanto revisavam Leishmaniinae em 2016.
Endotrypanum está intimamente relacionado com Leishmania . Algumasespécies de Endotypanum são únicas porque infectam os eritrócitos de seus hospedeiros (preguiças). Todas as espécies estão confinadas às Américas do Sul e Central. Infecções por E. colombiensis foram encontradas no homem.
A sauroleishmania foi originalmente descrita por Ranquein 1973 como um gênero separado, mas estudos moleculares sugerem que este é, na verdade, um subgênero, e não um gênero separado.
A divisão proposta da Leishmania em Euleishmania e Paraleishmania grupos em 2000 enfatizou a distância filogenética profunda entre parasitas, alguns dos quais tinham sido nomeados como Leishmania espécies. O Euleishmania incluiu espécies atualmente classificadas nos subgêneros Leishmania , Sauroleishmania , Mundinia e Viannia . A Paraleishmania proposta incluiu espécies de Endotypanum, Leishmamnia - L. colomubensis , L. herreri , L. hertigi e L. deanei e L. equatorensis . Em uma revisão recente, essas espécies receberam status genérico diferente.
Quatro subgêneros de Leishmania são agora reconhecidos - Leishmania , Sauroleishmania , Viannia e Mundinia (o complexo L. enriettii ). Os gêneros Endotrypanum e Porcisia pertencem à Paraleishmania .
Existem quatro espécies de Mundinia - L. (Mundinia) enriettii , L. (Mundinia) martiniquensis , L. (Mundinia) macropodum e L. (Mundinia) orientalis, que é encontrada na Tailândia.
O status específico de L. archibaldi é incerto, mas está intimamente relacionado a L. donovani .
L. herreri pertence ao gênero Endotypanum e não à Leishmania .
L. donovani e L. infantum estão intimamente relacionados.
Notas
A selenoenzima Seltryp parece ser exclusiva desta ordem. Foi removido do subgênero Viannia .
L. deanei e L. hertigi , que infectam porcos-espinhos, foram transferidos para o gênero Porcisia.
Classificação
Subgênero Leishmania Ross, 1903 sensu Saf'janova, 1982
- Leishmania aethiopica Bray, Ashford & Bray, 1973
- Leishmania amazonensis Lainson & Shaw, 1972 (inclui garnhami Scorza et al., 1979 )
- Leishmania arabica Peters, Elbihari & Evans, 1986
- Leishmania aristidesi Lainson & Shaw, 1979
- Leishmania donovani (Laveran & Mesnil, 1903)
- Leishmania forattinii Yoshida, Cuba, Pacheco, Cupolillo, Tavares, Machado, Homen & Grimaldi, 1993
- Leishmania gerbilli Wang, Qu & Guan, 1964
- Leishmania infantum Nicolle, 1908 (subespécie chagasi Cunha & Chagas, 1937 )
- Leishmania killicki Rioux, Lamotte & Pratlong, 1986
- Leishmania major Yakimoff & Schokhor, 1914
- Leishmania mexicana Biagi, 1953
- Leishmania pifanoi Medina e Romero, 1959
- Leishmania tropica (Wright, 1903)
- Leishmania turanica Strelkova, Shurkhal, Kellina, Eliseev, Evans, Peters, Chapman, Le Blancq & van Eys, 1990
- Leishmania venezeulensis Bonfante-Garrido, 1980
- Leishmania waltoni Shaw, Pratlong e Dedet 2015
Subgênero Mundinia Shaw, Camargo e Teixeira 2016
- Leishmania enriettii Muniz e Medina, 1948
- Leishmania macropodum Barratt, Kaufer, Peters, Craig, Lawrence, Roberts, Lee, McAuliffe, Stark, Ellis, 2017
- Leishmania martiniquensis Desbois, Pratlong, Quist e Dedet, 2014
- Leishmania orientalis Jariyapan, Daroontum, Jaiwong, Chanmol, .Intakhan, Sor-Suwan, Siriyasatien, Somboon, Bates, Bates, 2018
Subgênero Sauroleishmania Ranque, 1973 sensu Saf'janova, 1982
- Leishmania adleri Heisch, 1958
- Leishmania agamae David, 1929
- Leishmania ceramodactyli Adler & Theodor, 1929
- Leishmania gulikae Ovezmukhammedov & Saf'janova, 1987
- Leishmania gymnodactyli † Khodukin & Sofiev, 1940
- Leishmania helioscopi † Chodukin & Sofiev, 1940
- Leishmania hemidactyli Mackie, Gupta & Swaminath, 1923
- Leishmania hoogstraali McMillan, 1965
- Leishmania nicollei Chodukin & Sofieff, 1940
- Leishmania platycephala Telford, 2009
- Leishmania phrynocephali Chodukin & Sofieff, 1940
- Leishmania senegalensis Ranque, 1973
- Leishmania sofieffi ↑ Markov, Lukina & Markova, 1964
- Leishmania tarentolae Wenyon, 1921
- Leishmania zmeevi ↑ Andruchko & Markov 1955
- Leishmania zuckermani Paperna, Boulard, Hering-Hagenbeck & Landau, 2001
↑ Espécies descritas como Sauroleishmania . Seu desenvolvimento não é igual ao de outros membros do subgênero e, portanto, sua posição taxonômica é duvidosa.
Subgênero Viannia Lainson & Shaw 1987
- Leishmania braziliensis Vianna, 1911
- Leishmania guyanensis Floch, 1954
- Leishmania lainsoni Silveira, Shaw, Braga & Ishikawa, 1987
- Leishmania lindenbergi Silveira, Ishikawa, De Souza & Lainson, 2002
- Leishmania naiffi Lainson & Shaw, 1989
- Leishmania panamensis Lainson & Shaw, 1972
- Leishmania peruviana Velez, 1913
- Leishmania shawi Lainson, Braga & de Souza, 1989
- Leishmania utingensis Braga, Lainson, Ishikawa e Shaw 2003
Gêneros relacionados
As relações entre esses gêneros e Leishmania atualmente não são claras, mas eles estão intimamente relacionados.
Gênero Endotrypanum
- Endotrypanum colombiensis (Kreutzer, Corredor, Grimaldi, Grogl, Rowton, Young, Morales, McMahon-Pratt, Guzman & Tesh, 1991)
- Endotrypanum equatorensis (Grimaldi, Kreutzer, Hashiguchi, Gomet, Mimory & Tesh, 1992)
- Endotrypanum herreri (Zeledon, Ponce & Murillo, 1979)
- Endotrypanum monterogeii Shaw, 1969
- Endotrypanum schaudinni Mesnil e Brimont, 1908
Genus Novymonas Kostygov e Yurchenko 2016
- Novymonas esmeraldas Votýpka, Kostygov, Maslov e Lukeš 2016
Gênero Porcisia Shaw, Camargo e Teixeira 2016
- Porcisia deanei (Lainson & Shaw 1977)
- Porcisia hertigi ( Herrer 1971)
Gênero Zelonia Shaw, Camargo e Teixeira 2016
- Zelonia australiensis Barratt, Kaufer, Peters, Craig, Lawrence, Roberts, Lee, McAuliffe, Stark, Ellis 2017
- Zelonia costaricensis (Yurchenko, Lukes, Jirku, Zeledon, Maslov 2006)
Bioquímica e biologia celular
A bioquímica e a biologia celular da Leishmania são semelhantes às de outros cinetoplastídeos . Eles compartilham as mesmas características morfológicas principais, incluindo um único flagelo que tem uma invaginação, a bolsa flagelar, em sua base, um cinetoplasto , que é encontrado na mitocôndria única , e uma matriz subpelicular de microtúbulos, que constituem a parte principal de o citoesqueleto .
Casaco de lipofosfoglicano
A Leishmania possui uma camada de lipofosfoglicano sobre a parte externa da célula. O lipofosfoglicano é um gatilho para o receptor 2 do tipo toll , um receptor de sinalização envolvido no desencadeamento de uma resposta imune inata em mamíferos.
A estrutura precisa do lipofosfoglicano varia dependendo da espécie e do estágio do ciclo de vida do parasita. O componente de glicano é particularmente variável e diferentes variantes de lipofosfoglicano podem ser usadas como um marcador molecular para diferentes estágios do ciclo de vida. Lectinas , um grupo de proteínas que se ligam a diferentes glicanos, são frequentemente utilizadas para detectar essas variantes de lipofosfoglicanos. Por exemplo, a aglutinina de amendoim se liga a um lipofosfoglicano específico encontrado na superfície da forma infecciosa de L. major .
O lipofosfoglicano é usado pelo parasita para promover sua sobrevivência no hospedeiro e os mecanismos pelos quais o parasita faz isso giram em torno da modulação da resposta imune do hospedeiro. Isso é vital, pois os parasitas Leishmania vivem dentro dos macrófagos e precisam evitar que os macrófagos os matem. O lipofosfoglicano tem o papel de resistir ao sistema complemento , inibindo a resposta de explosão oxidativa , induzindo uma resposta inflamatória e prevenindo as células T natural killer reconhecendo que o macrófago está infectado com o parasita Leishmania .
| Modelo | Patógeno | Localização |
|---|---|---|
| As infecções cutâneas por leishmaniose (localizadas e difusas) aparecem como reações cutâneas óbvias. | A mais comum é a ferida oriental (causada por espécies do Velho Mundo L. major , L. tropica e L. aethiopica ). No Novo Mundo, o culpado mais comum é L. mexicana . | As infecções cutâneas são mais comuns no Afeganistão , Brasil , Irã , Peru , Arábia Saudita e Síria . |
| As infecções por leishmaniose mucocutânea começam como uma reação na picada e podem ir por metástase para a membrana mucosa e tornar-se fatais. | L. braziliensis | As infecções mucocutâneas são mais comuns na Bolívia , Brasil e Peru . Infecções mucocutâneas também são encontradas em Karamay , Região Autônoma de Xinjiang Uygur, China. |
| As infecções da leishmaniose visceral são frequentemente reconhecidas por febre, inchaço do fígado e baço e anemia . Eles são conhecidos por muitos nomes locais, dos quais o mais comum é provavelmente kala azar , | Causados exclusivamente por espécies do L. donovani complexo ( L. donovani , L. infantum syn. L. chagasi ). | Encontrada em áreas tropicais e subtropicais de todos os continentes, exceto Austrália , as infecções viscerais são mais comuns em Bangladesh , Brasil , Índia , Nepal e Sudão . A leishmaniose visceral também é encontrada em parte da China, como na província de Sichuan, na província de Gansu e na região autônoma de Xinjiang Uygur. |
Mecanismo intracelular de infecção
Para evitar a destruição pelo sistema imunológico e prosperar, a Leishmania 'se esconde' dentro das células do hospedeiro. Esta localização permite evitar a ação da resposta imune humoral (porque o patógeno está com segurança dentro de uma célula e fora da corrente sanguínea aberta) e, além disso, pode impedir que o sistema imunológico destrua seu hospedeiro por meio de sinais de superfície não perigosos que desencorajam a apoptose . Os tipos de células primárias infiltrados de Leishmania são células fagocitóticas , como neutrófilos e macrófagos .
Normalmente, uma célula imune fagocitótica como um macrófago ingerirá um patógeno dentro de um endossomo fechado e então preencherá esse endossomo com enzimas que digerem o patógeno. Porém, no caso da Leishmania , essas enzimas não têm efeito, permitindo que o parasita se multiplique rapidamente. Esse crescimento desinibido de parasitas eventualmente oprime o macrófago hospedeiro ou outra célula imune, fazendo com que ele morra.
Transmitidos pelo mosquito - pólvora , os protozoários parasitas de L. major podem mudar a estratégia da primeira defesa imunológica de comer / inflamar / matar para comer / sem inflamação / não matar seu fagócito hospedeiro e corrompê-lo para seu próprio benefício. Eles usam os granulócitos neutrófilos polimorfonucleares (PMNs) que fagocitam voluntariamente como um esconderijo complicado, onde se proliferam sem serem reconhecidos pelo sistema imunológico e entram nos macrófagos de longa vida para estabelecer uma infecção "oculta" .
Captura e sobrevivência
Após a infecção microbiana , os PMNs saem da corrente sanguínea através da camada endotelial dos vasos, para o local do tecido infectado (tecido dérmico após picada de mosca). Eles imediatamente iniciam a primeira resposta imune e fagocitam o invasor pelo reconhecimento de superfícies estranhas e ativadoras no parasita. PMN ativados secretam quimiocinas , IL-8 particularmente, para atrair mais granulócitos e estimular a fagocitose. Além disso, L. major aumenta a secreção de IL-8 pelos PMNs. Esse mecanismo também é observado durante a infecção por outros parasitas intracelulares obrigatórios . Para micróbios como esses, existem vários mecanismos de sobrevivência intracelular. Surpreendentemente, a co-injeção de patógenos apoptóticos e viáveis causa um curso de doença muito mais fulminante do que a injeção apenas de parasitas viáveis. Quando o sinal antiinflamatório fosfatidilserina geralmente encontrado em células apoptóticas, é exposto na superfície de parasitas mortos, L. major desliga a explosão oxidativa , evitando assim a morte e degradação do patógeno viável.
No caso da Leishmania , a progênie não é gerada em PMNs, mas dessa forma podem sobreviver e persistir desemaranhados no sítio primário de infecção. As formas promastigotas também liberam fator quimiotático de Leishmania (LCF) para recrutar neutrófilos ativamente, mas não outros leucócitos , por exemplo monócitos ou células NK . Além disso, a produção da proteína 10 induzível por interferon gama (IFNγ) pelos PMNs é bloqueada no atendimento à Leishmania , o que envolve o desligamento da resposta imune inflamatória e protetora pelo recrutamento de células NK e Th1 . Os patógenos permanecem viáveis durante a fagocitose, uma vez que seus hospedeiros primários, os PMNs, expõem o padrão molecular apoptótico associado à célula (ACAMP) sinalizando "nenhum patógeno".
Persistência e atração
A vida útil dos granulócitos neutrófilos é bastante curta. Eles circulam na corrente sanguínea por cerca de 6 a 10 horas após deixarem a medula óssea , após o que sofrem apoptose espontânea . Foi relatado que os patógenos microbianos influenciam a apoptose celular por meio de diferentes estratégias. Obviamente, por causa da inibição da ativação da caspase 3, L. major pode induzir o retardo da apoptose dos neutrófilos e estender sua vida por pelo menos 2-3 dias. O fato de prolongar a vida útil é muito benéfico para o desenvolvimento da infecção, pois as células hospedeiras finais desses parasitas são macrófagos, que normalmente migram para os locais de infecção em dois ou três dias. Os patógenos não são monótonos; em vez disso, eles assumem o comando no local primário de infecção. Eles induzem a produção por PMNs das quimiocinas MIP-1α e MIP-1β ( proteína inflamatória de macrófagos ) para recrutar macrófagos.
Um fator importante no prolongamento da infecção é a inibição do sistema imunológico adaptativo . Isso ocorre principalmente durante as fases intercelulares, quando os amastigotas procuram novos macrófagos para infectar e são mais suscetíveis às respostas imunológicas. Quase todos os tipos de fagócitos são direcionados. Por exemplo, mincle mostrou ser alvo de L. major . A interação entre o mincle e uma proteína liberada pelo parasita resulta em uma resposta imunológica enfraquecida nas células dendríticas .
Teoria da fagocitose silenciosa
Para salvar a integridade do tecido circundante dos componentes tóxicos das células e das enzimas proteolíticas contidas nos neutrófilos, os PMNs apoptóticos são eliminados silenciosamente pelos macrófagos. PMN moribundas expor a "me coma" -signal fosfatidilserina que é transferido para o folheto exterior da membrana plasmática durante a apoptose. Por causa da apoptose tardia, os parasitas que persistem nos PMNs são absorvidos pelos macrófagos, empregando um processo absolutamente fisiológico e não flogístico. A estratégia dessa "fagocitose silenciosa" tem as seguintes vantagens para o parasita:
- A tomada de células apoptóticas silencia a atividade de matar macrófagos, levando à sobrevivência dos patógenos.
- Os patógenos dentro dos PMNs não têm contato direto com os receptores de superfície dos macrófagos , porque eles não podem ver o parasita dentro da célula apoptótica. Assim, a ativação do fagócito para ativação imune não ocorre.
No entanto, estudos têm mostrado que isso é improvável, uma vez que os patógenos são vistos deixando células apoptópicas e nenhuma evidência é conhecida de captação de macrófagos por este método.
Biologia molecular
Um aspecto importante do protozoário Leishmania é sua camada glicoconjugada de lipofosfoglicano (LPG). Este é mantido junto com uma âncora de membrana de fosfoinositídeo e tem uma estrutura tripartida que consiste em um domínio lipídico, um hexassacarídeo neutro e uma galactose-manose fosforilada, com uma terminação em uma tampa neutra. Esses parasitas não apenas desenvolvem a digestão pós-flebotomia, mas também são considerados essenciais para explosões oxidativas, permitindo assim a passagem para a infecção. As características da digestão intracelular incluem a fusão do endossomo com um lisossoma , liberando hidrolases ácidas que degradam o DNA , o RNA , as proteínas e os carboidratos .
Genômica
Os genomas de quatro espécies de Leishmania ( L. major , L. infantum , L. donovani e L. braziliensis ) foram sequenciados, revelando mais de 8300 codificadores de proteínas e 900 genes de RNA . Quase 40% dos genes codificadores de proteínas se enquadram em 662 famílias contendo entre dois e 500 membros. A maioria das famílias de genes menores são arranjos em tandem de um a três genes, enquanto as famílias de genes maiores estão frequentemente dispersas em arranjos em tandem em diferentes loci ao longo do genoma . Cada um dos 35 ou 36 cromossomos é organizado em um pequeno número de grupos de genes de dezenas a centenas de genes na mesma fita de DNA. Esses agrupamentos podem ser organizados de forma cabeça-a-cabeça (divergente) ou cauda-a-cauda (convergente), sendo a última frequentemente separada por genes de tRNA , rRNA e / ou snRNA . A transcrição de genes codificadores de proteínas inicia bidirecionalmente nas regiões de troca de fita divergentes entre os agrupamentos de genes e se estende policistronicamente através de cada agrupamento de genes antes de terminar na região de troca de fita que separa os agrupamentos convergentes. Os telômeros de Leishmania são geralmente relativamente pequenos, consistindo em alguns tipos diferentes de sequência de repetição. As evidências podem ser encontradas para a recombinação entre vários grupos diferentes de telômeros. Os genomas de L. major e L. infantum contêm apenas cerca de 50 cópias de elementos inativos degenerados relacionados a Ingi / L1Tc (DIREs), enquanto L. braziliensis também contém vários elementos transponíveis associados a telômeros e retroelementos associados a líderes emendados. Os genomas de Leishmania compartilham um proteoma de núcleo conservado de cerca de 6200 genes com os tripanossomatídeos relacionados Trypanosoma brucei e Trypanosoma cruzi , mas cerca de 1000 genes específicos de Leishmania são conhecidos, os quais estão distribuídos aleatoriamente em todo o genoma. Relativamente poucas (cerca de 200) diferenças específicas da espécie no conteúdo do gene existem entre os três genomas sequenciados de Leishmania , mas cerca de 8% dos genes parecem estar evoluindo em taxas diferentes entre as três espécies, indicativo de diferentes pressões seletivas que podem estar relacionadas a patologia da doença. Cerca de 65% dos genes codificadores de proteínas atualmente carecem de atribuição funcional.
As espécies de Leishmania produzem várias proteínas de choque térmico diferentes . Estes incluem Hsp83, um homólogo de Hsp90 . Um elemento regulador na 3 'UTR de Hsp83 controla a tradução de Hsp83 de uma maneira sensível à temperatura. Esta região forma uma estrutura de RNA estável que derrete em altas temperaturas.
Reprodução sexual
O sistema reprodutivo de um patógeno microbiano é um dos processos biológicos básicos que condicionam a ecologia do microrganismo e a disseminação de doenças. Em 2009, Akopyants et al. demonstraram que L. major tem um ciclo sexual, incluindo um processo meiótico. A progênie híbrida é formada com complementos genômicos completos de ambos os pais. O acasalamento ocorre apenas no vetor flebotomíneo , e os híbridos podem ser transmitidos ao hospedeiro mamífero pela picada do flebotomíneo. Em L. braziliensis, os acasalamentos na natureza são predominantemente entre indivíduos aparentados, resultando em endogamia extrema. A taxa de cruzamento entre diferentes cepas de Leishmania no vetor flebotomíneo depende da frequência de coinfecção. Esses eventos de cruzamento parecem ser raros em L. major e L. donovani .
L. infantum produz as proteínas BRCA1 e RAD51 que interagem entre si para promover o reparo de recombinação homóloga. Essas proteínas desempenham um papel fundamental na meiose. Assim, eventos meióticos fornecem a vantagem adaptativa de reparo recombinacional eficiente de danos ao DNA, mesmo quando eles não levam ao cruzamento.
Veja também
Referências
Leitura adicional
- Van Zandbergen, G; Bollinger, A; Wenzel, A; Kamhawi, S; Voll, R; Klinger, M; Muller, A; Holscher, C; Herrmann, M; Sacks, D; Solbach, W; Laskay, T (2006). “O desenvolvimento da doença de Leishmania depende da presença de promastigotas apoptóticos no inóculo virulento” . Proceedings of the National Academy of Sciences . 103 (37): 13837–42. Bibcode : 2006PNAS..10313837V . doi : 10.1073 / pnas.0600843103 . PMC 1564231 . PMID 16945916 .
- Shaw, Jeffrey Jon (1969). Os hemoflagelados das preguiças . HK Lewis: Londres.
- Ansari MY, Dikhit MR, Sahoo GC, Das P (2012). "Modelagem comparativa da enzima HGPRT de L. donovani e afinidades de ligação de diferentes análogos de GMP". Int J Biol Macromol . 50 (3): 637–49. doi : 10.1016 / j.ijbiomac.2012.01.010 . PMID 22327112 .
links externos
- A Rede Internacional de Leishmania (ILN) tem informações básicas sobre a doença e links para muitos aspectos da doença e seu vetor.
- Uma lista de discussão (Leish-L) também está disponível com mais de 600 assinantes da lista, variando de biólogos moleculares a profissionais de saúde pública, de muitos países dentro e fora de regiões endêmicas. Comentários e perguntas são bem-vindos.
- KBD: Kinetoplastid Biology and Disease , é um site dedicado à leishmaniose, doença do sono e doença de Chagas (tripanossomíase americana). Ele contém acesso gratuito a artigos revisados por pares em texto completo sobre esses assuntos. O site contém muitos artigos relacionados ao organelo cinetoplastídeo único e material genético nele contido.
- Reprodução sexual em parasitas Leishmania, breve revisão de um artigo "científico"
- Pesquisa de drogas para leishmaniose World Community Grid