Lítio - Lithium
 Lítio flutuando em óleo
| ||||||||||||||||
| Lítio | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronúncia |
/ L do ɪ q i ə m / ( LITH -ee-əm ) |
|||||||||||||||
| Aparência | branco prateado | |||||||||||||||
| Peso atômico padrão A r, std (Li) | [6,938 , 6,997 ] convencional: 6,94 | |||||||||||||||
| Lítio na tabela periódica | ||||||||||||||||
| ||||||||||||||||
| Número atômico ( Z ) | 3 | |||||||||||||||
| Grupo | grupo 1: hidrogênio e metais alcalinos | |||||||||||||||
| Período | período 2 | |||||||||||||||
| Bloquear | bloco s | |||||||||||||||
| Configuração de elétron | [ Ele ] 2s 1 | |||||||||||||||
| Elétrons por camada | 2, 1 | |||||||||||||||
| Propriedades físicas | ||||||||||||||||
| Fase em STP | sólido | |||||||||||||||
| Ponto de fusão | 453,65 K (180,50 ° C, 356,90 ° F) | |||||||||||||||
| Ponto de ebulição | 1603 K (1330 ° C, 2426 ° F) | |||||||||||||||
| Densidade (próximo à rt ) | 0,534 g / cm 3 | |||||||||||||||
| quando líquido (em mp ) | 0,512 g / cm 3 | |||||||||||||||
| Ponto crítico | 3220 K, 67 MPa (extrapolado) | |||||||||||||||
| Calor de fusão | 3,00 kJ / mol | |||||||||||||||
| Calor da vaporização | 136 kJ / mol | |||||||||||||||
| Capacidade de calor molar | 24,860 J / (mol · K) | |||||||||||||||
Pressão de vapor
| ||||||||||||||||
| Propriedades atômicas | ||||||||||||||||
| Estados de oxidação | +1 (umóxidofortemente básico ) | |||||||||||||||
| Eletro-negatividade | Escala de Pauling: 0,98 | |||||||||||||||
| Energias de ionização | ||||||||||||||||
| Raio atômico | empírico: 152 pm | |||||||||||||||
| Raio covalente | 128 ± 19h | |||||||||||||||
| Raio de Van der Waals | 182 pm | |||||||||||||||
| Linhas espectrais de lítio | ||||||||||||||||
| Outras propriedades | ||||||||||||||||
| Ocorrência natural | primordial | |||||||||||||||
| Estrutura de cristal | cúbica de corpo centrado (BCC) | |||||||||||||||
| Velocidade do som haste fina | 6000 m / s (a 20 ° C) | |||||||||||||||
| Expansão térmica | 46 µm / (m⋅K) (a 25 ° C) | |||||||||||||||
| Condutividade térmica | 84,8 W / (m⋅K) | |||||||||||||||
| Resistividade elétrica | 92,8 nΩ⋅m (a 20 ° C) | |||||||||||||||
| Ordenação magnética | paramagnético | |||||||||||||||
| Suscetibilidade magnética molar | +14,2 × 10 −6 cm 3 / mol (298 K) | |||||||||||||||
| Módulo de Young | 4,9 GPa | |||||||||||||||
| Módulo de cisalhamento | 4,2 GPa | |||||||||||||||
| Módulo de massa | 11 GPa | |||||||||||||||
| Dureza de Mohs | 0,6 | |||||||||||||||
| Dureza Brinell | 5 MPa | |||||||||||||||
| Número CAS | 7439-93-2 | |||||||||||||||
| História | ||||||||||||||||
| Descoberta | Johan August Arfwedson (1817) | |||||||||||||||
| Primeiro isolamento | William Thomas Brande (1821) | |||||||||||||||
| Isótopos principais de lítio | ||||||||||||||||
| ||||||||||||||||
Lítio (do grego : λίθος , romanizado : lithos , lit. 'pedra') é um elemento químico com o símbolo Li e o número atômico 3. É um metal alcalino macio e branco prateado . Sob condições padrão , é o metal mais leve e o elemento sólido mais leve. Como todos os metais alcalinos, o lítio é altamente reativo e inflamável e deve ser armazenado em vácuo, atmosfera inerte ou líquido inerte, como querosene purificado ou óleo mineral. Quando cortado, ele exibe um brilho metálico , mas o ar úmido o corrói rapidamente para um cinza prateado opaco e depois para uma mancha preta. Nunca ocorre livremente na natureza, mas apenas em compostos (geralmente iônicos) , como os minerais pegmatíticos , que já foram a principal fonte de lítio. Devido à sua solubilidade como íon, está presente na água do oceano e é comumente obtido a partir de salmouras . O metal de lítio é isolado eletroliticamente de uma mistura de cloreto de lítio e cloreto de potássio .
O núcleo do átomo de lítio beira a instabilidade, uma vez que os dois isótopos de lítio estáveis encontrados na natureza têm as energias de ligação mais baixas por núcleo de todos os nuclídeos estáveis . Por causa de sua relativa instabilidade nuclear, o lítio é menos comum no sistema solar do que 25 dos primeiros 32 elementos químicos, embora seus núcleos sejam muito leves: é uma exceção à tendência de que núcleos mais pesados sejam menos comuns. Por razões relacionadas, o lítio tem usos importantes na física nuclear . A transmutação de átomos de lítio em hélio em 1932 foi a primeira reação nuclear totalmente produzida pelo homem , e o deutereto de lítio serve como combustível de fusão em armas termonucleares encenadas .
O lítio e seus compostos têm várias aplicações industriais, incluindo vidro e cerâmica resistentes ao calor , lubrificantes com graxa de lítio , aditivos de fluxo para a produção de ferro, aço e alumínio, baterias de lítio e baterias de íon-lítio . Esses usos consomem mais de três quartos da produção de lítio.
O lítio está presente em sistemas biológicos em pequenas quantidades; suas funções são incertas. Os sais de lítio provaram ser úteis como um estabilizador do humor e antidepressivo no tratamento de doenças mentais, como o transtorno bipolar .
Propriedades
Atômico e físico
Os metais alcalinos também são chamados de família do lítio , devido ao seu elemento principal. Como os outros metais alcalinos (que são sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr)), o lítio tem um único elétron de valência que é facilmente cedido para formar um cátion . Por causa disso, o lítio é um bom condutor de calor e eletricidade, bem como um elemento altamente reativo, embora seja o menos reativo dos metais alcalinos. A baixa reatividade do lítio se deve à proximidade de seu elétron de valência ao núcleo (os dois elétrons restantes estão no orbital 1s , com energia muito menor e não participam de ligações químicas). O lítio fundido é significativamente mais reativo do que sua forma sólida.
O metal de lítio é macio o suficiente para ser cortado com uma faca. Quando cortado, possui uma cor branco prateada que rapidamente muda para cinza à medida que oxida para óxido de lítio . Seu ponto de fusão de 180,50 ° C (453,65 K; 356,90 ° F) e seu ponto de ebulição de 1.342 ° C (1.615 K; 2.448 ° F) são os mais altos de todos os metais alcalinos, enquanto sua densidade de 0,534 g/cm 3 é o mais baixo.
O lítio tem uma densidade muito baixa (0,534 g / cm 3 ), comparável à madeira de pinho . É o menos denso de todos os elementos que são sólidos à temperatura ambiente; o próximo elemento sólido mais leve (potássio, a 0,862 g / cm 3 ) é mais de 60% mais denso. Além do hélio e do hidrogênio , como sólido é menos denso do que qualquer outro elemento como líquido, sendo apenas dois terços da densidade do nitrogênio líquido (0,808 g / cm 3 ). O lítio pode flutuar nos óleos de hidrocarbonetos mais leves e é um dos três únicos metais que podem flutuar na água, sendo os outros dois o sódio e o potássio .
O coeficiente de expansão térmica do lítio é o dobro do alumínio e quase quatro vezes o do ferro . O lítio é supercondutor abaixo de 400 μK na pressão padrão e em temperaturas mais altas (mais de 9 K) em pressões muito altas (> 20 GPa). Em temperaturas abaixo de 70 K, o lítio, como o sódio, sofre transformações de mudança de fase sem difusão . A 4,2 K, tem um sistema de cristal romboédrico (com espaçamento de repetição de nove camadas); em temperaturas mais altas, ele se transforma em cúbico centrado na face e, em seguida , em cúbico centrado no corpo . Em temperaturas de hélio líquido (4 K), a estrutura romboédrica é predominante. Múltiplas formas alotrópicas foram identificadas para o lítio em altas pressões.
O lítio tem uma capacidade de calor específico de massa de 3,58 quilojoules por quilograma-kelvin, a maior de todos os sólidos. Por causa disso, o metal de lítio é frequentemente usado em refrigerantes para aplicações de transferência de calor .
Isótopos
O lítio de ocorrência natural é composto por dois isótopos estáveis , 6 Li e 7 Li, sendo o último o mais abundante (92,5% de abundância natural ). Ambos os isótopos naturais têm energia de ligação nuclear anormalmente baixa por núcleo (em comparação com os elementos vizinhos na tabela periódica , hélio e berílio ); o lítio é o único elemento de baixo número que pode produzir energia líquida por meio da fissão nuclear . Os dois núcleos de lítio têm energias de ligação mais baixas por núcleo do que qualquer outro nuclídeo estável diferente de deutério e hélio-3 . Como resultado disso, embora muito leve em peso atômico, o lítio é menos comum no Sistema Solar do que 25 dos primeiros 32 elementos químicos. Sete radioisótopos foram caracterizados, sendo o mais estável 8 Li com meia-vida de 838 ms e 9 Li com meia-vida de 178 ms. Todos os demais isótopos radioativos têm meias-vidas menores que 8,6 ms. O isótopo de menor duração do lítio é 4 Li, que decai pela emissão de prótons e tem meia-vida de 7,6 × 10 -23 s.
7 Li é um dos elementos primordiais (ou, mais propriamente, nuclídeos primordiais ) produzidos na nucleossíntese do Big Bang . Uma pequena quantidade de 6 Li e 7 Li é produzida nas estrelas durante a nucleossíntese estelar , mas é posteriormente queimada " queimada " tão rápido quanto produzida. 7 Li também pode ser gerado em estrelas de carbono . Pequenas quantidades adicionais de 6 Li e 7 Li podem ser geradas do vento solar, raios cósmicos atingindo átomos mais pesados e da decadência radioativa do sistema solar 7 Be e 10 Be.
Os isótopos de lítio se fracionam substancialmente durante uma ampla variedade de processos naturais, incluindo formação mineral (precipitação química), metabolismo e troca iônica . Íons de lítio substituem magnésio e ferro em sítios octaédricos em minerais de argila , onde 6 Li é preferido a 7 Li, resultando no enriquecimento do isótopo leve em processos de hiperfiltração e alteração de rochas. O exótico 11 Li é conhecido por exibir um halo nuclear . O processo conhecido como separação de isótopos a laser pode ser usado para separar isótopos de lítio, em particular 7 Li de 6 Li.
A fabricação de armas nucleares e outras aplicações de física nuclear são uma fonte importante de fracionamento artificial de lítio, com o isótopo leve 6 Li sendo retido pela indústria e estoques militares a tal ponto que causou uma mudança leve, mas mensurável nas razões de 6 Li para 7 Li em fontes naturais, como rios. Isso levou a uma incerteza incomum no peso atômico padronizado do lítio, uma vez que essa quantidade depende das proporções de abundância natural desses isótopos de lítio estáveis de ocorrência natural, pois eles estão disponíveis em fontes comerciais de minerais de lítio.
Ambos os isótopos estáveis de lítio podem ser resfriados a laser e foram usados para produzir a primeira mistura degenerada quântica de Bose - Fermi .
Ocorrência
Astronômico
Embora tenha sido sintetizado no Big Bang , o lítio (junto com o berílio e o boro) é nitidamente menos abundante no universo do que outros elementos. Isso é resultado das temperaturas estelares comparativamente baixas necessárias para destruir o lítio, junto com a falta de processos comuns para produzi-lo.
De acordo com a teoria cosmológica moderna, o lítio - em ambos os isótopos estáveis (lítio-6 e lítio-7) - foi um dos três elementos sintetizados no Big Bang. Embora a quantidade de lítio gerada na nucleossíntese do Big Bang dependa do número de fótons por bárion , para valores aceitos a abundância de lítio pode ser calculada, e há uma " discrepância cosmológica de lítio " no universo: estrelas mais velhas parecem ter menos lítio do que deveriam, e algumas estrelas mais jovens têm muito mais. A falta de lítio nas estrelas mais velhas é aparentemente causada pela "mistura" do lítio no interior das estrelas, onde é destruído, enquanto o lítio é produzido nas estrelas mais jovens. Embora transmute em dois átomos de hélio devido à colisão com um próton em temperaturas acima de 2,4 milhões de graus Celsius (a maioria das estrelas atinge facilmente essa temperatura em seu interior), o lítio é mais abundante do que os cálculos poderiam prever em estrelas de geração posterior.

O lítio também é encontrado em objetos subestelares anãs marrons e em certas estrelas laranja anômalas. Como o lítio está presente em anãs marrons mais frias e menos massivas, mas é destruído em estrelas anãs vermelhas mais quentes , sua presença nos espectros das estrelas pode ser usada no "teste de lítio" para diferenciar os dois, já que ambos são menores que o Sol . Certas estrelas laranja também podem conter uma alta concentração de lítio. Essas estrelas laranja que têm uma concentração de lítio maior do que o normal (como Centaurus X-4 ) orbitam objetos massivos - estrelas de nêutrons ou buracos negros - cuja gravidade evidentemente puxa lítio mais pesado para a superfície de uma estrela de hidrogênio-hélio, causando mais lítio a ser observado.
Em 27 de maio de 2020, os astrônomos relataram que as explosões clássicas de novas são produtoras galácticas de lítio-7.
Terrestre
Embora o lítio seja amplamente distribuído na Terra, ele não ocorre naturalmente na forma elementar devido à sua alta reatividade. O conteúdo total de lítio da água do mar é muito grande e é estimado em 230 bilhões de toneladas, onde o elemento existe em uma concentração relativamente constante de 0,14 a 0,25 partes por milhão (ppm), ou 25 micromolar ; concentrações mais altas que se aproximam de 7 ppm são encontradas perto de fontes hidrotermais .
As estimativas para o conteúdo da crosta terrestre variam de 20 a 70 ppm por peso. O lítio constitui cerca de 0,002 por cento da crosta terrestre. De acordo com o seu nome, o lítio forma uma pequena parte das rochas ígneas , com as maiores concentrações nos granitos . Os pegmatitos graníticos também fornecem a maior abundância de minerais contendo lítio, com espodumênio e petalita sendo as fontes mais comercialmente viáveis. Outro mineral significativo de lítio é a lepidolita, que agora é um nome obsoleto para uma série formada por polilitionita e trilitionita. Uma nova fonte de lítio é a argila de hectorita , cujo único desenvolvimento ativo é através da Western Lithium Corporation nos Estados Unidos. Com 20 mg de lítio por kg da crosta terrestre, o lítio é o 25º elemento mais abundante.
De acordo com o Manual de Lítio e Cálcio Natural , "O lítio é um elemento comparativamente raro, embora seja encontrado em muitas rochas e algumas salmouras, mas sempre em concentrações muito baixas. Há um número bastante grande de depósitos de minerais e salmouras de lítio, mas apenas comparativamente poucos deles têm valor comercial real ou potencial. Muitos são muito pequenos, outros são de qualidade muito baixa. "
Estima-se que o Chile (2020) tenha as maiores reservas de longe (9,2 milhões de toneladas), e a Austrália a maior produção anual (40.000 toneladas). Uma das maiores bases de reserva de lítio está na área de Salar de Uyuni , na Bolívia, que possui 5,4 milhões de toneladas. Outros fornecedores importantes incluem Austrália, Argentina e China. Em 2015, o Serviço Geológico Tcheco considerou todas as montanhas de minério na República Tcheca como província de lítio. Cinco depósitos estão registrados, um próximo ao Cínovec é considerado um depósito potencialmente econômico, com 160 mil toneladas de lítio. Em dezembro de 2019, a mineradora finlandesa Keliber Oy informou que seu depósito de lítio Rapasaari estimou reservas de minério provadas e prováveis de 5,280 milhões de toneladas.
Em junho de 2010, o The New York Times relatou que geólogos americanos estavam conduzindo pesquisas terrestres em lagos de sal seco no oeste do Afeganistão, acreditando que grandes depósitos de lítio estavam localizados lá. Essas estimativas são "baseadas principalmente em dados antigos, que foram coletados principalmente pelos soviéticos durante a ocupação do Afeganistão de 1979 a 1989". O Ministério da Defesa dos Estados Unidos estimou as reservas de lítio no Afeganistão em igual às da Bolívia e apelidou-as de uma potencial "Arábia Saudita de lítio". Na Cornualha , Inglaterra, a presença de salmoura rica em lítio era bem conhecida devido à indústria de mineração histórica da região , e investidores privados realizaram testes para investigar a potencial extração de lítio nesta área.
Biológico
O lítio é encontrado em pequenas quantidades em várias plantas, plâncton e invertebrados, em concentrações de 69 a 5.760 partes por bilhão (ppb). Em vertebrados, a concentração é ligeiramente mais baixa e quase todos os tecidos e fluidos corporais de vertebrados contêm lítio variando de 21 a 763 ppb. Os organismos marinhos tendem a bioacumular o lítio mais do que os organismos terrestres. Não se sabe se o lítio tem um papel fisiológico em qualquer um desses organismos.
Estudos de concentrações de lítio em solos ricos em minerais fornecem intervalos entre 0,1 e 50-100 ppm , com algumas concentrações tão altas quanto 100-400 ppm, embora seja improvável que tudo esteja disponível para absorção pelas plantas . A concentração de lítio no tecido vegetal é normalmente em torno de 1 ppm , com algumas famílias de plantas bioacumulando mais lítio do que outras; O acúmulo de lítio não parece afetar a composição de nutrientes essenciais das plantas. A tolerância ao lítio varia de acordo com a espécie de planta e normalmente é paralela à tolerância ao sódio ; o milho e a grama Rhodes , por exemplo, são altamente tolerantes aos danos do lítio, enquanto o abacate e a soja são muito sensíveis. Da mesma forma, o lítio em concentrações de 5 ppm reduz a germinação das sementes em algumas espécies (por exemplo, arroz asiático e grão de bico ), mas não em outras (por exemplo, cevada e trigo ). Muitos dos principais efeitos biológicos do lítio podem ser explicados por sua competição com outros íons. O íon de lítio monovalente Li +
compete com outros íons, como o sódio (imediatamente abaixo do lítio na tabela periódica ), que, assim como o lítio, também é um metal alcalino monovalente . O lítio também compete com os íons de magnésio bivalentes , cujo raio iônico (86 pm ) é aproximadamente igual ao do íon lítio (90 pm). Os mecanismos que transportam sódio através das membranas celulares também transportam o lítio. Por exemplo, os canais de sódio ( dependentes de voltagem e epiteliais ) são vias de entrada particularmente importantes para o lítio. Os íons de lítio também podem permear através de canais de íons controlados por ligante , bem como atravessar as membranas nuclear e mitocondrial . Como o sódio, o lítio pode entrar e bloquear parcialmente (embora não permeie ) os canais de potássio e de cálcio . Os efeitos biológicos do lítio são muitos e variados, mas seus mecanismos de ação são apenas parcialmente compreendidos. Por exemplo, estudos de pacientes tratados com lítio com transtorno bipolar mostram que, entre muitos outros efeitos, o lítio reverte parcialmente o encurtamento do telômero nesses pacientes e também aumenta a função mitocondrial, embora como o lítio produz esses efeitos farmacológicos não seja compreendido. Mesmo os mecanismos exatos envolvidos na toxicidade do lítio não são totalmente compreendidos.
História
A petalita (LiAlSi 4 O 10 ) foi descoberta em 1800 pelo químico e estadista brasileiro José Bonifácio de Andrada e Silva em uma mina na ilha de Utö , na Suécia. No entanto, não foi até 1817 que Johan August Arfwedson , então trabalhando no laboratório do químico Jöns Jakob Berzelius , detectou a presença de um novo elemento ao analisar o minério de petalita. Esse elemento formava compostos semelhantes aos do sódio e do potássio , embora seu carbonato e hidróxido fossem menos solúveis em água e menos alcalinos . Berzelius deu ao material alcalino o nome de " litião / litina ", da palavra grega λιθoς (transliterada como lithos , que significa "pedra"), para refletir sua descoberta em um mineral sólido, em oposição ao potássio, que foi descoberto nas cinzas das plantas e sódio, conhecido em parte por sua grande abundância no sangue animal. Ele chamou o metal dentro do material de "lítio".
Arfwedson mais tarde mostrou que esse mesmo elemento estava presente nos minerais espodumênio e lepidolita . Em 1818, Christian Gmelin foi o primeiro a observar que os sais de lítio dão uma cor vermelha brilhante à chama. No entanto, tanto Arfwedson quanto Gmelin tentaram e não conseguiram isolar o elemento puro de seus sais. Não foi isolado até 1821, quando William Thomas Brande o obteve por eletrólise de óxido de lítio , processo que já havia sido empregado pelo químico Sir Humphry Davy para isolar os metais alcalinos potássio e sódio. Brande também descreveu alguns sais puros de lítio, como o cloreto, e, estimando que a lítio ( óxido de lítio ) continha cerca de 55% de metal, estimou o peso atômico do lítio em cerca de 9,8 g / mol (valor moderno ~ 6,94 g / mol ) Em 1855, maiores quantidades de lítio foram produzidas através da eletrólise do cloreto de lítio por Robert Bunsen e Augustus Matthiessen . A descoberta desse procedimento levou à produção comercial de lítio em 1923 pela empresa alemã Metallgesellschaft AG , que realizava uma eletrólise de uma mistura líquida de cloreto de lítio e cloreto de potássio .
O psiquiatra australiano John Cade é creditado por reintroduzir e popularizar o uso de lítio para tratar mania em 1949. Pouco depois, em meados do século 20, a aplicabilidade estabilizadora de humor do lítio para mania e depressão decolou na Europa e nos Estados Unidos.
A produção e o uso de lítio sofreram várias mudanças drásticas na história. A primeira grande aplicação de lítio foi em graxas de lítio de alta temperatura para motores de aeronaves e aplicações semelhantes na Segunda Guerra Mundial e logo depois. Esse uso foi apoiado pelo fato de que os sabões à base de lítio têm um ponto de fusão mais alto do que outros sabões alcalinos e são menos corrosivos do que os sabões à base de cálcio. A pequena demanda por sabões de lítio e graxas lubrificantes foi sustentada por várias pequenas operações de mineração, principalmente nos Estados Unidos.
A demanda por lítio aumentou dramaticamente durante a Guerra Fria com a produção de armas de fusão nuclear . Tanto o lítio-6 quanto o lítio-7 produzem trítio quando irradiado por nêutrons e, portanto, são úteis para a produção de trítio por si só, bem como uma forma de combustível de fusão sólido usado dentro de bombas de hidrogênio na forma de deutereto de lítio . Os Estados Unidos se tornaram o principal produtor de lítio entre o final dos anos 1950 e meados dos anos 1980. No final, o estoque de lítio era de aproximadamente 42.000 toneladas de hidróxido de lítio. O lítio armazenado estava esgotado em lítio-6 em 75%, o que foi suficiente para afetar o peso atômico medido do lítio em muitos produtos químicos padronizados e até mesmo o peso atômico do lítio em algumas "fontes naturais" de íon de lítio que haviam sido "contaminadas "por sais de lítio descarregados de instalações de separação de isótopos, que encontraram seu caminho para as águas subterrâneas.
O lítio é usado para diminuir a temperatura de fusão do vidro e para melhorar o comportamento de fusão do óxido de alumínio no processo Hall-Héroult . Esses dois usos dominaram o mercado até meados da década de 1990. Após o fim da corrida armamentista nuclear , a demanda por lítio diminuiu e a venda do departamento de estoques de energia no mercado aberto reduziu ainda mais os preços. Em meados da década de 1990, várias empresas começaram a isolar o lítio da salmoura, o que provou ser uma opção menos cara do que a mineração subterrânea ou a céu aberto. A maioria das minas fechou ou mudou seu foco para outros materiais porque apenas o minério de pegmatitos zoneados poderia ser extraído por um preço competitivo. Por exemplo, as minas americanas perto de Kings Mountain , na Carolina do Norte, fecharam antes do início do século XXI.
O desenvolvimento de baterias de íon de lítio aumentou a demanda por lítio e se tornou o uso dominante em 2007. Com o aumento da demanda por lítio nas baterias na década de 2000, novas empresas expandiram os esforços de isolamento de salmoura para atender à crescente demanda.
Argumenta-se que o lítio será um dos principais objetos de competição geopolítica em um mundo movido a energias renováveis e dependente de baterias, mas essa perspectiva também tem sido criticada por subestimar o poder dos incentivos econômicos para a expansão da produção.
Propriedades do elemento

Quando colocados sobre uma chama, os compostos de lítio emitem uma cor carmesim impressionante, mas quando o metal queima fortemente, a chama se torna uma prata brilhante. O lítio entra em ignição e queima em oxigênio quando exposto a água ou vapores de água.
Química
De metal de lítio
O lítio reage com a água facilmente, mas notavelmente com menos vigor do que outros metais alcalinos. A reação forma gás hidrogênio e hidróxido de lítio . No ar úmido, o lítio mancha rapidamente para formar uma camada preta de hidróxido de lítio (LiOH e LiOH · H 2 O), nitreto de lítio (Li 3 N) e carbonato de lítio (Li 2 CO 3 , o resultado de uma reação secundária entre LiOH e CO 2 ). O lítio é um dos poucos metais que reagem com o gás nitrogênio .
Por causa de sua reatividade com água, e especialmente nitrogênio, o metal de lítio é geralmente armazenado em um selante de hidrocarboneto, geralmente vaselina . Embora os metais alcalinos mais pesados possam ser armazenados sob o óleo mineral , o lítio não é denso o suficiente para submergir totalmente nesses líquidos.
O lítio tem uma relação diagonal com o magnésio , um elemento de raio atômico e iônico semelhante . As semelhanças químicas entre os dois metais incluem a formação de um nitreto por reação com N 2 , a formação de um óxido ( Li
2O ) e peróxido ( Li
2O
2) quando queimado em O 2 , sais com solubilidades semelhantes e instabilidade térmica dos carbonatos e nitretos. O metal reage com o gás hidrogênio em altas temperaturas para produzir hidreto de lítio (LiH).
O lítio forma uma variedade de materiais binários e ternários por reação direta com os elementos do grupo principal. Estas fases Zintl , embora altamente covalentes, podem ser vistas como sais de ânions poliatômicos como Si 4 4- , P 7 3- e Te 5 2- . Com a grafite, o lítio forma uma variedade de compostos de intercalação .
Ele se dissolve em amônia (e aminas) para dar [Li (NH 3 ) 4 ] + e o elétron solvatado .
Compostos inorgânicos
O lítio forma derivados semelhantes a sal com todos os halogenetos e pseudohalides. Alguns exemplos incluem os haletos LiF , LiCl , LiBr , LiI , bem como os pseudohaletos e ânions relacionados. O carbonato de lítio foi descrito como o composto mais importante de lítio. Este sólido branco é o principal produto do beneficiamento de minérios de lítio. É um precursor de outros sais, incluindo cerâmicas e materiais para baterias de lítio.
Os compostos LiBH
4e LiAlH
4são reagentes úteis . Esses sais e muitos outros sais de lítio exibem uma solubilidade distintamente alta em éteres, em contraste com os sais de metais alcalinos mais pesados.
Em solução aquosa, o complexo de coordenação [Li (H 2 O) 4 ] + predomina para muitos sais de lítio. Complexos relacionados são conhecidos com aminas e éteres.
Química orgânica
Os compostos de organolítio são numerosos e úteis. Eles são definidos pela presença de uma ligação entre o carbono e o lítio. Eles servem como carbânions estabilizados por metal , embora sua solução e estruturas de estado sólido sejam mais complexas do que essa visão simplista. Portanto, essas são bases e nucleófilos extremamente poderosos . Eles também têm sido aplicados em síntese assimétrica na indústria farmacêutica. Para a síntese orgânica de laboratório, muitos reagentes de organolítio estão disponíveis comercialmente na forma de solução. Esses reagentes são altamente reativos e, às vezes, pirofóricos.
Como seus compostos inorgânicos, quase todos os compostos orgânicos de lítio seguem formalmente a regra do dueto (por exemplo, BuLi, MeLi). No entanto, é importante notar que, na ausência de solventes ou ligantes de coordenação, os compostos de organolítio formam clusters diméricos, tetraméricos e hexaméricos (por exemplo, BuLi é na verdade [BuLi] 6 e MeLi é na verdade [MeLi] 4 ) que apresentam multi- ligação central e aumentar o número de coordenação em torno do lítio. Esses aglomerados são divididos em unidades menores ou monoméricas na presença de solventes como dimetoxietano (DME) ou ligantes como tetrametiletilenodiamina (TMEDA). Como uma exceção à regra do dueto, um complexo de litato de duas coordenadas com quatro elétrons ao redor do lítio, [Li (thf) 4 ] + [((Me 3 Si) 3 C) 2 Li] - , foi caracterizado cristalograficamente.
Produção
A produção de lítio aumentou muito desde o final da Segunda Guerra Mundial . As principais fontes de lítio são salmouras e minérios.
O metal de lítio é produzido através da eletrólise de uma mistura de 55% de cloreto de lítio fundido e 45% de cloreto de potássio a cerca de 450 ° C.
Reservas e ocorrência
As reservas mundiais identificadas em 2020 e 2021 foram estimadas pelo US Geological Survey (USGS) em 17 milhões e 21 milhões de toneladas , respectivamente. Uma estimativa precisa das reservas mundiais de lítio é difícil. Uma razão para isso é que a maioria dos esquemas de classificação de lítio são desenvolvidos para depósitos de minério sólido, enquanto a salmoura é um fluido que é problemático para tratar com o mesmo esquema de classificação devido a concentrações variáveis e efeitos de bombeamento.
Os recursos mundiais de lítio identificados pelo USGS começaram a aumentar em 2017 devido à exploração contínua. Os recursos identificados em 2016, 2017, 2018, 2019 e 2020 foram de 41, 47, 54, 62 e 80 milhões de toneladas, respectivamente.
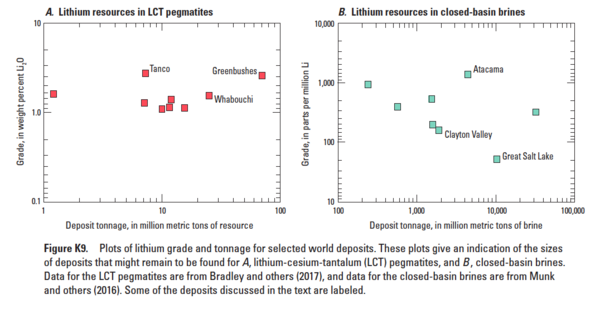
O mundo em 2013 foi estimado para conter cerca de 15 milhões de toneladas de reservas de lítio, enquanto 65 milhões de toneladas de recursos conhecidos eram razoáveis. Um total de 75% de tudo normalmente pode ser encontrado nos dez maiores depósitos do mundo. Outro estudo observou que 83% dos recursos geológicos de lítio estão localizados em seis salmouras, dois pegmatitos e dois depósitos sedimentares.
Nos EUA, o lítio é recuperado de piscinas de salmoura em Nevada . Estima-se que um depósito descoberto em 2013 em Rock Springs Uplift, em Wyoming, contenha 228.000 toneladas. Os depósitos adicionais na mesma formação foram estimados em até 18 milhões de toneladas.
Triângulo de lítio
Os quatro principais países produtores de lítio do mundo em 2019, conforme relatado pelo US Geological Survey, são Austrália, Chile, China e Argentina. A intersecção do Chile , Bolívia e Argentina forma a região conhecida como Triângulo de Lítio . O Triângulo de Lítio é conhecido por suas salinas de alta qualidade, incluindo o Salar de Uyuni da Bolívia, o Salar de Atacama do Chile e o Salar de Arizaro da Argentina . Acredita-se que o Triângulo de Lítio contenha mais de 75% das reservas conhecidas de lítio existentes. Depósitos são encontrados na América do Sul ao longo da cordilheira dos Andes . O Chile é o maior produtor, seguido pela Argentina. Ambos os países recuperam lítio de piscinas de salmoura. De acordo com o USGS, o deserto de Uyuni , na Bolívia, tem 5,4 milhões de toneladas de lítio. Metade das reservas conhecidas do mundo estão localizadas na Bolívia, ao longo da encosta centro-leste dos Andes. Desde 2009, o governo boliviano busca investidores para o desenvolvimento da mina Salar de Uyuni , entre os quais empresas japonesas, francesas e coreanas. Em 2019, a estatal boliviana YLB assinou um contrato com a alemã ACI Systems estimado em US $ 1,2 bilhão para construir usinas de hidróxido de lítio e baterias de íon-lítio, mas rapidamente desistiu do negócio.
| País | Produção | Reservas | Recursos |
|---|---|---|---|
| Argentina | 6.200 | 1.900.000 | 19.300.000 |
| Austrália | 40.000 | 4.700.000 | 6.400.000 |
| Áustria | - | - | 50.000 |
| Bolívia | - | - | 21.000.000 |
| Brasil | 1.900 | 95.000 | 470.000 |
| Canadá | 0 | 530.000 | 2.900.000 |
| Chile | 18.000 | 9.200.000 | 9.600.000 |
| República Checa | - | - | 1.300.000 |
| RD congo | - | - | 3.000.000 |
| Finlândia | - | - | 50.000 |
| Alemanha | - | - | 2.700.000 |
| Gana | - | - | 90.000 |
| Cazaquistão | - | - | 50.000 |
| Mali | - | - | 700.000 |
| México | - | - | 1.700.000 |
| Namibia | - | - | 50.000 |
| República Popular da China | 14.000 | 1.500.000 | 5.100.000 |
| Peru | - | - | 880.000 |
| Portugal | 900 | 60.000 | 270.000 |
| Sérvia | - | - | 1.200.000 |
| Espanha | - | - | 300.000 |
| Estados Unidos | 870 | 750.000 | 7.900.000 |
| Zimbábue | 1.200 | 220.000 | 500.000 |
| Total mundial | 82.000 | 21.000.000 | 86.000.000+ |
Desde 2018, a República Democrática do Congo é conhecida por ter o maior depósito de rocha dura de lítio espodumênio do mundo. O recurso total do depósito localizado em Manono, região central da RDC , tem o potencial de ser da ordem de 1,5 bilhão de toneladas de rocha dura de espodumênio de lítio. Os dois maiores pegmatitos (conhecidos como Carriere de l'Este Pegmatite e Roche Dure Pegmatite) são cada um de tamanho semelhante ou maior do que o famoso Greenbushes Pegmatite na Austrália Ocidental. Em um futuro próximo, em 2023, a República Democrática do Congo deverá ser um fornecedor significativo de lítio para o mundo com seu alto teor e baixo teor de impurezas.
De acordo com um estudo posterior de 2011 do Lawrence Berkeley National Laboratory e da University of California, Berkeley , a então base de reserva estimada de lítio não deve ser um fator limitante para a produção de baterias em grande escala para veículos elétricos porque estima-se que 1 bilhão de 40 kWh Li baterias baseadas poderiam ser construídas com essas reservas - cerca de 10 kg de lítio por carro. Outro estudo de 2011 da Universidade de Michigan e da Ford Motor Company encontrou recursos suficientes para atender à demanda global até 2100, incluindo o lítio necessário para o uso potencial de transporte generalizado. O estudo estimou as reservas globais em 39 milhões de toneladas e a demanda total de lítio durante o período de 90 anos anualizada em 12–20 milhões de toneladas, dependendo dos cenários de crescimento econômico e taxas de reciclagem.
Em 2014, o The Financialist afirmou que a demanda por lítio crescia a mais de 12% ao ano. De acordo com o Credit Suisse, essa taxa superou a disponibilidade projetada em 25%. A publicação comparou a situação do lítio com o petróleo em 2014, segundo a qual "os preços mais altos do petróleo estimularam o investimento em técnicas caras de produção em águas profundas e areias betuminosas"; isto é, o preço do lítio continuaria a subir até que métodos de produção mais caros, que poderiam aumentar a produção total, recebessem a atenção dos investidores.
Em 16 de julho de 2018, 2,5 milhões de toneladas de recursos de lítio de alto grau e 124 milhões de libras de recursos de urânio foram encontrados no depósito de rocha dura de Falchani na região de Puno, Peru.
Em 2019, a produção mundial de lítio de espodumênio foi de cerca de 80.000 t por ano, principalmente do pegmatito Greenbushes e de algumas fontes chinesas e chilenas . A mina Talison em Greenbushes é relatada como a maior e com o maior teor de minério com 2,4% Li 2 O (números de 2012).
Estima-se que os oceanos contenham 230 bilhões de toneladas de lítio, mas a concentração é de 0,1-0,2 ppm, tornando mais caro isolar com a tecnologia de 2020 do que com salmoura e rochas terrestres.
Fontes
Outra fonte potencial de lítio A partir de 2012 foi identificada como os lixiviados de poços geotérmicos , que são transportados para a superfície. A recuperação deste tipo de lítio foi demonstrada no campo; o lítio é separado por filtração simples. As reservas são mais limitadas do que as dos reservatórios de salmoura e rochas duras.
Preços
Em 1998, o preço do metal de lítio era de cerca de 95 USD / kg (ou US $ 43 / lb ). Após a crise financeira de 2007 , grandes fornecedores, como a Sociedad Química y Minera (SQM), baixaram os preços do carbonato de lítio em 20%. Os preços subiram em 2012. Um artigo da Business Week de 2012 descreveu um oligopólio no setor de lítio: "SQM, controlada pelo bilionário Julio Ponce , é a segunda maior, seguida pela Rockwood , que é apoiada pela KKR & Co. de Henry Kravis , e pela Filadélfia com base na FMC ", sendo Talison mencionado como o maior produtor. O consumo global pode saltar para 300.000 toneladas métricas por ano até 2020 de cerca de 150.000 toneladas em 2012, para corresponder à demanda por baterias de lítio que tem crescido cerca de 25% ao ano, ultrapassando o ganho geral de 4% a 5% na produção de lítio.
Extração
De lítio e seus compostos foram historicamente isolado e extraiu-se a partir de rocha dura, mas na década de 1990 fontes de água mineral , salmoura piscinas, e depósitos de salmoura tinha-se tornado a fonte dominante. A maioria deles foi no Chile, Argentina e Bolívia.
No início de 2021, grande parte do lítio extraído globalmente vem de " espodumênio , o mineral contido em rochas duras encontradas em lugares como Austrália e Carolina do Norte" ou da salmoura bombeada diretamente do solo, como está em locais em Chile.
Espera-se que os cátodos de baixo teor de cobalto para baterias de lítio requeiram hidróxido de lítio em vez de carbonato de lítio como matéria-prima, e essa tendência favorece a rocha como fonte.
Em um método de fazer intermediários de lítio a partir da salmoura, a salmoura é primeiro bombeada de piscinas subterrâneas e concentrada por evaporação solar. Quando a concentração de lítio é suficiente, o carbonato de lítio e o hidróxido de lítio são precipitados pela adição de carbonato de sódio e hidróxido de cálcio, respectivamente. Cada lote leva de 18 a 24 meses.
O uso de eletrodiálise e intercalação eletroquímica foi proposto para extrair compostos de lítio da água do mar (que contém lítio a 0,2 partes por milhão ), mas ainda não é comercialmente viável.
Problemas ambientais
Os processos de fabricação de lítio, incluindo o solvente e resíduos de mineração , apresentam riscos ambientais e de saúde significativos. A extração de lítio pode ser fatal para a vida aquática devido à poluição da água . É conhecido por causar contaminação das águas superficiais, contaminação da água potável, problemas respiratórios, degradação do ecossistema e danos à paisagem. Também leva a um consumo insustentável de água em regiões áridas (1,9 milhão de litros por tonelada de lítio). A geração maciça de subprodutos da extração de lítio também apresenta problemas não resolvidos, como grandes quantidades de magnésio e resíduos de cal .
Nos Estados Unidos, há uma competição ativa entre a mineração a céu aberto ambientalmente catastrófica , a mineração de remoção do topo de montanhas e a mineração de extração de salmoura menos prejudicial em um esforço para expandir drasticamente a capacidade doméstica de mineração de lítio. As preocupações ambientais incluem a degradação do habitat da vida selvagem, poluição da água potável, incluindo contaminação por arsênio e antimônio , redução do lençol freático insustentável e resíduos de mineração em massa , incluindo subproduto de urânio radioativo e descarga de ácido sulfúrico .
Investimento
Várias opções estão disponíveis no mercado para investir no metal. Embora a compra de ações físicas de lítio seja dificilmente possível, os investidores podem comprar ações de empresas que atuam na mineração e produção de lítio. Além disso, os investidores podem comprar um ETF de lítio dedicado oferecendo exposição a um grupo de produtores de commodities.
Com o crescimento substancial da demanda por lítio ocorrendo na década de 2020, as empresas de mineração e produção de lítio estão crescendo e algumas estão experimentando aumentos marcantes na avaliação de mercado. Os preços das ações de Lithium Americas, Piedmont Lithium , AVZ Minerals e MP Materials aumentaram substancialmente como resultado da crescente importância do lítio para a economia global. Em 2021, a AVZ Minerals, uma empresa australiana, está desenvolvendo o projeto Manono Lithium and Tin em Manono, na República Democrática do Congo , o recurso tem alto teor de impurezas baixas em 1,65% Li2O (óxido de lítio) espodumênio de rocha dura com base em estudos e perfuração de Roche Dure, um dos vários pegmatitos do depósito. Há um impulso global da UE e dos principais fabricantes de automóveis ( OEM ) para que todo o lítio seja produzido e adquirido de forma sustentável com iniciativas ESG e pegada de carbono zero a baixa . O projeto AVZ Minerals Manono concluiu um estudo de efeito estufa de GEE em 2021 em sua pegada de carbono futura. Isso se tornou mais comum agora para as empresas da cadeia de suprimentos de baterias cumprirem práticas ambientais, sociais e de governança (ESG) , práticas sustentáveis, conformidade com regulamentações ambientais do governo, EIA e desempenho de pegada de carbono baixo, a fim de serem consideradas para atividades de financiamento / investimento e carteiras de fundos. Investimentos responsáveis são essenciais para ajudar a cumprir o Acordo de Paris e os ODS da ONU. O estudo mostra que o projeto AVZ Minerals DRC Manono provavelmente tem uma das pegadas de carbono mais baixas de todos os produtores de rocha dura de espodumênio por 30% a 40% e alguns produtores de salmoura em todo o mundo. A AVZ Minerals assinou uma parceria de longo prazo com a maior Ganfeng Lithium, o maior produtor de compostos de lítio da China. É importante ressaltar que a parceria prevê que ambas as partes se concentrem no desenvolvimento ambiental, social e de governança (ESG) .
No início de 2021, Piedmont Lithium Ltd - uma empresa australiana fundada em 2016 - está explorando 2.300 acres (930 ha) de terras que possui ou tem direitos minerais no Condado de Gaston, Carolina do Norte . "A moderna indústria de mineração de lítio começou nesta região da Carolina do Norte na década de 1950, quando o metal era usado para fazer componentes para bombas nucleares . Uma das maiores mineradoras de lítio do mundo, a Albemarle Corp , está sediada nas proximidades de Charlotte. Quase todos de seu lítio, no entanto, é extraído na Austrália e no Chile, que têm depósitos grandes e acessíveis do metal. " Em 2021, apenas um por cento do fornecimento global de lítio era extraído e processado nos Estados Unidos (3.150 t (6.940.000 lb)), enquanto 233.550 t (514.890.000 lb) eram produzidos na Austrália e no Chile.
Espera-se que o lítio seja reciclado das baterias de íon-lítio no fim da vida útil no futuro, mas em 2020, não havia quantidades suficientes de baterias para reciclar e a tecnologia não estava bem desenvolvida. Em qualquer caso, o componente mais valioso provavelmente continuará sendo o material do cátodo do NCM , e a recuperação desse material deverá ser o acionador.
Formulários
Baterias
Em 2021, a maior parte do lítio é usada para fabricar baterias de íon-lítio para carros elétricos e dispositivos móveis .
Cerâmica e vidro
O óxido de lítio é amplamente utilizado como fundente para processamento de sílica , reduzindo o ponto de fusão e a viscosidade do material e levando a vidrados com propriedades físicas aprimoradas, incluindo baixos coeficientes de expansão térmica. Em todo o mundo, este é um dos maiores usos para compostos de lítio. Esmaltes contendo óxidos de lítio são usados para loiça. Carbonato de lítio (Li 2 CO 3 ) é geralmente usado nesta aplicação porque se converte em óxido ao ser aquecido.
Elétrica e Eletrônica
No final do século 20, o lítio se tornou um componente importante dos eletrólitos e eletrodos da bateria, devido ao seu alto potencial de eletrodo . Por causa de sua baixa massa atômica , ele tem uma alta relação carga e potência / peso. Uma bateria de íon de lítio típica pode gerar aproximadamente 3 volts por célula, em comparação com 2,1 volts para chumbo-ácido e 1,5 volts para zinco-carbono . Baterias de iões de lítio, os quais são recarregáveis e têm uma alta densidade de energia , diferem das pilhas de lítio , que são descartáveis ( primários ) baterias com lítio ou os seus compostos como o ânodo . Outras baterias recarregáveis que usam lítio incluem a bateria de polímero de íon de lítio , a bateria de fosfato de ferro de lítio e a bateria de nanofio .
Ao longo dos anos, as opiniões divergem sobre o crescimento potencial. Um estudo de 2008 concluiu que "a produção de carbonato de lítio realisticamente alcançável seria suficiente para apenas uma pequena fração das necessidades futuras do mercado global de PHEV e EV ", que "a demanda do setor de eletrônicos portáteis absorverá grande parte dos aumentos de produção planejados na próxima década" , e que "a produção em massa de carbonato de lítio não é ambientalmente saudável, causará danos ecológicos irreparáveis aos ecossistemas que devem ser protegidos e que a propulsão de LiIon é incompatível com a noção de 'Carro Verde'".
Graxas lubrificantes
O terceiro uso mais comum de lítio é em graxas. O hidróxido de lítio é uma base forte e, quando aquecido com uma gordura, produz um sabão de estearato de lítio . O sabão de lítio tem a capacidade de engrossar óleos e é usado na fabricação de graxas lubrificantes de alta temperatura para todos os fins .
Metalurgia
O lítio (por exemplo, como carbonato de lítio) é usado como um aditivo para escórias de fluxo de molde de fundição contínua, onde aumenta a fluidez, um uso que representa 5% do uso global de lítio (2011). Compostos de lítio também são usados como aditivos (fluxos) para fundir areia para fundição de ferro para reduzir veios.
O lítio (como fluoreto de lítio ) é utilizado como aditivo em fundições de alumínio ( processo Hall-Héroult ), reduzindo a temperatura de fusão e aumentando a resistência elétrica, uso que representa 3% da produção (2011).
Quando utilizado como fundente para soldagem ou soldagem , o lítio metálico promove a fusão dos metais durante o processo e elimina a formação de óxidos ao absorver as impurezas. Ligas de metal com alumínio, cádmio , cobre e manganês são usadas para fazer peças de aeronaves de alto desempenho (ver também ligas de alumínio e lítio ).
Nanossoldagem de silício
O lítio foi considerado eficaz em auxiliar no aperfeiçoamento das nanossoldas de silício em componentes eletrônicos para baterias elétricas e outros dispositivos.

Pirotecnia
Os compostos de lítio são usados como corantes pirotécnicos e oxidantes em fogos de artifício e foguetes vermelhos .
Purificação de ar
O cloreto de lítio e o brometo de lítio são higroscópicos e são usados como dessecantes para fluxos de gás. Hidróxido de lítio e peróxido de lítio são os sais mais usados em áreas confinadas, como a bordo de espaçonaves e submarinos , para remoção de dióxido de carbono e purificação do ar. O hidróxido de lítio absorve o dióxido de carbono do ar formando carbonato de lítio e é preferido a outros hidróxidos alcalinos por seu baixo peso.
O peróxido de lítio (Li 2 O 2 ) na presença de umidade não apenas reage com o dióxido de carbono para formar carbonato de lítio, mas também libera oxigênio. A reação é a seguinte:
- 2 Li 2 O 2 + 2 CO 2 → 2 Li 2 CO 3 + O 2 .
Alguns dos compostos mencionados, assim como o perclorato de lítio , são usados em velas de oxigênio que fornecem oxigênio aos submarinos . Isso também pode incluir pequenas quantidades de boro , magnésio , alumínio , silício , titânio , manganês e ferro .
Óptica
O fluoreto de lítio , cultivado artificialmente como cristal , é límpido e transparente e frequentemente usado em ópticas especializadas para aplicações de infravermelho , UV e VUV ( UV a vácuo ). Ele tem um dos índices de refração mais baixos e a maior faixa de transmissão na radiação ultravioleta profunda da maioria dos materiais comuns. O pó de fluoreto de lítio finamente dividido tem sido utilizado para dosimetria de radiação termoluminescente (TLD): quando uma amostra deste é exposta à radiação, ela acumula defeitos de cristal que, quando aquecidos, se resolvem por meio de uma liberação de luz azulada cuja intensidade é proporcional à dose absorvida , permitindo assim que seja quantificado. O fluoreto de lítio às vezes é usado em lentes focais de telescópios .
A alta não linearidade do niobato de lítio também o torna útil em aplicações ópticas não lineares . É amplamente utilizado em produtos de telecomunicações, como telefones celulares e moduladores ópticos , para componentes como cristais ressonantes . Os aplicativos de lítio são usados em mais de 60% dos telefones celulares.
Química orgânica e de polímeros
Os compostos de organolítio são amplamente usados na produção de polímeros e produtos químicos finos. Na indústria de polímeros, que é o consumidor dominante desses reagentes, os compostos de alquil-lítio são catalisadores / iniciadores . na polimerização aniônica de olefinas não funcionalizadas . Para a produção de produtos químicos finos, os compostos de organolítio funcionam como bases fortes e como reagentes para a formação de ligações carbono-carbono . Os compostos de organolítio são preparados a partir de metal de lítio e halogenetos de alquila.
Muitos outros compostos de lítio são usados como reagentes para preparar compostos orgânicos. Alguns compostos populares incluem hidreto de alumínio e lítio (LiAlH 4 ), trietilboro-hidreto de lítio , n-butil-lítio e terc-butil-lítio .
Militares
O lítio metálico e seus hidretos complexos , como Li [AlH 4 ] , são usados como aditivos de alta energia para propelentes de foguetes . O hidreto de alumínio e lítio também pode ser usado sozinho como combustível sólido .
O sistema de propulsão de energia química armazenada por torpedo Mark 50 (SCEPS) usa um pequeno tanque de hexafluoreto de enxofre , que é pulverizado sobre um bloco de lítio sólido. A reação gera calor, criando vapor para impulsionar o torpedo em um ciclo fechado de Rankine .
O hidreto de lítio contendo lítio-6 é usado em armas termonucleares , onde serve como combustível para a fase de fusão da bomba.
Nuclear
O lítio-6 é valorizado como uma fonte de material para a produção de trítio e como um absorvedor de nêutrons na fusão nuclear . O lítio natural contém cerca de 7,5% de lítio-6, do qual grandes quantidades de lítio-6 foram produzidas por separação de isótopos para uso em armas nucleares . O lítio-7 ganhou interesse para uso em refrigerantes de reatores nucleares .

O deutereto de lítio era o combustível de fusão preferido nas primeiras versões da bomba de hidrogênio . Quando bombardeados por nêutrons , tanto 6 Li quanto 7 Li produzem trítio - essa reação, que não foi totalmente compreendida quando as bombas de hidrogênio foram testadas pela primeira vez, foi responsável pelo rendimento descontrolado do teste nuclear Castle Bravo . O trítio se funde com o deutério em uma reação de fusão que é relativamente fácil de conseguir. Embora os detalhes permaneçam secretos, o deutereto de lítio-6 aparentemente ainda desempenha um papel nas armas nucleares modernas como material de fusão.
Fluoreto de lítio , quando altamente enriquecido em isótopo lítio-7, forma o componente básico da mistura de sal de fluoreto LiF- BeF 2 utilizado em reactores nucleares fluoreto líquidos . O fluoreto de lítio é excepcionalmente estável quimicamente e as misturas de LiF-BeF 2 têm baixos pontos de fusão. Além disso, 7 Li, Be e F estão entre os poucos nuclídeos com seções transversais de captura de nêutrons térmicos baixas o suficiente para não envenenar as reações de fissão dentro de um reator de fissão nuclear.
Em usinas de fusão nuclear conceituadas (hipotéticas) , o lítio será usado para produzir trítio em reatores magneticamente confinados usando deutério e trítio como combustível. O trítio de ocorrência natural é extremamente raro e deve ser produzido sinteticamente envolvendo o plasma reagente com uma 'manta' contendo lítio, onde nêutrons da reação deutério-trítio no plasma irão fissão do lítio para produzir mais trítio:
- 6 Li + n → 4 He + 3 H.
O lítio também é usado como fonte de partículas alfa , ou núcleos de hélio . Quando 7 Li é bombardeado por prótons acelerados, 8 Be é formado, que sofre fissão para formar duas partículas alfa. Essa façanha, chamada de "divisão do átomo" na época, foi a primeira reação nuclear totalmente produzida pelo homem . Foi produzido por Cockroft e Walton em 1932.
Em 2013, o US Government Accountability Office disse que a escassez de lítio-7 crítica para a operação de 65 dos 100 reatores nucleares americanos "coloca sua capacidade de continuar a fornecer eletricidade sob algum risco". A Castle Bravo usou pela primeira vez o lítio-7, no Camarão , seu primeiro dispositivo, que pesava apenas 10 toneladas, e gerou contaminação atmosférica nuclear maciça do Atol de Biquíni . Isso talvez seja responsável pelo declínio da infraestrutura nuclear dos Estados Unidos. O equipamento necessário para separar o lítio-6 do lítio-7 é principalmente um resíduo da guerra fria. Os Estados Unidos desligaram a maior parte desse maquinário em 1963, quando havia um enorme excedente de lítio separado, consumido principalmente durante o século XX. O relatório disse que levaria cinco anos e US $ 10 milhões a US $ 12 milhões para restabelecer a capacidade de separar o lítio-6 do lítio-7.
Reatores que usam lítio-7 aquecem água sob alta pressão e transferem calor por meio de trocadores de calor sujeitos à corrosão. Os reatores usam lítio para neutralizar os efeitos corrosivos do ácido bórico , que é adicionado à água para absorver o excesso de nêutrons.
Medicina
O lítio é útil no tratamento do transtorno bipolar . Os sais de lítio também podem ser úteis para diagnósticos relacionados, como transtorno esquizoafetivo e depressão maior cíclica . A parte ativa desses sais é o íon lítio Li + . Eles podem aumentar o risco de desenvolver anomalia cardíaca de Ebstein em bebês nascidos de mulheres que tomam lítio durante o primeiro trimestre da gravidez.
O lítio também foi pesquisado como um possível tratamento para dores de cabeça em salvas .
Precauções
| Perigos | |
|---|---|
| Pictogramas GHS |
 
|
| Palavra-sinal GHS | Perigo |
| H260 , H314 | |
| P223 , P231 + 232 , P280 , P305 + 351 + 338 , P370 + 378 , P422 | |
| NFPA 704 (diamante de fogo) | |
O metal de lítio é corrosivo e requer manuseio especial para evitar o contato com a pele. Respirar pó de lítio ou compostos de lítio (que geralmente são alcalinos ) irrita inicialmente o nariz e a garganta, enquanto uma exposição maior pode causar um acúmulo de líquido nos pulmões , levando ao edema pulmonar . O metal em si é um perigo de manuseio porque o contato com a umidade produz o hidróxido de lítio cáustico . O lítio é armazenado com segurança em compostos não reativos, como a nafta .
Veja também
- Problema cosmológico de lítio
- Dilithium
- Núcleo halo
- Isótopos de lítio
- Lista de países por produção de lítio
- Água de lítio
- Bateria de lítio-ar
- Lítio como investimento
- Queima de lítio
- Compostos de lítio (categoria)
- Bateria de íon-lítio
- Experimento de lítio Tokamak
Notas
Referências
links externos
- Avaliação da McKinsey de 2018
- Lítio na Tabela Periódica de Vídeos (Universidade de Nottingham)
- Aliança Internacional de Lítio
- USGS: Estatísticas e informações sobre lítio
- Lithium Supply & Markets 2009 IM Conference 2009 Suprimentos sustentáveis de lítio até 2020 em face do crescimento sustentável do mercado
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5.
- Conservas de lítio por país em investingnews.com