Litmus - Litmus

Tornesol é uma mistura solúvel em água de diferentes corantes extraídos de líquenes . Muitas vezes, é absorvido em papel de filtro para produzir uma das formas mais antigas de indicador de pH , usado para testar materiais quanto à acidez .
História
A palavra "tornassol" vem da antiga palavra nórdica para "tintura" ou "cor". Torneio foi usado pela primeira vez em cerca de 1300 pelo médico espanhol Arnaldus de Villa Nova . A partir do século 16, o corante azul foi extraído de alguns líquenes, principalmente na Holanda .
Fontes naturais
Torneio pode ser encontrado em diferentes espécies de líquenes. Os corantes são extraídos de espécies como Roccella tinctoria (América do Sul), Roccella fuciformis (Angola e Madagascar), Roccella pygmaea (Argélia), Roccella phycopsis , Lecanora tartarea (Noruega, Suécia), Variolaria dealbata , Ochrolechia parella , Parmotrema tinctorum , e Parmelia . Atualmente, as principais fontes são Roccella montagnei (Moçambique) e Dendrographa leucophoea (Califórnia).
Usos
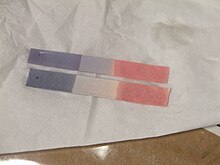
O principal uso do tornassol é testar se uma solução é ácida ou básica . O papel de tornassol azul claro fica vermelho em condições ácidas e o papel de tornassol vermelho fica azul em condições básicas ou alcalinas , com a mudança de cor ocorrendo na faixa de pH 4,5–8,3 a 25 ° C (77 ° F). O papel de tornassol neutro é roxo. O papel de tornassol úmido também pode ser usado para testar gases solúveis em água que afetam a acidez ou a basicidade ; o gás se dissolve na água e a solução resultante colore o papel de tornassol. Por exemplo, o gás amônia , que é alcalino, torna o papel de tornassol vermelho azul. Embora todo papel de tornassol atue como papel de pH, o oposto não é verdadeiro.
Tornesmo também pode ser preparado como uma solução aquosa que funciona de forma semelhante. Em condições ácidas, a solução é vermelha, e em condições alcalinas, a solução é azul.
| Tornassol ( indicador de pH ) | ||
| abaixo de pH 4,5 | acima de pH 8,3 | |
| 4,5 | ⇌ | 8,3 |
Outras reações químicas além do ácido-base também podem causar uma mudança de cor no papel de tornassol. Por exemplo, o gás cloro torna o papel de tornassol azul branco; o corante de tornassol é branqueado porque os íons hipoclorito estão presentes. Essa reação é irreversível, portanto o tornassol não está atuando como um indicador nessa situação.
Química
A mistura de tornassol tem o número CAS 1393-92-6 e contém de 10 a cerca de 15 corantes diferentes. Todos os componentes químicos do tornassol são provavelmente os mesmos da mistura relacionada conhecida como orceína , mas em proporções diferentes. Em contraste com a orceína, o principal constituinte do tornassol tem uma massa molecular média de 3300. Os indicadores ácido-base no tornassol devem suas propriedades a um cromóforo 7-hidroxifenoxazona . Algumas frações de tornassol receberam nomes específicos, incluindo eritrolitmina (ou eritroleína), azolitmina, spaniolitmina, leucoorceína e leucazolitmina. Azolitmin mostra quase o mesmo efeito que tornassol.
Mecanismo
O tornassol vermelho contém um ácido diprótico fraco . Quando é exposto a um composto básico, os íons de hidrogênio reagem com a base adicionada. A base conjugada formada do ácido de tornassol tem uma cor azul, então o papel de tornassol vermelho úmido fica azul em solução alcalina.