MT-ATP6 - MT-ATP6
MT-ATP6 (ou ATP6 ) é um gene mitocondrial com o nome completo 'subunidade de membrana ATP sintase codificada mitocondrialmente 6' que codifica a ATP sintase F o subunidade 6 (ou subunidade / cadeia A) . Esta subunidade pertence ao F O complexo do grande, transmembranar do tipo F ATP sintase . Essa enzima, também conhecida como complexo V, é responsável pela etapa final da fosforilação oxidativa na cadeia de transporte de elétrons . Especificamente, um segmento da ATP sintase permite que íons carregados positivamente, chamados prótons , fluam através de uma membrana especializada dentro da mitocôndria. Outro segmento da enzima usa a energia criada por esse fluxo de prótons para converter uma molécula chamada difosfato de adenosina (ADP) em ATP . Mutações nogene MT-ATP6 foram encontradas em aproximadamente 10 a 20 por cento das pessoas com síndrome de Leigh .
Estrutura
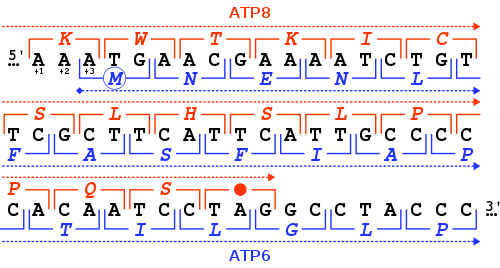
O gene MT-ATP6 fornece informações para a produção de uma proteína essencial para a função mitocondrial normal. O gene humano MT-ATP6 , localizado no DNA mitocondrial , tem 681 pares de bases de comprimento. Uma característica incomum do MT-ATP6 é a sobreposição do gene de 46 nucleotídeos de seus primeiros códons com o final do gene MT-ATP8 . No que diz respeito ao quadro de leitura MT-ATP6 (+3), o gene MT-ATP8 termina no quadro de leitura +1 com um códon de parada TAG .
A proteína MT-ATP6 pesa 24,8 kDa e é composta por 226 aminoácidos . A proteína é uma subunidade da F 1 F o ATPase, também conhecida como Complexo V , que consiste em 14 subunidades codificadas nuclearmente e 2 mitocondriais. Como uma subunidade A, MT-ATP6 está contido na porção F o transmembranar não catalítica do complexo.
A nomenclatura da enzima tem uma longa história. A fração F 1 deriva seu nome do termo "Fração 1" e F o (escrito como uma letra subscrita "o", não "zero") deriva seu nome de ser a fração de ligação para a oligomicina , um tipo de antibiótico de origem natural que é capaz de inibir a unidade F o da ATP sintase. A região F o da ATP sintase é um poro de próton que está embutido na membrana mitocondrial. Consiste em três subunidades principais A, B e C e (em humanos) seis subunidades adicionais, d , e , f , g , F6 e 8 (ou A6L). A estrutura 3D do homólogo de E. coli desta subunidade foi modelada com base em dados de microscopia eletrônica (cadeia M de PDB : 1c17 ). Ele forma um feixe 4-α transmembrana.
Função
Esta subunidade é um componente chave do canal de prótons e pode desempenhar um papel direto na translocação de prótons através da membrana. A catálise no complexo F 1 depende da rotação da haste central e do anel F o , que por sua vez é impulsionada pelo fluxo de prótons através da membrana através da interface entre o anel C F0 e a subunidade A. A haste periférica liga a subunidade A à superfície externa do domínio F 1 e acredita-se que atue como um estator para contrariar a tendência da subunidade A e da porção catalítica F 1 alfa 3 beta 3 de girar com o elemento rotativo central.
Significado clínico
Mutações em MT-ATP6 e outros genes que afetam a fosforilação oxidativa na mitocôndria foram associadas a uma variedade de distúrbios neurodegenerativos e cardiovasculares , incluindo deficiência do complexo V mitocondrial, neuropatia óptica hereditária de Leber (LHON), encefalomiopatia mitocondrial com episódios semelhantes a acidente vascular cerebral ( MELAS ) , Síndrome de Leigh e síndrome NARP . A maioria das células do corpo contém milhares de mitocôndrias, cada uma com uma ou mais cópias de DNA mitocondrial . A gravidade de alguns distúrbios mitocondriais está associada à porcentagem de mitocôndrias em cada célula que possui uma alteração genética específica. Pessoas com síndrome de Leigh devido a uma mutação no gene MT-ATP6 tendem a ter uma porcentagem muito alta de mitocôndrias com a mutação (de mais de 90% a 95%). As características menos graves do NARP resultam de uma porcentagem menor de mitocôndrias com a mutação, normalmente de 70 a 90 por cento. Como essas duas condições resultam das mesmas mudanças genéticas e podem ocorrer em membros diferentes de uma única família, os pesquisadores acreditam que podem representar um espectro de características sobrepostas, em vez de duas síndromes distintas.
Deficiência do complexo V mitocondrial
A deficiência do complexo V mitocondrial é uma deficiência (deficiência) ou perda de função no complexo V da cadeia de transporte de elétrons que pode causar uma grande variedade de sinais e sintomas que afetam muitos órgãos e sistemas do corpo, particularmente o sistema nervoso e o coração . O distúrbio pode ser fatal na primeira infância. Os indivíduos afetados podem ter problemas de alimentação, crescimento lento, baixo tônus muscular ( hipotonia ), fadiga extrema ( letargia ) e atraso no desenvolvimento . Eles tendem a desenvolver níveis elevados de ácido láctico no sangue ( acidose láctica ), o que pode causar náuseas, vômitos, fraqueza e respiração rápida. Níveis elevados de amônia no sangue ( hiperamonemia ) também podem ocorrer em indivíduos afetados e, em alguns casos, resultar em função cerebral anormal ( encefalopatia ) e danos a outros órgãos. Ataxia , microcefalia , atraso no desenvolvimento e deficiência intelectual foram observados em pacientes com uma mutação frameshift em MT-ATP6. Isso causa uma inserção C na posição 8612 que resulta em uma proteína truncada com apenas 36 aminoácidos de comprimento e dois polimorfismos de nucleotídeo único T> C nas posições 8610 e 8614 que resultam em um trecho homopolimérico de citosina .
Outra característica comum da deficiência do complexo V mitocondrial é a cardiomiopatia hipertrófica . Esta condição é caracterizada por espessamento ( hipertrofia ) do músculo cardíaco que pode levar à insuficiência cardíaca . A mutação m.8528T> C ocorre na região de sobreposição dos genes MT-ATP6 e MT-ATP8 e foi descrita em vários pacientes com cardiomiopatia infantil. Esta mutação muda o códon de iniciação em MT-ATP6 para treonina , bem como uma mudança de triptofano para arginina na posição 55 de MT-ATP8 . Indivíduos com deficiência do complexo V mitocondrial também podem ter um padrão característico de traços faciais, incluindo testa alta, sobrancelhas curvas, cantos externos dos olhos que apontam para baixo ( fissuras palpebrais inclinadas para baixo ), uma ponte proeminente do nariz, orelhas baixas, lábios finos e um queixo pequeno ( micrognatia ).
Síndrome de Leigh
Variantes patogênicas do gene mitocondrial MT-ATP6 são conhecidas por causar a síndrome de Leigh associada ao mtDNA , um distúrbio cerebral progressivo que geralmente aparece na primeira infância. As crianças afetadas podem apresentar atraso no desenvolvimento , fraqueza muscular, problemas de movimento ou dificuldade para respirar. Outras variantes conhecidas por causar a síndrome de Leigh associada ao mtDNA envolvem MT-TL1 , MT-TK , MT-TW , MT-TV , MT-ND1 , MT-ND2 , MT-ND3 , MT-ND4 , MT-ND5 , MT-ND6 e MT-CO3 . Anormalidades na geração de energia mitocondrial resultam em distúrbios neurodegenerativos como a síndrome de Leigh , que é caracterizada pelo início dos sintomas entre os 12 meses e os três anos de idade. Os sintomas freqüentemente se manifestam após uma infecção viral e incluem distúrbios do movimento e neuropatia periférica , bem como hipotonia , espasticidade e ataxia cerebelar . Aproximadamente metade dos pacientes afetados morre de insuficiência respiratória ou cardíaca aos três anos de idade. A síndrome de Leigh é uma doença de herança materna e seu diagnóstico é estabelecido por meio de testes genéticos dos genes mitocondriais mencionados, incluindo o MT-ATP6. As mutações do gene MT-ATP6 associadas à síndrome de Leigh alteram um bloco de construção do DNA ( nucleotídeo ) no gene MT-ATP6. A alteração genética mais comum substitui o nucleotídeo timina por guanina na posição 8993 (escrita como T8993G). As mutações que causam a síndrome de Leigh prejudicam a função ou estabilidade do complexo ATP sintase , inibindo a produção de ATP e prejudicando a fosforilação oxidativa . Embora o mecanismo exato não seja claro, os pesquisadores acreditam que a fosforilação oxidativa prejudicada pode levar à morte celular devido à diminuição da energia disponível na célula. Certos tecidos que requerem grandes quantidades de energia, como cérebro, músculos e coração, parecem especialmente sensíveis a diminuições na energia celular. A morte celular no cérebro provavelmente causa as mudanças características no cérebro vistas na síndrome de Leigh, que contribuem para os sinais e sintomas da doença. A morte celular em outros tecidos sensíveis também pode contribuir para as características da síndrome de Leigh. Uma mutação heteroplasmática T → C MT-ATP6 na posição 9185 resulta na substituição de uma leucina altamente conservada por prolina no códon 220 e uma mutação heteroplasmática T → C missense na posição 9191 converteu uma leucina altamente conservada em uma prolina na posição 222 do polipeptídeo , levando a um fenótipo do tipo Leigh . A mutação T9185C resultou em um fenótipo leve e reversível , com 97% das amostras de músculo e sangue do paciente refletindo a mutação. A mutação T9191C apresentou um fenótipo muito mais grave que resultou na morte do paciente aos 2 anos de idade.
Síndrome NARP
Algumas das mutações do gene ATP6 que causam a síndrome de Leigh também são responsáveis por uma condição semelhante, mas menos grave, chamada neuropatia, ataxia e retinite pigmentosa (NARP). Um pequeno número de mutações no gene MT-ATP6 foi identificado em pessoas com NARP. Cada uma dessas mutações altera um nucleotídeo no gene MT-ATP6. Como na síndrome de Leigh, a alteração genética mais comum associada ao NARP substitui o nucleotídeo timina pela guanina na posição 8993 (escrita como T8993G). As mutações que causam o NARP alteram a estrutura ou função da ATP sintase , reduzindo a capacidade da mitocôndria de produzir ATP. Embora os efeitos precisos dessas mutações não sejam claros, os pesquisadores continuam a investigar como as mudanças no gene MT-ATP6 interferem na produção de ATP e levam à fraqueza muscular, perda de visão e outras características do NARP.
Necrose estriatal bilateral familiar
Uma condição chamada necrose estriatal bilateral familiar, que é semelhante à síndrome de Leigh, também pode resultar de alterações no gene MT-ATP6. Nos poucos casos relatados com essas mutações, as crianças afetadas apresentaram atraso no desenvolvimento, problemas de movimento e coordenação, tônus muscular fraco ( hipotonia ) e cabeça de tamanho anormalmente pequeno ( microcefalia ). Os pesquisadores não determinaram por que as mutações MT-ATP6 resultam nesta combinação de sinais e sintomas em crianças com necrose estriatal bilateral.
Interações
Foi demonstrado que o MT-ATP6 tem 20 interações de proteína-proteína binárias, incluindo 17 interações co-complexas. MT-ATP6 parece interagir com o SP1 .
Pesquisar
A SENS Research Foundation publicou um artigo detalhando a expressão alotópica bem-sucedida do DNA de substituição para o gene MT-ATP6 no DNA nuclear da célula.
Referências
Leitura adicional
- Holme E, Greter J, Jacobson CE, Larsson NG, Lindstedt S, Nilsson KO, Oldfors A, Tulinius M (dezembro de 1992). "Deficiência mitocondrial de ATP-sintase em uma criança com acidúria 3-metilglutacônica" . Pediatric Research . 32 (6): 731–5. doi : 10.1203 / 00006450-199212000-00022 . PMID 1287564 .
- Torroni A, Achilli A, Macaulay V, Richards M, Bandelt HJ (junho de 2006). "Colhendo o fruto da árvore humana do mtDNA". Tendências em genética . 22 (6): 339–45. doi : 10.1016 / j.tig.2006.04.001 . PMID 16678300 .
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (dezembro de 2000). "Variação do genoma mitocondrial e a origem dos humanos modernos". Nature . 408 (6813): 708–13. Bibcode : 2000Natur.408..708I . doi : 10.1038 / 35047064 . PMID 11130070 . S2CID 52850476 .
- Manfredi G, Fu J, Ojaimi J, Sadlock JE, Kwong JQ, Guy J, Schon EA (abril de 2002). "Resgate de uma deficiência na síntese de ATP pela transferência de MTATP6, um gene codificado pelo DNA mitocondrial, para o núcleo". Nature Genetics . 30 (4): 394–9. doi : 10.1038 / ng851 . PMID 11925565 . S2CID 30012532 .
- Torigoe T, Izumi H, Ishiguchi H, Uramoto H, Murakami T, Ise T, Yoshida Y, Tanabe M, Nomoto M, Itoh H, Kohno K (setembro de 2002). "Enhanced expression of the human vacuolar H + -ATPase c subunit gene (ATP6L) in response to anticancer agents" . The Journal of Biological Chemistry . 277 (39): 36534–43. doi : 10.1074 / jbc.M202605200 . PMID 12133827 .
- Mishmar D, Ruiz-Pesini E, Golik P, Macaulay V, Clark AG, Hosseini S, Brandon M, Easley K, Chen E, Brown MD, Sukernik RI, Olckers A, Wallace DC (janeiro de 2003). "A seleção natural moldou a variação regional do mtDNA em humanos" . Anais da Academia Nacional de Ciências dos Estados Unidos da América . 100 (1): 171–6. Bibcode : 2003PNAS..100..171M . doi : 10.1073 / pnas.0136972100 . PMC 140917 . PMID 12509511 .
- Ingman M, Gyllensten U (julho de 2003). "Variação do genoma mitocondrial e história evolutiva dos aborígenes australianos e da Nova Guiné" . Genome Research . 13 (7): 1600–6. doi : 10.1101 / gr.686603 . PMC 403733 . PMID 12840039 .
- Kong QP, Yao YG, Sun C, Bandelt HJ, Zhu CL, Zhang YP (setembro de 2003). "Filogenia de linhagens de DNA mitocondrial do leste asiático inferida a partir de sequências completas" . American Journal of Human Genetics . 73 (3): 671–6. doi : 10.1086 / 377718 . PMC 1180693 . PMID 12870132 .
- Temperley RJ, Seneca SH, Tonska K, Bartnik E, Bindoff LA, Lightowlers RN, Chrzanowska-Lightowlers ZM (setembro de 2003). "A investigação de uma microdeleção de mtDNA patogênica revela uma via de decaimento de deadenilação dependente da tradução em mitocôndrias humanas" . Human Molecular Genetics . 12 (18): 2341–8. doi : 10.1093 / hmg / ddg238 . PMID 12915481 .
- Reuter TY, Medhurst AL, Waisfisz Q, Zhi Y, Herterich S, Hoehn H, Gross HJ, Joenje H, Hoatlin ME, Mathew CG, Huber PA (outubro de 2003). "Os rastreios de dois híbridos de levedura implicam o envolvimento das proteínas de anemia de Fanconi na regulação da transcrição, sinalização celular, metabolismo oxidativo e transporte celular". Experimental Cell Research . 289 (2): 211–21. doi : 10.1016 / S0014-4827 (03) 00261-1 . PMID 14499622 .
- Dubot A, Godinot C, Dumur V, Sablonnière B, Stojkovic T, Cuisset JM, Vojtiskova A, Pecina P, Jesina P, Houstek J (janeiro de 2004). "GUG é um códon de iniciação eficiente para traduzir o gene ATP6 mitocondrial humano". Comunicações de pesquisa bioquímica e biofísica . 313 (3): 687–93. doi : 10.1016 / j.bbrc.2003.12.013 . PMID 14697245 .
- Coble MD, Just RS, O'Callaghan JE, Letmanyi IH, Peterson CT, Irwin JA, Parsons TJ (junho de 2004). "Polimorfismos de nucleotídeo único em todo o genoma do mtDNA que aumentam o poder dos testes forenses em caucasianos". International Journal of Legal Medicine . 118 (3): 137–46. doi : 10.1007 / s00414-004-0427-6 . PMID 14760490 . S2CID 8413730 .
- Carrozzo R, Rizza T, Stringaro A, Pierini R, Mormone E, Santorelli FM, Malorni W, Matarrese P (julho de 2004). "Mutações relacionadas à síndrome de Leigh herdadas pela mãe reforçam a apoptose mediada por mitocondrial". Journal of Neurochemistry . 90 (2): 490–501. doi : 10.1111 / j.1471-4159.2004.02505.x . PMID 15228605 . S2CID 33013529 .
links externos
- GeneReviews / NCBI / NIH / UW entrada na Síndrome de Leigh associada ao DNA mitocondrial e NARP
- MT-ATP6 + proteína + humano na Biblioteca Nacional de Medicina dos EUA Medical Subject Headings (MeSH)
Este artigo incorpora texto da Biblioteca Nacional de Medicina dos Estados Unidos , que é de domínio público .


