Maltase - Maltase
| Alfa-glucosidase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| EC nº | 3.2.1.20 | ||||||||
| CAS no. | 9001-42-7 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
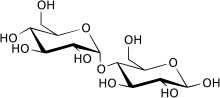
Maltase ( EC 3.2.1.20 , alfa-glucosidase , glucoinvertase , glucosidosucrase , maltase-glucoamilase , alfa-glucopiranosidase , glucosidoinvertase , alfa-D-glucosidase , alfa-glucosido hidrolase , alfa-1,4-glucosidase , alfa-D-glucosido glucohidrolase ) é um tipo de enzimas alfa-glicosidase localizadas na borda em escova do intestino delgado. Esta enzima catalisa a hidrólise do dissacarídeo maltose em dois açúcares simples de glicose . A maltase é encontrada em plantas, bactérias, leveduras, humanos e outros vertebrados. Acredita-se que seja sintetizado pelas células da membrana mucosa que reveste a parede intestinal.
A digestão do amido requer seis enzimas intestinais. Duas dessas enzimas são endo-glucosidases luminais denominadas alfa-amilases. As outras quatro enzimas foram identificadas como diferentes maltases, exo-glicosidases ligadas à superfície luminal dos enterócitos. Duas dessas atividades da maltase foram associadas à sucrase-isomaltase (maltase Ib, maltase Ia). As outras duas maltases sem características distintivas foram denominadas maltase-glucoamilase (maltases II e III). As atividades dessas quatro maltases também são descritas como alfa-glicosidase porque todas elas digerem oligossacarídeos de amido linear em glicose.
Na maioria dos casos, é equivalente à alfa-glucosidase , mas o termo "maltase" enfatiza a natureza dissacarídica do substrato do qual a glicose é clivada, e "alfa-glucosidase" enfatiza a ligação, seja o substrato um dissacarídeo ou polissacarídeo .
Morcegos vampiros são os únicos vertebrados que não exibem atividade de maltase intestinal.
Estrutura
A maltase faz parte de um grupo de enzimas intestinais chamadas FamilyGH13 ( família da glicosídeo hidrolase 13 ) que são responsáveis por quebrar as ligações α-glucosidase de carboidratos complexos em moléculas de glicose simples de usar. As moléculas de glicose seriam então usadas como uma espécie de "alimento" para as células produzirem energia ( trifosfato de adenosina ) durante a respiração celular . A seguir estão os genes que podem codificar para maltase:
- A alfa-glicosidase ácida, codificada no gene GAA, é essencial para quebrar os açúcares complexos chamados glicogênio em glicose.
- A maltase-glucoamilase, codificada no gene MGAM, desempenha um papel na digestão dos amidos. É devido a essa enzima em humanos que os amidos de origem vegetal são digeridos.
- A sucrase-isomaltase, codificada no gene SI, é essencial para a digestão de carboidratos, incluindo amido, sacarose e isomaltose.
- A alfa-amilase 1, que é codificada no gene AMY1A, é responsável pela clivagem das ligações da α-glucosidase em oligossacarídeos e polissacarídeos para produzir amidos e glicogênio para as enzimas anteriores catalisarem. Quantidades maiores desse gene no cérebro diminuem o risco de doença de Alzheimer .
Mecanismo
O mecanismo de todas as enzimas FamilyGH13 é quebrar uma ligação da α-glucosidase hidrolisando-a. A maltase se concentra em quebrar a maltose, um dissacarídeo que é uma ligação entre 2 unidades de glicose, na ligação α- (1-> 4). A taxa de hidrólise é controlada pelo tamanho do substrato (tamanho do carboidrato).
Aplicações industriais
A alfa-amilase tem importante função na degradação de amidos, por isso é extremamente utilizada na indústria de panificação. É usado principalmente como meio de intensificar o sabor para melhorar a qualidade do pão. Sem alfa-amilase, a levedura não seria capaz de fermentar.
A maltose-glucoamilase é comumente usada como fonte de fermentação, pois é capaz de transformar o amido em maltose, que é então usada para fazer cervejas e saquê.
Além da fermentação, a maltose glucoamilase foi estudada pela introdução de inibidores específicos para interromper a hidrólise das ligações da α-glucosidase. Ao inibir a clivagem das ligações, os cientistas esperam desenvolver um medicamento que seja mais eficiente e menos tóxico para o tratamento do diabetes.
História
A história da descoberta da maltase começou quando Napoleão Bonaparte declarou um bloqueio continental em seu “decreto de Berlim” em 1806. Isso deu início à busca por fontes alternativas de açúcar. Em 1833, os químicos franceses Anselm Payen e Jean-François Persoz descobriram um extrato de malte que convertia o amido em glicose, que na época eles chamavam de diastase. Em 1880, HT Brown descobriu a atividade da maltase na mucosa e a diferenciou da diastase, agora chamada de amilase. Na década de 1960, os avanços na química de proteínas permitiram que Arne Dahlqvist e Giorgio Semenza fracionassem e caracterizassem as atividades da maltase no intestino delgado. Ambos os grupos mostraram que havia quatro frações principais da atividade da maltase que eram intrínsecas a duas estruturas peptídicas diferentes, sucrase-isomaltase e maltase-glucoamilase. Cinquenta anos mais tarde, entrando na era genômica, a clonagem e o sequenciamento da hidrolase de amido da mucosa confirmaram as descobertas de Dahlqvist e Semenza.
Deficiência de maltase
A deficiência de ácido maltase (DMRI), também conhecida como doença de Pompe, foi descrita pela primeira vez pelo patologista holandês JC Pompe em 1932. A DMRI é uma condição autossômica recessiva não ligada ao sexo na qual o acúmulo excessivo de glicogênio se acumula nos vacúolos lisossomais em quase todos os tipos de células. o corpo. É uma das doenças de armazenamento de glicogênio mais sérias que afetam o tecido muscular.
A DMRI é categorizada em três tipos distintos com base na idade de início dos sintomas no indivíduo afetado. Infantil (Tipo a), infância (Tipo b) e idade adulta (Tipo c). O tipo de DMRI é determinado pelo tipo de mutação genética localizada em 17q23. O tipo de mutação determinará o nível de produção de maltase ácida. AMD é extremamente fatal. Tipo A geralmente morre de insuficiência cardíaca antes de um ano de idade. O tipo b morre de insuficiência respiratória entre os três e os vinte e quatro anos. O tipo c morre de insuficiência respiratória 10-20 anos após o início dos sintomas.
Veja também
Referências
links externos
- Maltases nos cabeçalhos de assuntos médicos da Biblioteca Nacional de Medicina dos EUA (MeSH)
- Estrutura e evolução da maltase-glicoamilase e sacarase-isomaltase de mamíferos