Regra de Markovnikov - Markovnikov's rule
Em química orgânica , a regra de Markovnikov ou regra de Markownikoff descreve o resultado de algumas reações de adição . A regra foi formulada pelo químico russo Vladimir Markovnikov em 1870.
Explicação
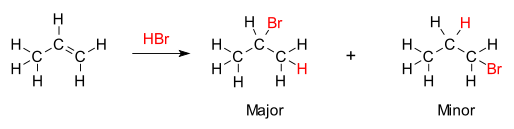
A regra estabelece que com a adição de um ácido prótico HX ou outro reagente polar a um alceno assimétrico , o hidrogênio ácido (H) ou parte eletropositiva se liga ao carbono com mais substituintes de hidrogênio e o grupo haleto (X) ou parte eletronegativa fica ligado ao carbono com mais substituintes alquil. Isso contrasta com a definição original de Markovnikov, na qual a regra é que o componente X é adicionado ao carbono com o menor número de átomos de hidrogênio, enquanto o átomo de hidrogênio é adicionado ao carbono com o maior número de átomos de hidrogênio.
O mesmo é verdadeiro quando um alceno reage com a água em uma reação de adição para formar um álcool que envolve a formação de carbocations. O grupo hidroxila (OH) se liga ao carbono que tem o maior número de ligações carbono-carbono, enquanto o hidrogênio se liga ao carbono na outra extremidade da ligação dupla, que tem mais ligações carbono-hidrogênio.
A base química da Regra de Markovnikov é a formação do carbocátion mais estável durante o processo de adição. A adição do íon hidrogênio a um átomo de carbono no alceno cria uma carga positiva no outro carbono, formando um carbocátio intermediário. Quanto mais substituído o carbocátion, mais estável ele é, devido à indução e hiperconjugação . O principal produto da reação de adição será aquele formado a partir do intermediário mais estável. Portanto, o principal produto da adição de HX (onde X é algum átomo mais eletronegativo do que H) a um alceno tem o átomo de hidrogênio na posição menos substituída e X na posição mais substituída. Mas o outro carbocátion menos substituído e menos estável ainda será formado em alguma concentração e continuará a ser o produto secundário com o anexo conjugado oposto de X.
Reações anti-Markovnikov
Os mecanismos que não envolvem um intermediário carbocátion podem reagir por meio de outros mecanismos que possuem outras regiosseletividades não ditadas pela regra de Markovnikov, como a adição de radicais livres . Essas reações são chamadas de anti-Markovnikov , uma vez que o halogênio adiciona ao carbono menos substituído, o oposto de uma reação de Markovnikov.
A regra anti-Markovnikov pode ser ilustrada usando a adição de brometo de hidrogênio ao isobutileno na presença de peróxido de benzoíla ou peróxido de hidrogênio. A reação de HBr com alquenos substituídos foi prototípica no estudo de adições de radicais livres. Os primeiros químicos descobriram que a razão para a variabilidade na proporção de Markovnikov para produtos de reação anti-Markovnikov era devido à presença inesperada de substâncias ionizantes de radicais livres, como peróxidos. A explicação é que a ligação OO em peróxidos é relativamente fraca. Com a ajuda de luz, calor ou às vezes até mesmo agindo por conta própria, a ligação OO pode se dividir para formar 2 radicais . Os grupos radicais podem então interagir com HBr para produzir um radical Br, que então reage com a ligação dupla. Como o átomo de bromo é relativamente grande, é mais provável que ele encontre e reaja com o carbono menos substituído, uma vez que essa interação produz menos interações estáticas entre o carbono e o radical de bromo. Além disso, semelhante a uma espécie com carga positiva, a espécie radical é mais estável quando o elétron desemparelhado está na posição mais substituída. O intermediário radical é estabilizado por hiperconjugação . Na posição mais substituída, mais ligações carbono-hidrogênio são alinhadas com o orbital molecular deficiente de elétrons do radical. Isso significa que há maiores efeitos de hiperconjugação, de modo que a posição é mais favorável. Nesse caso, o carbono terminal é um reagente que produz um produto de adição primário em vez de um produto de adição secundário.
Um novo método de adição de anti-Markovnikov foi descrito por Hamilton e Nicewicz, que utilizam moléculas aromáticas e energia luminosa de um diodo de baixa energia para transformar o alceno em um radical catiônico.
O comportamento anti-Markovnikov se estende a mais reações químicas do que adições a alcenos. O comportamento anti-Markovnikov é observado na hidratação do fenilacetileno por catálise áurica, que dá acetofenona ; embora com um catalisador de rutênio especial, ele fornece o outro regioisômero 2-fenilacetaldeído :
O comportamento anti-Markovnikov também pode se manifestar em certas reações de rearranjo . Em um cloreto de titânio (IV) catalisada por formal de substituição nucleofílica na enantiomericamente 1 no esquema a seguir, dois produtos são formados - 2a e 2b Devido aos dois centros quirais na molécula alvo, o cloro realização de carbono e o carbono que tem o grupo metilo e grupo acetoxietil, quatro compostos diferentes devem ser formados: 1R, 2R- (representado como 2b) 1R, 2S- 1S, 2R- (representado como 2a) e 1S, 2S-. Portanto, ambas as estruturas representadas existirão nas formas D e L. :
Esta distribuição do produto pode ser racionalizada por assumindo que a perda do hidroxi grupo em 1 dá o terciária carbocatião A , que se rearranja para o aparentemente menos estável carbocação secundária B . O cloro pode se aproximar desse centro por duas faces, levando à mistura observada de isômeros.
Outro exemplo notável de adição de anti-Markovnikov é a hidroboração .




