Redução Meerwein – Ponndorf – Verley - Meerwein–Ponndorf–Verley reduction
| Redução de Meerwein – Ponndorf – Verley | |
|---|---|
| Nomeado após |
Hans Meerwein Wolfgang Ponndorf Albert Verley |
| Tipo de reação | Reação redox orgânica |
| Identificadores | |
| Portal de Química Orgânica | meerwein-ponndorf-verley-redução |
| ID de ontologia RSC | RXNO: 0000089 |
A redução Meerwein – Ponndorf – Verley (MPV) na química orgânica é a redução de cetonas e aldeídos em seus álcoois correspondentes , utilizando catálise de alcóxido de alumínio na presença de um álcool sacrificial. As vantagens da redução do MPV residem em sua alta quimiosseletividade e no uso de um catalisador de metal barato e ecologicamente correto.
|
|
A redução do VPM foi descoberta por Meerwein e Schmidt, e separadamente por Verley em 1925. Eles descobriram que uma mistura de etóxido de alumínio e etanol poderia reduzir os aldeídos a seus álcoois. Ponndorf aplicou a reação às cetonas e atualizou o catalisador para isopropóxido de alumínio em isopropanol .
Mecanismo
Acredita-se que a redução do MPV passe por um ciclo catalítico envolvendo um estado de transição de anel de seis membros, conforme mostrado na Figura 2. Começando com o alcóxido de alumínio 1 , um oxigênio de carbonila é coordenado para atingir o intermediário de alumínio tetra-coordenado 2 . Entre os intermediários 2 e 3, o hidreto é transferido para o carbonil do ligante alcoxi por meio de um mecanismo pericíclico . Neste ponto, o novo carbonil se dissocia e dá a espécie de alumínio tricoordenado 4 . Finalmente, um álcool da solução desloca o carbonil recém-reduzido para regenerar o catalisador 1 .
|
|
Cada etapa do ciclo é reversível e a reação é impulsionada pelas propriedades termodinâmicas dos intermediários e dos produtos. Isso significa que, com o tempo, o produto mais estável termodinamicamente será favorecido.
Vários outros mecanismos foram propostos para esta reação, incluindo um mecanismo radical , bem como um mecanismo envolvendo uma espécie de hidreto de alumínio . A transferência direta de hidreto é o mecanismo comumente aceito recentemente apoiado por dados experimentais e teóricos.
Quimiosseletividade
Um dos grandes atrativos da redução Meerwein – Ponndorf – Verley é sua quimiosseletividade . Os aldeídos são reduzidos antes das cetonas, permitindo uma medida de controle sobre a reação. Se for necessário reduzir um carbonil na presença de outro, os grupos de proteção de carbonil comuns podem ser empregados. Grupos, como alcenos e alcinos, que normalmente representam um problema para redução por outros meios, não têm reatividade nessas condições.
Estereosseletividade
A redução de Meerwein-Ponndorf-Verley com base de alumínio pode ser realizada em proquirais cetonas que conduzem à quirais álcoois. As três formas principais de se obter a redução assimétrica são pelo uso de uma fonte de hidreto de álcool quiral, pelo uso de uma redução intramolecular do VPM ou pelo uso de um ligante quiral no alcóxido de alumínio.
Um método para alcançar a redução assimétrica do VPM é com o uso de álcoois doadores de hidretos quirais. O uso de álcool quiral (R) - (+) - sec - o -bromofen-álcool etílico deu 82% ee ( excesso enantiomérico percentual ) na redução de 2-cloroacetofenona. Esta enantiosseleção é devida aos estéricos dos dois grupos fenol no estado de transição de seis membros, conforme mostrado na Figura 3. Na Figura 3, 1 é favorecido em relação a 2 devido ao grande efeito estérico em 2 dos dois grupos fenil .
|
|
O uso de uma redução intramolecular do VPM pode fornecer boa enantiopureza. Ao amarrar a cetona à fonte de hidreto, apenas um estado de transição é possível (Figura 4) levando à redução assimétrica. Este método, entretanto, tem a capacidade de sofrer a oxidação Oppenauer reversa devido à proximidade dos dois reagentes. Assim, a reação ocorre em equilíbrio termodinâmico com a proporção dos produtos em relação às suas estabilidades relativas. Após a reação ser executada, a porção da fonte de hidreto da molécula pode ser removida.
|
|
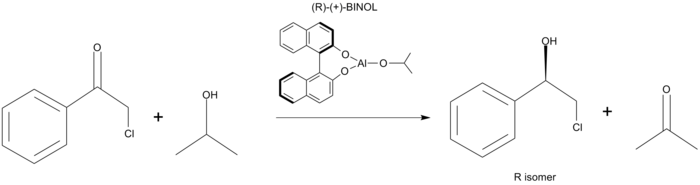
Ligantes quirais no alcóxido de alumínio podem afetar o resultado estereoquímico da redução do VPM. Esse método levou à redução das acetofenonas substituídas em até 83% ee (Figura 5). O apelo desse método é que ele usa um ligante quiral em oposição a uma fonte estequiométrica de quiralidade. Recentemente, foi demonstrado que a baixa seletividade desse método se deve ao formato do estado de transição. Foi demonstrado que o estado de transição é um estado de transição planar de seis membros. Isso é diferente do que se acreditava no modelo Zimmerman-Traxler, como o estado de transição.
|
|
Alcance
Vários problemas restringem o uso da redução Meerwein – Ponndorf – Verley em comparação com o uso de outros agentes redutores. O controle estereoquímico é seriamente limitado. Freqüentemente, uma grande quantidade de alcóxido de alumínio é necessária quando se usa reagente comercial, e há várias reações colaterais conhecidas.
Embora o isopropóxido de alumínio comercial esteja disponível, seu uso geralmente requer cargas de catalisador de até 100-200 mol%. Isso dificulta o uso da redução do VPM em escala. Um trabalho recente mostrou que os alcóxidos de alumínio feitos in situ a partir de reagentes de trimetilalumínio têm uma atividade muito melhor, exigindo um carregamento de apenas 10%. Acredita-se que a diferença de atividade se deva ao grande estado de agregação do produto disponível comercialmente.
Sabe-se que várias reações colaterais ocorrem. No caso das cetonas e especialmente dos aldeídos , foram observadas condensações de aldol . Os aldeídos sem α-hidrogênios podem sofrer a reação de Tishchenko . Finalmente, em alguns casos, o álcool gerado pela redução pode ser desidratado dando um carbono alquil .
Variações
A redução Meerwein – Ponndorf – Verley foi recentemente usada na síntese de aminas quirais a partir de cetiminas usando um alcóxido quiral. A adição de um grupo fosfinoila ao nitrogênio da cetimina permitiu alta enantiosseletividade de até 98% ee.
Trabalho tem sido feito no uso de lantanídeos e metais de transição para a redução Meerwein – Ponndorf – Verley. Tanto o rutênio quanto o samário apresentam altos rendimentos e alta estereosseletividade na redução de carbonilas a álcoois. Foi demonstrado que o catalisador de rutênio, entretanto, passa por um intermediário de hidreto de rutênio. A redução Meerwein – Ponndorf – Verley também foi realizada com rendimento sinteticamente útil pelo isopropóxido de plutônio (III).
A redução padrão do VPM é uma reação homogênea, várias reações heterogêneas foram desenvolvidas.