Fluoreto de mercúrio (IV) - Mercury(IV) fluoride
|
|
|
|
| Identificadores | |
|---|---|
|
Modelo 3D ( JSmol )
|
|
|
|
|
|
| Propriedades | |
| HgF 4 | |
| Massa molar | 276,58 g / mol |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O fluoreto de mercúrio (IV) , HgF 4 , é o primeiro composto de mercúrio a ser relatado com mercúrio no estado de oxidação +4 . O mercúrio, como os outros elementos do grupo 12 ( cádmio e zinco ), tem uma configuração eletrônica s 2 d 10 e geralmente só forma ligações envolvendo seu orbital 6s. Isso significa que o mais alto estado de oxidação que o mercúrio normalmente atinge é +2 e, por essa razão, ele é geralmente considerado um metal pós-transição em vez de um metal de transição . O HgF 4 foi relatado pela primeira vez em experimentos em 2007, mas sua existência permanece controversa; experimentos conduzidos em 2008 não conseguiram replicar o composto.
História
Especulação sobre os estados de oxidação mais elevados para o mercúrio tinha existido desde os anos 1970, e cálculos teóricos na década de 1990 previsto que deve ser estável na fase gasosa, com um quadrado planar geometria consistentes com formal d 8 configuração. No entanto, a prova experimental permaneceu esquiva até 2007, quando o HGF 4 foi preparado primeiro utilizando sólido néon e gon para o isolamento da matriz a uma temperatura de 4 K . O composto foi detectado usando espectroscopia de infravermelho . A análise da teoria do funcional da densidade e cálculos de agrupamento acoplado mostraram que os orbitais d estão envolvidos na ligação, levando à sugestão de que o mercúrio deve ser considerado um metal de transição, afinal. No entanto, essa conclusão foi contestada por W. B. Jensen com o argumento de que o HgF 4 só existe em condições de desequilíbrio altamente atípicas e deve ser considerado uma exceção.
Explicação
Estudos teóricos sugerem que o mercúrio é único entre os elementos naturais do grupo 12 na formação de um tetrafluoreto , e atribuem essa observação a efeitos relativísticos . Pelos cálculos, os tetrafluoretos dos elementos "menos relativísticos" cádmio e zinco são instáveis e eliminam uma molécula de flúor, F 2 , para formar o complexo de difluoreto metálico. Por outro lado, prevê-se que o tetrafluoreto do elemento 112 sintético "mais relativístico", copernicium , seja mais estável. No entanto, estudos teóricos mais recentes lançam dúvidas sobre a possível existência de fluoreto de mercúrio (IV) e mesmo de copernício (IV).
Síntese e propriedades
O HgF 4 é produzido pela reação do mercúrio elementar com o flúor :
- Hg + 2 F 2 → HgF 4
O HgF 4 é estável apenas no isolamento da matriz a 4 K (−269 ° C); ao aquecer, ou se as moléculas de HgF 4 tocam umas nas outras, ele se decompõe em fluoreto de mercúrio (II) e flúor:
- HgF 4 → HgF 2 + F 2
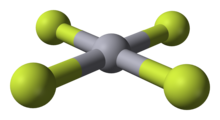
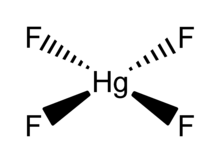
O HgF 4 é uma molécula plana quadrada diamagnética . O átomo de mercúrio tem uma configuração formal de elétrons 6s 2 5d 8 6p 6 e, como tal, obedece à regra do octeto, mas não à regra dos 18 elétrons . HgF 4 é isoeletrônico com o ânion tetrafluoroaurato , AuF -
4 , e é valência isoeletrônica com o tetracloroaurato ( AuCl -
4 ), tetrabromoaurato ( AuBr -
4 ), e tetracloroplatinato ( PtCl 2−
4 ) ânions.
