RNA mensageiro - Messenger RNA
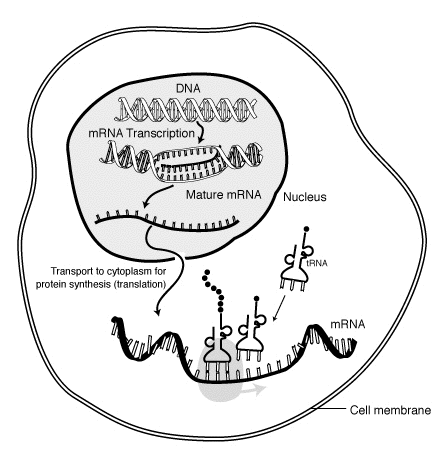
Em biologia molecular , o ácido ribonucléico mensageiro ( mRNA ) é uma molécula de RNA de fita simples que corresponde à sequência genética de um gene e é lida por um ribossomo no processo de síntese de uma proteína .
O mRNA é criado durante o processo de transcrição , onde uma enzima ( RNA polimerase ) converte o gene em mRNA transcrito primário (também conhecido como pré-mRNA ). Este pré-mRNA geralmente ainda contém íntrons , regiões que não irão codificar a sequência final de aminoácidos . Eles são removidos no processo de splicing do RNA , deixando apenas os exons , regiões que irão codificar a proteína. Esta sequência de exon constitui mRNA maduro . O mRNA maduro é então lido pelo ribossomo e, utilizando aminoácidos transportados pelo RNA de transferência (tRNA), o ribossomo cria a proteína. Este processo é conhecido como tradução . Todos esses processos fazem parte do dogma central da biologia molecular , que descreve o fluxo de informações genéticas em um sistema biológico.
Como no DNA , a informação genética no mRNA está contida na sequência de nucleotídeos , que são organizados em códons que consistem em três ribonucleotídeos cada. Cada códon codifica um aminoácido específico , exceto os códons de parada , que terminam a síntese de proteínas. A tradução de códons em aminoácidos requer dois outros tipos de RNA: RNA de transferência, que reconhece o códon e fornece o aminoácido correspondente, e RNA ribossômico (rRNA), o componente central da maquinaria de fabricação de proteínas do ribossomo.
A ideia do mRNA foi concebida pela primeira vez por Sydney Brenner e Francis Crick em 15 de abril de 1960 no King's College, Cambridge , enquanto François Jacob estava contando a eles sobre um experimento recente conduzido por Arthur Pardee , ele mesmo e Jacques Monod . Com o incentivo de Crick, Brenner e Jacob imediatamente começaram a testar essa nova hipótese e contataram Matthew Meselson , do Instituto de Tecnologia da Califórnia . Durante o verão de 1960, Brenner, Jacob e Meselson conduziram um experimento no laboratório de Meselson em Caltech que estabeleceu a existência de mRNA. Naquele outono, Jacob e Monod cunharam o nome de "RNA mensageiro" e desenvolveram a primeira estrutura teórica para explicar sua função. Em fevereiro de 1961, James Watson revelou que seu grupo de pesquisa estava logo atrás deles com um experimento semelhante mais ou menos na mesma direção; Brenner e os outros concordaram com o pedido de Watson de atrasar a publicação dos resultados de suas pesquisas. Como resultado, os artigos de Brenner e Watson foram publicados simultaneamente na mesma edição da Nature em maio de 1961, enquanto, naquele mesmo mês, Jacob e Monod publicaram seu arcabouço teórico para mRNA no Journal of Molecular Biology .
Síntese, processamento e função
A breve existência de uma molécula de mRNA começa com a transcrição e, finalmente, termina na degradação. Durante sua vida, uma molécula de mRNA também pode ser processada, editada e transportada antes da tradução. As moléculas de mRNA eucarióticas freqüentemente requerem processamento e transporte extensos, enquanto as moléculas de mRNA procarióticas não. Uma molécula de mRNA eucariótico e as proteínas ao seu redor são chamadas juntas de mensageiro RNP .
Transcrição
A transcrição ocorre quando o RNA é copiado do DNA. Durante a transcrição, a RNA polimerase faz uma cópia de um gene do DNA para o mRNA conforme necessário. Este processo difere ligeiramente em eucariotos e procariontes. Uma diferença notável é que a RNA polimerase procariótica se associa a enzimas de processamento de DNA durante a transcrição, de modo que o processamento pode prosseguir durante a transcrição. Portanto, isso faz com que a nova fita de mRNA se torne dupla, produzindo uma fita complementar conhecida como fita de tRNA, que quando combinada é incapaz de formar estruturas a partir do emparelhamento de bases. Além disso, o molde para o mRNA é a fita complementar do tRNA, que é idêntica em sequência à sequência do anticódon à qual o DNA se liga. O produto de vida curta, não processado ou parcialmente processado é denominado mRNA precursor ou pré-mRNA ; uma vez completamente processado, é denominado mRNA maduro .
Processamento de pré-mRNA eucariótico
O processamento de mRNA difere muito entre eucariotos , bactérias e arquéias . O mRNA não eucariótico é, em essência, maduro após a transcrição e não requer processamento, exceto em casos raros. O pré-mRNA eucariótico, entretanto, requer várias etapas de processamento antes de seu transporte para o citoplasma e sua tradução pelo ribossomo.
Splicing
O extenso processamento do pré-mRNA eucariótico que leva ao mRNA maduro é o splicing do RNA , um mecanismo pelo qual os íntrons ou outrons (regiões não codificantes) são removidos e os exons (regiões codificantes) são unidos.
Adição de 5 'cap
Um cap 5 ' (também denominado um cap de RNA, um cap de RNA 7-metilguanosina ou um cap de RNA m 7 G) é um nucleotídeo de guanina modificado que foi adicionado à "frente" ou extremidade 5' de um RNA mensageiro eucariótico em breve após o início da transcrição. O cap 5 'consiste em um resíduo terminal 7-metilguanosina que está ligado através de uma ligação 5'-5'-trifosfato ao primeiro nucleotídeo transcrito. Sua presença é crítica para o reconhecimento pelo ribossomo e proteção contra RNases .
A adição de cap é acoplada à transcrição e ocorre co-transcricionalmente, de modo que cada um influencia o outro. Logo após o início da transcrição, a extremidade 5 'do mRNA sendo sintetizado é ligada por um complexo de síntese de cap associado com a RNA polimerase . Este complexo enzimático catalisa as reações químicas necessárias para o capeamento do mRNA. A síntese ocorre como uma reação bioquímica de várias etapas .
Editando
Em alguns casos, um mRNA será editado , alterando a composição de nucleotídeos desse mRNA. Um exemplo em humanos é o mRNA da apolipoproteína B , que é editado em alguns tecidos, mas não em outros. A edição cria um códon de parada precoce, que, após a tradução, produz uma proteína mais curta.
Poliadenilação
A poliadenilação é a ligação covalente de uma porção poliadenilil a uma molécula de RNA mensageiro. Em organismos eucarióticos, a maioria das moléculas de RNA mensageiro (mRNA) são poliadeniladas na extremidade 3 ', mas estudos recentes mostraram que curtos trechos de uridina (oligouridilação) também são comuns. A cauda poli (A) e a proteína ligada a ela auxiliam na proteção do mRNA da degradação por exonucleases. A poliadenilação também é importante para a terminação da transcrição, exportação do mRNA do núcleo e tradução. O mRNA também pode ser poliadenilado em organismos procarióticos, onde caudas de poli (A) atuam para facilitar, em vez de impedir, a degradação exonucleolítica.
A poliadenilação ocorre durante e / ou imediatamente após a transcrição do DNA em RNA. Após o término da transcrição, a cadeia de mRNA é clivada pela ação de um complexo de endonuclease associado à RNA polimerase. Após o mRNA ter sido clivado, cerca de 250 resíduos de adenosina são adicionados à extremidade 3 'livre no local de clivagem. Esta reação é catalisada pela poliadenilato polimerase. Assim como no splicing alternativo , pode haver mais de uma variante de poliadenilação de um mRNA.
Também ocorrem mutações no local de poliadenilação. O transcrito primário de RNA de um gene é clivado no local de adição de poli-A, e 100–200 As são adicionados à extremidade 3 'do RNA. Se este local for alterado, uma construção de mRNA anormalmente longa e instável será formada.
Transporte
Outra diferença entre eucariotos e procariontes é o transporte de mRNA. Como a transcrição e tradução eucarióticas são separadas por compartimentos, os mRNAs eucarióticos devem ser exportados do núcleo para o citoplasma - um processo que pode ser regulado por diferentes vias de sinalização. Os mRNAs maduros são reconhecidos por suas modificações processadas e, em seguida, exportados através do poro nuclear pela ligação às proteínas de ligação a cap CBP20 e CBP80, bem como ao complexo de transcrição / exportação (TREX). Múltiplas vias de exportação de mRNA foram identificadas em eucariotos.
Em células espacialmente complexas, alguns mRNAs são transportados para destinos subcelulares específicos. Em neurônios maduros , certos mRNAs são transportados do soma para os dendritos . Um local de tradução do mRNA está em polirribossomos seletivamente localizados abaixo das sinapses. O mRNA para Arc / Arg3.1 é induzido pela atividade sináptica e localiza-se seletivamente perto das sinapses ativas com base nos sinais gerados pelos receptores NMDA. Outros mRNAs também se movem para dendritos em resposta a estímulos externos, como o mRNA de β-actina. Após a exportação do núcleo, o mRNA da actina associa-se à ZBP1 e à subunidade 40S. O complexo é ligado por uma proteína motora e é transportado para o local alvo (extensão da neurite) ao longo do citoesqueleto. Eventualmente, ZBP1 é fosforilado por Src para que a tradução seja iniciada. No desenvolvimento de neurônios, os mRNAs também são transportados para os axônios em crescimento e, especialmente, para os cones de crescimento. Muitos mRNAs são marcados com os chamados "códigos postais", que direcionam seu transporte para um local específico.
Tradução
Como o mRNA procariótico não precisa ser processado ou transportado, a tradução pelo ribossomo pode começar imediatamente após o final da transcrição. Portanto, pode-se dizer que a tradução procariótica é acoplada à transcrição e ocorre co-transcricionalmente .
O mRNA eucariótico que foi processado e transportado para o citoplasma (isto é, mRNA maduro) pode então ser traduzido pelo ribossomo. A tradução pode ocorrer em ribossomos flutuando livremente no citoplasma ou direcionada ao retículo endoplasmático pela partícula de reconhecimento de sinal . Portanto, ao contrário dos procariotos, a tradução eucariótica não está diretamente acoplada à transcrição. É até possível em alguns contextos que níveis reduzidos de mRNA sejam acompanhados por níveis aumentados de proteína, como foi observado para níveis de mRNA / proteína de EEF1A1 no câncer de mama.
Estrutura

Regiões de codificação
As regiões codificantes são compostas por códons , que são decodificados e traduzidos em proteínas pelo ribossomo; em eucariotos geralmente em um e em procariotos geralmente em vários. As regiões de codificação começam com o códon de início e terminam com um códon de parada . Em geral, o códon de início é um tripleto AUG e o códon de parada é UAG ("âmbar"), UAA ("ocre") ou UGA ("opala"). As regiões de codificação tendem a ser estabilizadas por pares de base internos, o que impede a degradação. Além de serem codificadores de proteínas, porções de regiões codificantes podem servir como sequências regulatórias no pré-mRNA como intensificadores de splicing exônicos ou silenciadores de splicing exônicos .
Regiões não traduzidas
As regiões não traduzidas (UTRs) são seções do mRNA antes do códon de início e após o códon de parada que não são traduzidas, denominadas as cinco regiões não traduzidas principais (5 'UTR) e três regiões não traduzidas principais (UTR 3'), respectivamente. Essas regiões são transcritas com a região codificadora e, portanto, são exônicas , pois estão presentes no mRNA maduro. Vários papéis na expressão gênica foram atribuídos às regiões não traduzidas, incluindo a estabilidade do mRNA, a localização do mRNA e a eficiência da tradução . A capacidade de uma UTR de realizar essas funções depende da sequência da UTR e pode diferir entre os mRNAs. Variantes genéticas em 3 'UTR também foram implicadas na suscetibilidade à doença devido à mudança na estrutura do RNA e na tradução da proteína.
A estabilidade dos mRNAs pode ser controlada pela 5 'UTR e / ou 3' UTR devido à afinidade variável para enzimas degradantes de RNA chamadas ribonucleases e para proteínas auxiliares que podem promover ou inibir a degradação de RNA. (Veja também, elemento de estabilidade rico em C ).
A eficiência translacional, incluindo às vezes a inibição completa da tradução, pode ser controlada por UTRs. As proteínas que se ligam à UTR 3 'ou 5' podem afetar a tradução ao influenciar a capacidade do ribossomo de se ligar ao mRNA. MicroRNAs ligados à 3 'UTR também podem afetar a eficiência da tradução ou a estabilidade do mRNA.
A localização citoplasmática do mRNA é considerada uma função da 3 'UTR. As proteínas que são necessárias em uma determinada região da célula também podem ser traduzidas lá; em tal caso, o UTR 3 'pode conter sequências que permitem que o transcrito seja localizado nesta região para tradução.
Alguns dos elementos contidos em regiões não traduzidas formam uma estrutura secundária característica quando transcritos em RNA. Esses elementos estruturais do mRNA estão envolvidos na regulação do mRNA. Alguns, como o elemento SECIS , são alvos para a ligação de proteínas. Uma classe de elemento de mRNA, os riboswitches , ligam-se diretamente a pequenas moléculas, mudando sua dobra para modificar os níveis de transcrição ou tradução. Nestes casos, o mRNA se auto-regula.
Cauda poli (A)
A cauda poli (A) 3 'é uma longa sequência de nucleotídeos de adenina (frequentemente várias centenas) adicionados à extremidade 3' do pré-mRNA. Esta cauda promove a exportação do núcleo e a tradução, e protege o mRNA da degradação.
MRNA monocistrônico versus policistrônico
Uma molécula de mRNA é considerada monocistrônica quando contém a informação genética para traduzir apenas uma única cadeia de proteína (polipeptídeo). Este é o caso da maioria dos mRNAs eucarióticos . Por outro lado, o mRNA policistrônico carrega vários quadros de leitura aberta (ORFs), cada um dos quais é traduzido em um polipeptídeo. Esses polipeptídeos geralmente têm uma função relacionada (muitas vezes são as subunidades que compõem uma proteína complexa final) e sua sequência de codificação é agrupada e regulada em uma região reguladora, contendo um promotor e um operador . A maior parte do mRNA encontrado em bactérias e arquéias é policistrônico, assim como o genoma mitocondrial humano. O mRNA dicistrônico ou bicistrônico codifica apenas duas proteínas .
circularização de mRNA
Em eucariotos, as moléculas de mRNA formam estruturas circulares devido a uma interação entre o eIF4E e a proteína de ligação a poli (A) , que se ligam a eIF4G , formando uma ponte mRNA-proteína-mRNA. A circularização é pensada para promover a ciclagem de ribossomos no mRNA levando a uma tradução eficiente em tempo, e também pode funcionar para garantir que apenas o mRNA intacto seja traduzido (mRNA parcialmente degradado caracteristicamente não tem capa m7G, ou nenhuma cauda poli-A).
Existem outros mecanismos de circularização, particularmente no mRNA do vírus. O mRNA do poliovírus usa uma seção de trevo em direção à sua extremidade 5 'para se ligar ao PCBP2, que se liga à proteína de ligação poli (A) , formando o familiar círculo mRNA-proteína-mRNA. O vírus da anã amarela da cevada tem ligação entre os segmentos de mRNA em sua extremidade 5 'e 3' (chamados laços de haste beijando), circularizando o mRNA sem qualquer proteína envolvida.
Genomas de vírus de RNA (as fitas + dos quais são traduzidos como mRNA) também são comumente circularizados. Durante a replicação do genoma, a circularização atua para aumentar as velocidades de replicação do genoma, fazendo o ciclo da polimerase de RNA dependente de RNA viral muito semelhante ao ribossomo.
Degradação
Diferentes mRNAs dentro da mesma célula têm tempos de vida distintos (estabilidades). Em células bacterianas, os mRNAs individuais podem sobreviver de segundos a mais de uma hora. No entanto, a média de vida é entre 1 e 3 minutos, tornando o mRNA bacteriano muito menos estável do que o mRNA eucariótico. Em células de mamíferos, o tempo de vida do mRNA varia de vários minutos a dias. Quanto maior a estabilidade de um mRNA, mais proteína pode ser produzida a partir desse mRNA. O tempo de vida limitado do mRNA permite que uma célula altere a síntese de proteínas rapidamente em resposta às suas necessidades de mudança. Existem muitos mecanismos que levam à destruição de um mRNA, alguns dos quais são descritos a seguir.
Degradação de mRNA procariótica
Em geral, em procariotos, o tempo de vida do mRNA é muito mais curto do que em eucariotos. Os procariotos degradam as mensagens usando uma combinação de ribonucleases, incluindo endonucleases, 3 'exonucleases e 5' exonucleases. Em alguns casos, pequenas moléculas de RNA (sRNA) com dezenas a centenas de nucleotídeos de comprimento podem estimular a degradação de mRNAs específicos por emparelhamento de bases com sequências complementares e facilitando a clivagem da ribonuclease por RNase III . Recentemente, foi demonstrado que as bactérias também têm uma espécie de capa 5 ' consistindo de um trifosfato na extremidade 5' . A remoção de dois dos fosfatos deixa um monofosfato 5 ', fazendo com que a mensagem seja destruída pela exonuclease RNase J, que degrada 5' para 3 '.
Volume de negócios do mRNA eucariótico
Dentro das células eucarióticas, há um equilíbrio entre os processos de tradução e decaimento do mRNA. As mensagens que estão sendo traduzidas ativamente são ligadas por ribossomos , os fatores de iniciação de eucariotos eIF-4E e eIF-4G e proteína de ligação poli (A) . O eIF-4E e o eIF-4G bloqueiam a enzima de decapagem ( DCP2 ) e a proteína de ligação a poli (A) bloqueia o complexo do exossomo , protegendo as extremidades da mensagem. O equilíbrio entre a tradução e deterioração reflecte-se no tamanho e na abundância de estruturas citoplasmicas conhecidos como corpos de processamento A cauda poli (A) do mRNA é encurtado por exonucleases especializado que são direccionados para RNAs mensageiros específicas através de uma combinação de sequências de cis-reguladoras no RNA e nas proteínas de ligação ao RNA de ação trans. Acredita-se que a remoção da cauda de poli (A) interrompa a estrutura circular da mensagem e desestabilize o complexo de ligação da tampa . A mensagem é então sujeita a degradação pelo complexo exossomo ou pelo complexo de decapagem . Dessa forma, as mensagens inativas de tradução podem ser destruídas rapidamente, enquanto as mensagens ativas permanecem intactas. O mecanismo pelo qual a tradução para e a mensagem é entregue aos complexos de decomposição não é compreendido em detalhes.
Decaimento de elemento rico em AU
A presença de elementos ricos em AU em alguns mRNAs de mamíferos tende a desestabilizar esses transcritos por meio da ação de proteínas celulares que se ligam a essas sequências e estimulam a remoção da cauda poli (A) . Acredita-se que a perda da cauda poli (A) promova a degradação do mRNA ao facilitar o ataque tanto do complexo exossomo quanto do complexo de decapagem . A rápida degradação do mRNA por meio de elementos ricos em AU é um mecanismo crítico para prevenir a superprodução de citocinas potentes, como o fator de necrose tumoral (TNF) e o fator estimulador de colônia de granulócitos-macrófagos (GM-CSF). Elementos ricos em AU também regulam a biossíntese de fatores de transcrição proto-oncogênicos como c-Jun e c-Fos .
Decadência mediada por absurdos
As mensagens eucarióticas estão sujeitas à vigilância por decaimento mediado por nonsense (NMD), que verifica a presença de códons de parada prematuros (códons sem sentido) na mensagem. Estes podem surgir por meio de splicing incompleto, recombinação V (D) J no sistema imune adaptativo , mutações no DNA, erros de transcrição, varredura com vazamento pelo ribossomo causando uma mudança de quadro e outras causas. A detecção de um códon de parada prematura desencadeia a degradação do mRNA por decapagem 5 ', remoção da cauda poli (A) 3' ou clivagem endonucleolítica .
RNA de interferência pequeno (siRNA)
Em metazoários , pequenos RNAs de interferência (siRNAs) processados por Dicer são incorporados a um complexo conhecido como complexo de silenciamento induzido por RNA ou RISC. Este complexo contém uma endonuclease que cliva mensagens perfeitamente complementares às quais o siRNA se liga. Os fragmentos de mRNA resultantes são então destruídos por exonucleases . O siRNA é comumente usado em laboratórios para bloquear a função de genes em cultura de células. Acredita-se que seja parte do sistema imunológico inato como uma defesa contra vírus de RNA de fita dupla.
MicroRNA (miRNA)
MicroRNAs (miRNAs) são pequenos RNAs que normalmente são parcialmente complementares às sequências em RNAs mensageiros de metazoários. A ligação de um miRNA a uma mensagem pode reprimir a tradução dessa mensagem e acelerar a remoção da cauda poli (A), acelerando assim a degradação do mRNA. O mecanismo de ação dos miRNAs é objeto de pesquisas ativas.
Outros mecanismos de decaimento
Existem outras maneiras pelas quais as mensagens podem ser degradadas, incluindo decadência ininterrupta e silenciamento por RNA de interação com Piwi (piRNA), entre outros.
Formulários
A administração de uma sequência de RNA mensageiro modificada por nucleosídeo pode fazer com que uma célula produza uma proteína, a qual, por sua vez, pode tratar diretamente uma doença ou pode funcionar como uma vacina ; mais indiretamente, a proteína poderia levar uma célula-tronco endógena a se diferenciar da maneira desejada.
Os principais desafios da terapia de RNA centram-se na entrega do RNA às células apropriadas. Os desafios incluem o fato de que as sequências nuas de RNA se degradam naturalmente após a preparação; eles podem acionar o sistema imunológico do corpo para atacá-los como um invasor; e eles são impermeáveis à membrana celular . Uma vez dentro da célula, eles devem deixar o mecanismo de transporte da célula para agir dentro do citoplasma , que abriga os ribossomos necessários .
Superando esses desafios, o mRNA como terapêutico foi apresentado pela primeira vez em 1989 "após o desenvolvimento de uma técnica de transfecção in vitro amplamente aplicável." Na década de 1990, vacinas de mRNA para câncer personalizado foram desenvolvidas, contando com mRNA modificado não nucleosídeo. As terapias baseadas em mRNA continuam a ser investigadas como um método de tratamento ou terapia tanto para o câncer quanto para doenças inflamatórias autoimunes, metabólicas e respiratórias. Terapias de edição de genes, como CRISPR, também podem se beneficiar do uso de mRNA para induzir as células a produzir a proteína Cas desejada .
Desde 2010, as vacinas de RNA e outras terapêuticas de RNA foram consideradas "uma nova classe de drogas". As primeiras vacinas baseadas em mRNA receberam autorização restrita e foram lançadas em todo o mundo durante a pandemia de COVID-19 pela vacina COVID-19 da Pfizer – BioNTech e pela Moderna , por exemplo.
Veja também
- GeneCalling , uma tecnologia de criação de perfil de mRNA
- Missense mRNA
- exibição de mRNA
- vigilância mRNA
- Transcriptoma , a soma de todo o RNA em uma célula
Referências
Leitura adicional
- Alsaweed M, Lai CT, Hartmann PE, Geddes DT, Kakulas F (fevereiro de 2016). "Os miRNAs de leite humano originam-se principalmente da glândula mamária, resultando em perfis de miRNA únicos de leite fracionado" . Relatórios científicos . 6 (1): 20680. bibcode : 2016NatSR ... 620680A . doi : 10.1038 / srep20680 . PMC 4745068 . PMID 26854194 .
- Lillycrop KA, Burdge GC (outubro de 2012). "Mecanismos epigenéticos que ligam a nutrição precoce à saúde a longo prazo". Melhores práticas e pesquisa. Endocrinologia Clínica e Metabolismo . 26 (5): 667–676. doi : 10.1016 / j.beem.2012.03.009 . PMID 22980048 .
- Melnik BC, Kakulas F, Geddes DT, Hartmann PE, John SM, Carrera-Bastos P, Cordain L, Schmitz G (21 de junho de 2016). "Leite miRNAs: nutrientes simples ou reguladores funcionais sistêmicos?" . Nutrição e Metabolismo . 13 (1): 42. doi : 10.1186 / s12986-016-0101-2 . PMC 4915038 . PMID 27330539 .
- Vickers MH (junho de 2014). "Nutrição na primeira infância, epigenética e programação das doenças posteriores da vida" . Nutrientes . 6 (6): 2165–2178. doi : 10.3390 / nu6062165 . PMC 4073141 . PMID 24892374 .
- Zhou Q, Li M, Wang X, Li Q, Wang T, Zhu Q, Zhou X, Wang X, Gao X, Li X (2012). "MicroRNAs relacionados ao sistema imunológico são abundantes nos exossomos do leite materno" . Revista Internacional de Ciências Biológicas . 8 (1): 118–123. doi : 10.7150 / ijbs.8.118 . PMC 3248653 . PMID 22211110 .
links externos
| Scholia tem um perfil para RNA mensageiro (Q188928) . |
- RNAi Atlas : um banco de dados de bibliotecas RNAi e seus resultados de análise de destino
- miRSearch : ferramenta para encontrar microRNAs que têm como alvo o mRNA
- Como o mRNA é codificado? : Vídeo do youtube
- O que é mRNA? : theconversation.com
