Metionina - Methionine

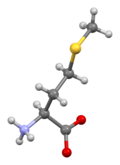
Fórmula esquelética da forma canônica de metionina
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Metionina
|
|||
| Outros nomes
Ácido 2-amino-4- (metiltio) butanoico
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| Abreviações | Met, M | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100.000.393 |
||
| Número EC | |||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 5 H 11 N O 2 S | |||
| Massa molar | 149,21 g · mol −1 | ||
| Aparência | Pó cristalino branco | ||
| Densidade | 1,340 g / cm 3 | ||
| Ponto de fusão | 281 ° C (538 ° F; 554 K) se decompõe | ||
| Solúvel | |||
| Acidez (p K a ) | 2,28 (carboxil), 9,21 (amino) | ||
| Farmacologia | |||
| V03AB26 ( OMS ) QA05BA90 ( OMS ), QG04BA90 ( OMS ) | |||
| Página de dados suplementares | |||
|
Índice de refração ( n ), constante dielétrica (ε r ), etc. |
|||
|
Dados termodinâmicos |
Comportamento da fase sólido-líquido-gás |
||
| UV , IR , NMR , MS | |||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
Metionina (símbolo Met ou M ) ( / m do ɪ q aɪ ə n i n / ) é um aminoácido essencial em seres humanos. Como substrato para outros aminoácidos, como cisteína e taurina , compostos versáteis como SAM-e e o importante antioxidante glutationa , a metionina desempenha um papel crítico no metabolismo e na saúde de muitas espécies, incluindo humanos. É codificado pelo códon AUG.
A metionina também é uma parte importante da angiogênese , o crescimento de novos vasos sanguíneos. A suplementação pode beneficiar aqueles que sofrem de envenenamento por cobre. O consumo excessivo de metionina, o doador do grupo metil na metilação do DNA , está relacionado ao crescimento do câncer em vários estudos. A metionina foi isolada pela primeira vez em 1921 por John Howard Mueller .
Detalhes bioquímicos
A metionina (abreviada como Met ou M ; codificada pelo códon AUG) é um α- aminoácido usado na biossíntese de proteínas . Ele contém um grupo α-amino (que está na forma −NH 3 + protonada em condições biológicas), um grupo carboxila (que está na forma −COO - desprotonada em condições biológicas) e uma cadeia lateral de tioéter S-metílico , classificando-o como um não-polar , alifático aminoácido.
Em genes nucleares de eucariotos e em Archaea , a metionina é codificada pelo códon de início , o que significa que indica o início da região codificadora e é o primeiro aminoácido produzido em um polipeptídeo nascente durante a tradução do mRNA .
Um aminoácido proteinogênico
Junto com a cisteína , a metionina é um dos dois aminoácidos proteinogênicos contendo enxofre . Excluindo as poucas exceções em que a metionina pode atuar como um sensor redox (por exemplo,), os resíduos de metionina não têm um papel catalítico. Isso está em contraste com os resíduos de cisteína, onde o grupo tiol tem um papel catalítico em muitas proteínas. O tioéter, entretanto, tem um papel estrutural menor devido ao efeito de estabilidade das interações S / π entre o átomo de enxofre da cadeia lateral e os aminoácidos aromáticos em um terço de todas as estruturas de proteínas conhecidas. Esta falta de um papel forte é refletida em experimentos onde pouco efeito é visto em proteínas onde a metionina é substituída por norleucina , um aminoácido de cadeia lateral de hidrocarboneto direto que não possui o tioéter. Foi conjecturado que a norleucina estava presente nas primeiras versões do código genético, mas a metionina intrometeu-se na versão final do código genético devido ao fato de ser usada no cofator S -adenosil metionina (SAM-e). Esta situação não é única e pode ter ocorrido com ornitina e arginina.
Codificação
A metionina é um dos dois únicos aminoácidos codificados por um único códon (AUG) no código genético padrão ( triptofano , codificado por UGG, é o outro). Em reflexão à origem evolutiva de seu códon, os outros códons da AUN codificam a isoleucina, que também é um aminoácido hidrofóbico. No genoma mitocondrial de vários organismos, incluindo metazoa e levedura , o códon AUA também codifica para metionina. No código genético padrão, os códigos AUA para isoleucina e o respectivo tRNA ( ileX em Escherichia coli ) usam a base incomum lisidina (bactéria) ou agmatidina (archaea) para discriminar contra AUG.
O códon de metionina AUG também é o códon de início mais comum. Um códon "Iniciar" é uma mensagem para um ribossomo que sinaliza o início da tradução da proteína a partir do mRNA quando o códon AUG está em uma sequência de consenso Kozak . Como consequência, a metionina é frequentemente incorporada na posição N-terminal de proteínas em eucariotos e arquéias durante a tradução, embora possa ser removida por modificação pós-tradução . Em bactérias , o derivado N- formilmetionina é usado como o aminoácido inicial.
Derivados
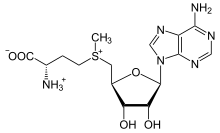
S -adenosil-metionina
O derivado de metionina S- adenosil metionina (SAM-e) é um cofator que atua principalmente como um doador de metila . SAM-e é composto de uma molécula de adenosila (via carbono 5 ') ligada ao enxofre da metionina, tornando-a, portanto, um cátion sulfônio (ou seja, três substituintes e carga positiva). O enxofre atua como um ácido de Lewis macio (ou seja, doador / eletrófilo) que permite que o grupo S- metila seja transferido para um sistema de oxigênio, nitrogênio ou aromático, muitas vezes com a ajuda de outros cofatores, como a cobalamina (vitamina B12 em humanos ) Algumas enzimas usam SAM-e para iniciar uma reação radical; estes são chamados de enzimas SAM -e radicais . Como resultado da transferência do grupo metil, S-adenosil-homocisteína é obtida. Nas bactérias, este é regenerado por metilação ou é recuperado pela remoção da adenina e da homocisteína, deixando o composto diidroxipentandiona se converter espontaneamente em autoindutor-2 , que é excretado como um produto residual / sinal de quorum.
Biossíntese
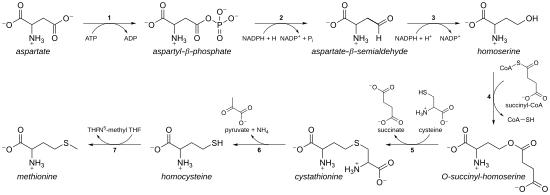
Como um aminoácido essencial, a metionina não é sintetizada de novo em humanos e outros animais, que devem ingerir metionina ou proteínas que contêm metionina. Em plantas e microrganismos, a biossíntese de metionina pertence à família do aspartato , junto com a treonina e a lisina (via diaminopimelato , mas não via α-aminoadipato ). O esqueleto principal é derivado do ácido aspártico , enquanto o enxofre pode vir da cisteína , metanotiol ou sulfeto de hidrogênio .
- Primeiro, o ácido aspártico é convertido via β-aspartil-semialdeído em homosserina por duas etapas de redução do grupo carboxila terminal (a homosserina tem, portanto, um γ-hidroxila, daí a homossérie ). O aspartato-semialdeído intermediário é o ponto de ramificação com a via biossintética da lisina, onde é condensado com o piruvato. A homosserina é o ponto de ramificação com a via da treonina, onde, em vez disso, é isomerizada após a ativação da hidroxila terminal com fosfato (também usado para a biossíntese de metionina em plantas).
- A homoserina é então ativada com um fosfato, succinila ou um grupo acetila na hidroxila.
- Em plantas e possivelmente em algumas bactérias, o fosfato é usado. Esta etapa é compartilhada com a biossíntese de treonina.
- Na maioria dos organismos, um grupo acetil é usado para ativar a homosserina. Isso pode ser catalisado em bactérias por uma enzima codificada por metX ou metA (não homólogos).
- Em enterobactérias e em um número limitado de outros organismos, o succinato é usado. A enzima que catalisa a reação é MetA e a especificidade para acetil-CoA e succinil-CoA é ditada por um único resíduo. A base fisiológica para a preferência de acetil-CoA ou succinil-CoA é desconhecida, mas tais rotas alternativas estão presentes em algumas outras vias ( por exemplo, biossíntese de lisina e biossíntese de arginina).
- O grupo de ativação de hidroxila é então substituído por cisteína, metanotiol ou sulfeto de hidrogênio. Uma reação de substituição é tecnicamente uma eliminação γ seguida por uma variante de uma adição de Michael . Todas as enzimas envolvidas são homólogas e membros da família de enzimas dependentes de PLP do metabolismo Cys / Met , que é um subconjunto do clado tipo I de dobra dependente de PLP. Eles utilizam o cofator PLP ( fosfato de piridoxal ), que funciona estabilizando intermediários de carbanião.
- Se reage com a cisteína, produz cistationina , que é clivada para dar homocisteína . As enzimas envolvidas são cistationina-γ-sintase (codificada por metB em bactérias) e cistationina-β-liase ( metC ). A cistationina está ligada de forma diferente nas duas enzimas, permitindo que as reações β ou γ ocorram.
- Se ele reage com o sulfeto de hidrogênio livre, ele produz homocisteína. Este é catalisado pela O- acetilhomoserina aminocarboxipropiltransferase (anteriormente conhecida como O -acetilhomoserina (tiol) -lyase. É codificada por metY ou metZ nas bactérias.
- Se reage com o metanotiol, produz metionina diretamente. O metanotiol é um subproduto da via catabólica de certos compostos, portanto, essa via é mais incomum.
- Se a homocisteína for produzida, o grupo tiol é metilado, produzindo metionina. Duas metionina sintases são conhecidas; um é dependente da cobalamina (vitamina B 12 ) e o outro é independente.
A via de uso da cisteína é chamada de " via de transulfuração ", enquanto a via de sulfeto de hidrogênio (ou metanotiol) é chamada de "via de sulfurilação direta".
A cisteína é produzida de forma semelhante, nomeadamente pode ser feita a partir de uma serina activada e quer a partir da homocisteína ("via de trans-sulfurilação reversa") ou de sulfureto de hidrogénio ("via de sulfurilação directa"); a serina ativada é geralmente O -acetilserina (via CysK ou CysM em E. coli ), mas em Aeropyrum pernix e alguma outra archaea O- fosfoserina é usada. CysK e CysM são homólogos, mas pertencem ao clado PLP fold tipo III.
Via de trans-sulfurilação
Enzimas envolvidas na rota de trans-sulfurilação de E. coli da biossíntese de metionina:
- Aspartoquinase
- Aspartato-semialdeído desidrogenase
- Homosserina desidrogenase
- Homoserina O-transsuccinilase
- Cistationina-γ-sintase
- Cistationina-β-liase
- Metionina sintase (em mamíferos, esta etapa é realizada pela homocisteína metiltransferase ou betaína - homocisteína S-metiltransferase .)
Outras vias bioquímicas
Embora os mamíferos não possam sintetizar metionina, eles ainda podem usá-la em uma variedade de vias bioquímicas:
Catabolismo
A metionina é convertida em S-adenosilmetionina (SAM-e) por (1) metionina adenosiltransferase .
SAM-e atua como um doador de metil em muitas (2) reações de metiltransferase e é convertido em S- adenosil-homocisteína (SAH).
(3) Adenosil-homocisteinase cisteína.
Regeneração
A metionina pode ser regenerada a partir da homocisteína via (4) metionina sintetase em uma reação que requer vitamina B 12 como cofator .
A homocisteína também pode ser remetilada usando glicina betaína (NNN-trimetil glicina, TMG) em metionina por meio da enzima betaína-homocisteína metiltransferase (EC2.1.1.5, BHMT). O BHMT constitui até 1,5% de todas as proteínas solúveis do fígado e evidências recentes sugerem que pode ter uma influência maior na homeostase da metionina e da homocisteína do que a metionina sintase.
Via de transulfurilação reversa: conversão em cisteína
A homocisteína pode ser convertida em cisteína.
- (5) A cistationina-β-sintase (uma enzima que requer a forma ativa da vitamina B6 , o fosfato de piridoxal ) combina homocisteína e serina para produzir cistationina . Em vez de degradar a cistationina via cistationina-β-liase , como na via biossintética, a cistationina é quebrada em cisteína e α-cetobutirato via (6) cistationina-γ-liase .
- (7) A enzima α-cetoácido desidrogenase converte α-cetobutirato em propionil-CoA , que é metabolizado em succinil-CoA em um processo de três etapas (ver propionil-CoA para a via).
Síntese de etileno
Este aminoácido também é usado por plantas para a síntese de etileno . O processo é conhecido como ciclo Yang ou ciclo da metionina.
Síntese química
A síntese industrial combina acroleína , metanotiol e cianeto, que dá origem à hidantoína . A metionina racêmica também pode ser sintetizada a partir de dietil sódio ftalimidomalonato por alquilação com cloroetilmetilsulfeto (ClCH 2 CH 2 SCH 3 ) seguido por hidrólise e descarboxilação.
Nutrição humana
Requisitos
O Food and Nutrition Board do US Institute of Medicine definiu as recomendações dietéticas (RDAs) para aminoácidos essenciais em 2002. Para metionina combinada com cisteína, para adultos com 19 anos ou mais, 19 mg / kg de peso corporal / dia.
Isso se traduz em cerca de 1,33 gramas por dia para um indivíduo de 70 kg.
Fontes dietéticas
| Comida | g / 100g |
|---|---|
| Ovo , branco, seco, em pó, glicose reduzida | 3.204 |
| Farinha de sementes de gergelim (baixo teor de gordura) | 1.656 |
| castanha-do-pará | 1,124 |
| Queijo , Parmesão, desfiado | 1,114 |
| semente de cânhamo , descascada | 0,933 |
| Concentrado de proteína de soja | 0,814 |
| Frango , frango ou fritadeira, assado | 0,801 |
| Peixe , atum, light, enlatado em água, sólidos drenados | 0,755 |
| Carne , curada, seca | 0,749 |
| Bacon | 0,593 |
| sementes de chia | 0,588 |
| Carne , moída, 95% carne magra / 5% gordura, crua | 0,565 |
| Carne de porco , moída, 96% magra / 4% gordura, crua | 0,564 |
| Soja | 0,547 |
| Germe do trigo | 0,456 |
| Ovo , inteiro, cozido, cozido | 0,392 |
| Aveia | 0,312 |
| Amendoim | 0,309 |
| Grão de bico | 0,253 |
| Milho , amarelo | 0,197 |
| Amêndoas | 0,151 |
| Feijão, pinto, cozido | 0,117 |
| Lentilhas cozidas | 0,077 |
| Arroz , marrom, grão médio, cozido | 0,052 |
Altos níveis de metionina podem ser encontrados em ovos, carnes e peixes; sementes de gergelim, castanha do Brasil e algumas outras sementes de plantas; e grãos de cereais . A maioria das frutas e vegetais contém muito pouco. A maioria das leguminosas , embora densa em proteínas, tem baixo teor de metionina. Proteínas sem metionina adequada não são consideradas proteínas completas . Por esse motivo, a metionina racêmica às vezes é adicionada como ingrediente de alimentos para animais de estimação .
Restrição
Algumas evidências científicas indicam que a restrição do consumo de metionina pode aumentar a expectativa de vida das moscas-das-frutas.
Um estudo de 2005 mostrou que a restrição de metionina sem restrição de energia estende a expectativa de vida dos camundongos. Essa extensão requer sinalização intacta do hormônio do crescimento, uma vez que animais sem sinalização intacta do hormônio do crescimento não têm um aumento adicional na expectativa de vida quando a metionina é restrita. A resposta metabólica à restrição de metionina também é alterada em mutantes de sinalização do hormônio de crescimento de camundongos.
Um estudo publicado na Nature mostrou que adicionar apenas o aminoácido essencial metionina à dieta de moscas- das- frutas sob restrição dietética, incluindo restrição de aminoácidos essenciais (EAAs), restaurou a fertilidade sem reduzir o maior tempo de vida típico da restrição alimentar, levando os pesquisadores para determinar que a metionina "atua em combinação com um ou mais outros EAAs para encurtar a vida útil." Restaurar a metionina na dieta de camundongos em um regime de restrição dietética bloqueia muitos benefícios agudos da restrição dietética, um processo que pode ser mediado pelo aumento da produção de sulfeto de hidrogênio.
Vários estudos mostraram que a restrição de metionina também inibe os processos de doenças relacionadas ao envelhecimento em camundongos e inibe a carcinogênese do cólon em ratos. Em humanos, a restrição de metionina por meio de modificação dietética pode ser alcançada por meio de uma dieta à base de plantas.
A restrição da metionina na dieta reduz os níveis de seu catabólito S-adenosilmetionina (SAM-e), resultando em uma perda subsequente da metilação das histonas . Um processo ativo mediado por uma metilação preservada e específica de H3K9 preserva a memória do perfil de metilação original, permitindo que o epigenoma seja restaurado durante a dieta quando os níveis de metionina retornam.
Um estudo de 2009 em ratos mostrou que "a suplementação de metionina na dieta aumenta especificamente a produção de ROS mitocondrial e o dano oxidativo do DNA mitocondrial em mitocôndrias de fígado de rato, oferecendo um mecanismo plausível para sua hepatotoxicidade ".
No entanto, como a metionina é um aminoácido essencial , não pode ser totalmente removida da dieta dos animais sem que ocorra doença ou morte ao longo do tempo. Por exemplo, ratos alimentados com uma dieta sem metionina e colina desenvolveram esteatohepatite (fígado gorduroso) e anemia , e perderam dois terços de seu peso corporal em 5 semanas. A administração de metionina melhorou as consequências patológicas da privação de metionina. A remoção a curto prazo de apenas metionina da dieta pode reverter a obesidade induzida pela dieta e promove a sensibilidade à insulina em camundongos, e a restrição de metionina também protege um modelo de camundongo de obesidade poligênica espontânea e diabetes.
Saúde
A perda de metionina tem sido associada ao envelhecimento senil do cabelo. Sua falta leva ao acúmulo de peróxido de hidrogênio nos folículos capilares, à redução da eficácia da tirosinase e à perda gradual da cor do cabelo. A metionina aumenta a concentração intracelular de GSH, promovendo assim a defesa celular mediada por antioxidantes e a regulação redox. Ele também protege as células contra a perda de células negras induzida pela dopamina, ligando-se a metabólitos oxidativos.
A metionina é um intermediário na biossíntese de cisteína , carnitina , taurina , lecitina , fosfatidilcolina e outros fosfolipídios . A conversão inadequada de metionina pode levar à aterosclerose devido ao acúmulo de homocisteína .
Outros usos
A DL- metionina é algumas vezes administrada como suplemento aos cães; Ajuda a reduzir as chances de pedras nos rins em cães. A metionina também é conhecida por aumentar a excreção urinária de quinidina por acidificação da urina. Os antibióticos aminoglicosídeos usados para tratar infecções do trato urinário funcionam melhor em condições alcalinas, e a acidificação urinária com o uso de metionina pode reduzir sua eficácia. Se um cão está em uma dieta que acidifica a urina, a metionina não deve ser usada.
A metionina é permitida como suplemento à ração orgânica de aves de acordo com o programa orgânico certificado dos EUA.
A metionina pode ser usada como uma opção de pesticida não tóxico contra lagartas gigantes da cauda de andorinha , que são uma praga séria para as plantações de laranja.
Veja também
- Alantoína
- Formilmetionina
- Oxidação de metionina
- Envenenamento por paracetamol
- Metionina fotorreativa
- S-Metilcisteína
Referências
links externos
- Rudra MN, Chowdhury LM (30 de setembro de 1950). “Teor de Metionina em Cereais e Legumes” . Nature . 166 (568): 568. bibcode : 1950Natur.166..568R . doi : 10.1038 / 166568a0 . PMID 14780151 . S2CID 3026278 .